Ciencia y Salud, Vol. VI, No. 3, septiembre-diciembre, 2022 • ISSN (impreso): 2613-8816 • ISSN (en línea): 2613-8824 • Sitio web: https://revistas.intec.edu.do/
DÉFICIT DE 5 ALFA-REDUCTASA. ESTIMULACIÓN PRE-QUIRÚRGICA CON GEL DE DEHIDROTESTOSTERONA EN UN PACIENTE.
Use of dihidrotestosterone cream prior to surgery in a case of 5 alfa reductase deficiency
Cómo citar: . Rosario C, Ovalle R, Morla E, Vargas E, Almánzar R, Mejia A, Suarez S, Rivera L, Burgos M, Vásquez Ruiz AP. Uso de dihidrotestosterona en crema previo a cirugía en un caso de deficiencia de 5 Rivera alfa reductasa. cysa [Internet]. 19 de noviembre de 2022 [citado 18 de noviembre de 2022];6(3):105-9. Disponible en: https://revistas.intec.edu.do/index.php/cisa/article/view/2677
Introducción
La deficiencia de 5 alfa reductasa ha sido descrita en poblaciones con genealogías afines en el sur de la República Dominicana, en el Líbano, en Papúa Nueva Guinea, Turquía y Egipto. Se desconoce su prevalencia, es rara en caucásicos y se incluye entre las enfermedades raras que causan desorden de la diferenciación sexual. (DDS)1-4
Se debe a mutaciones en el gen SRD5A2 que producen una disminución o ausencia de la enzima 5 alfa reductasa, la cual convierte la testosterona en dihidrotestosterona en los genitales externos. Esto afecta desde el feto la diferenciación sexual masculina, provocando expresiones somáticas diferentes según las concentraciones de la enzima alterada5-7.
Presentamos un caso diagnosticado por evidenciar DDS secundario a déficit de la enzima 5 alfa reductasa, al cual le aplicamos dihidrotestosterona local durante un período previo a la cirugía.
Caso clínico
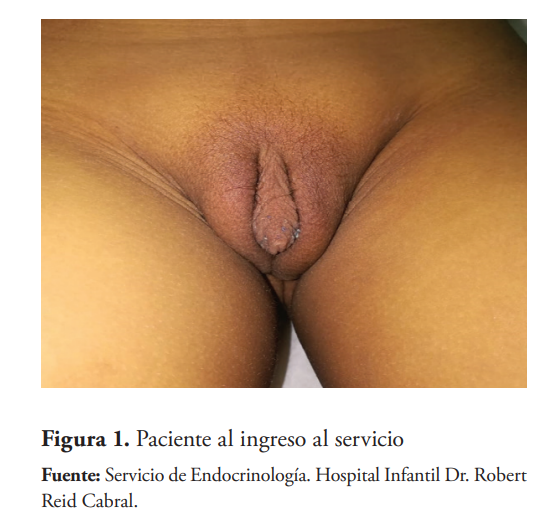
Paciente preescolar que acude a consulta de revisión por presencia de masas en labios mayores bilaterales y ligero crecimiento del clítoris desde el nacimiento. Hay antecedentes de dos primas maternas con anomalías del desarrollo genital. Genitales externos de aspecto femenino, masas bilaterales de 2 ml en labios mayores, clítoris de 2 cm con ligera hipertrofia e introito vaginal. Laboratorios: Cariotipo 46XY, Relación Testosterona/Dihidrotestosterona: 41,25. Ecografía genital: dos estructuras con características de testículos de dimensiones y morfología conservadas. El epidídimo sin alteración, medidas testiculares TD: 1.04 X 1.26 CMS, TI: 0.79 x 1.31 ms. El estudio molecular no estaba disponible.
Se inició terapia con gel de dihidrotestosterona a 0,2 mg/kg diarios en zona genital durante 4 meses y, posteriormente, se realizó genitoplastia masculinizante. Después de 4 meses de aplicación diaria del preparado, se comprobó un crecimiento longitudinal del falo de 4,5 cm y una circunferencia de 4 cm, favoreciendo la reconstrucción o genitoplastia a edades tempranas con mejores resultados.

Discusión
Mutaciones en el gen SRD5A2 es la causa de esta enfermedad, ya que este gen controla la síntesis de la enzima 5 alfa reductasa tipo 2, la cual convierte la testosterona en dihidrotestosterona. Esto altera el desarrollo masculino normal, a pesar de concentraciones normales o elevadas de testosterona.8, 9
El espectro clínico es heterogéneo. A los dos tercios se les asigna el sexo femenino al nacer. Presentan hipospadias posterior, micropene, falo similar al clítoris, escroto bífido, testículos criptórquidos y próstata rudimentaria, aunque podría presentarse como un fenotipo masculino con hipospadia y micropene. La diferenciación de los conductos de Wolff al ser dependiente de la testosterona no se afecta, al igual que la regresión de las estructuras de Müller, que depende de AMH.10
Los hallazgos bioquímicos revelan un aumento en la relación testosterona/DHT después de la estimulación con gonadotropina coriónica humana y una concentración normal de testosterona y hormona anti-Mülleriana. El diagnóstico también se basa en la evaluación de la actividad de la 5-alfa-reductasa utilizando el perfil de esteroides urinarios (relación androsterona/etiocolanolona y 5-alfa-tetrahidrocortisol/tetrahidrocortisol y 5-alfa-tetrahidrocorticosterona/tetrahidrocorticosterona por debajo del límite inferior de normalidad.11, 12
Nuestro caso se presentó con un fenotipo femenino y con la presencia de masas bilateral en los labios mayores, con aumento del clítoris desde el nacimiento e introito vaginal. Como procede de una zona donde es común esta alteración genética, con la relación testosterona/dihidrotestoterona elevada, el cariotipo y el estudio sonográfico establecimos el diagnóstico.
En los casos criados como varones, la principal preocupación es conservar los testículos para la posterior producción hormonal. La crema tópica de DHT se puede aplicar en el área púbica después del diagnóstico. La reparación quirúrgica de la hipospadias debe realizarse entre los 6 y 18 meses de edad.13
Para las pacientes criadas como niñas, el tratamiento puede incluir la corrección quirúrgica de los genitales externos (apertura vaginal en el perineo con separación temprana de la vagina y la uretra), extracción temprana del tejido gonadal para prevenir la masculinización antes de la pubertad, reducción del clítoris (si hay masculinización severa) y terapia hormonal cíclica en la pubertad para el desarrollo de las características sexuales secundarias. La elección del sexo femenino es hoy en día solo una opción en niños xy con deficiencia completa.14-18
El riesgo de desarrollar tumores gonadales es bastante reducido. En los varones afectados no se ha descrito enfermedad prostática. La mayoría de los varones es infértil debido a que la reducida glándula prostática ocasiona la disminución del volumen de semen y ausencia de fertilidad espontánea; sin embargo, las técnicas de reproducción asistida constituyen una opción. La transmisión es autosómica recesiva, por lo que se debe ofrecer consejo genético.
Referencias
- Imperato-McGinley J, Zhu YS. Androgens and male physiology the syndrome of 5alpha-reductase-2 deficiency. Mol Cell Endocrinol, 2002;30(198):51–9.
- Imperato-McGinley J, Guerrero L, Gautier T, Peterson R. Steroid 5α-Reductase Deficiency in Man: An Inherited Form of Male Pseudohermaphroditism. Science, 1974;186(4170):1213-5.
- Imperato-McGinley J, Peterson, RE, Gautier T, Sturla E. Androgens and the evolution of male-gender identity among male pseudohermaphrodites with 5α-reductase deficiency. New England Journal of Medicine, 1979;300(22):1233-7.
- Audi L, Fernández Cancio M, Torán N, Piro C. Anomalías de la diferenciación sexual. Tratado de Endocrinología Pediátrica. (4th Ed.). Ed. M. Pombo et al.; 2009. pp. 583-609.
- Mowszowicz I, Berthauit I, Mestayer C, et al. 5-alphareductases: physiology and pathology. Ann Endocrinol, 1995;56:555–9.
- Kim SH, Kim KS, Kim GH et al. A novel frameshift mutation in the 5alpha-reductase type 2 gene in Korean sisters with male pseudohermaphroditism. Fertil Steril, 2006;85:e9–e12.
- Thiele S, Hoppe U, Holterhus PM, Hiort O. Isoenzyme type 1 of 5-alpha-reductase is abundantly transcribed in normal human genital skin fibroblasts and may play an important role in masculinization of 5-alpha-reductase type 2 deficient males. Eur J Endocrinol, 1966;152:875-80. Disponible en: http://dx.doi.org/10.1530/eje.1.01927 | Medline
- Cohen-Kettenis PT. Gender Changes in 46XY person with 5 α-Reductase-2. Deficiency and 17β-Hydroxysteroid Dehydrogenase-3 Deficiency. Archives of Sexual Behavior, 2005;34(4):399-410. Disponible en: https://pubmed.ncbi.nlm.nih.gov/16010463/
- Azzouni F, Godoy A, Li Y, Mohler J. «The 5 alpha-reductase isozyme family: a review of basic biology and their role in human diseases». Adv Urol, 2012:530121. Doi:10.1155/2012/530121.
- Maimoun L, Philibert P, Cammas B. Phenotypical, biological, and molecular heterogeneity of 5a-reductasa deficiency: an extensive international experience of 55 patients. J Clin Endocrinol Metab, 2011;96:296-307. https://pubmed.ncbi.nlm.nih.gov/21147889/
- Odame I, Donaldson MD, Wallace AM, Cochran W, Smith PJ. Early diagnosis and management of 5 alpha-reductase deficiency. Arch Dis Child, 1992;6:720-3
- Lambert SM, Vilain EJ, Kolon TF. A practical approach to ambiguous genitalia in the newborn period. Urol Clin North Am, 2010;37(2):195-205. https://pubmed.ncbi.nlm.nih.gov/20685548/
- Rodríguez A, Vela A, Grau G, Martínez-Múgica O, Rica Etxeberría I. Anomalías de la diferenciación sexual: decisiones terapéuticas y resultados a largo plazo. En: Dilemas Terapéuticos en Endocrinología Pediátrica. Ed. Pulso; 2014. pp. 57-77.
- Lee PA, Houk CP, Ahmed SF, Hughes IA. Consensus statement on management of intersex disorders. Pediatrics, 2006;118:e488-e5000. https://pubmed.ncbi.nlm.nih.gov/16882788/
- Pasterski V, Prentice P, Hughes IA. Impact of the consensus statement and the new DSD classification system. Best Pract Res Clin Endocrinol Metab, 2010;24(2):187-95.
- Kolesinska Z, Ahmed SF, Niedziela M, Bryce J, Molinska-Glura M, Rodie M, et al. Changes over time in sex assignment for disorders of sex development. Pediatrics, 2014;134:e710-15. https://pubmed.ncbi.nlm.nih.gov/25092939/
- Dacou-Voutetakis C. A multidisciplinary approach to the management of children with complex genital anomalies. Nat Clin Pract Endocrinol Metab, 2007;3:668-9. https://pubmed.ncbi.nlm.nih.gov/17724484/
- Thyn U, Richter-Appelt H, Wiesemann C, Holterhus PM, Hiort O. Deciding on gender in children with intersex conditions: considerations and controversies. Treat Endocrinol, 2005;4:8.

