Introducción
La COVID-19 es la enfermedad causada por el nuevo coronavirus conocido como SARS-CoV-2. La Organización Mundial de la Salud tuvo noticia por primera vez de la existencia de este nuevo virus el 31 de diciembre del 2019, al ser informada de un grupo de casos de «neumonía vírica» que se habían declarado en Wuhan, República Popular China.
En República Dominicana, el Ministerio de Salud Pública confirmó el primer caso de la enfermedad por el Coronavirus en la provincia La Altagracia el 16 de marzo del 2020.
Desde el inicio de la pandemia, se inició una colaboración sin precedentes de investigadores, instituciones gubernamentales y la industria farmacéutica multinacional, logrando desarrollar en tiempo récord vacunas contra la COVID-19 seguras y efectivas.
El gobierno dominicano realizó un esfuerzo extraordinario para tener acceso a las vacunas desarrolladas contra la COVID-19, estrategia primordial para controlar la pandemia y asegurar la salud de los dominicanos. A finales de febrero, concertó un acuerdo con la farmacéutica Sinovac, China, dando inicio al Programa Nacional de Vacunación de RD con la vacuna Coronavac/Sinovac. La Coronavac es una vacuna con virus inactivado. Un estudio realizado en Chile, incluyó 10.2 millones de personas vacunadas con la misma y mostró una efectividad del 65.2-66.6 % de eficacia para la prevención de la COVID-19 y 84.5-87.9 % para prevenir muertes asociadas a la COVID-191.
En diciembre del 2020, la vacuna de Pfizer-BioNTech COVID-19 (BNT162b2) fue aprobada por la FDA para su uso de emergencia en los Estados Unidos, luego que el resultado de su estudio Fase II/III con 43,548 participantes mostró una eficacia en prevenir la infección por COVID-19 en un 95.1 %2. Recientemente, el 23 de agosto del 2021, la FDA aprobó su uso, con el nombre comercial de Comirnaty, asegurando los estándares de seguridad, eficacia y calidad de esta vacuna. La vacuna Pfizer es un nuevo tipo de vacuna ARNm, la cual utiliza ARN genéticamente modificado para generar la producción de una porción de la proteína espiga de la superficie del virus, que por sí sola desencadena una respuesta inmunitaria.
Las vacunas Pfizer llegaron al país a finales de junio del 2021, para ser utilizadas en adolescentes. Sin embargo, el 30 de junio del 2021, el gobierno, en conjunto al Colegio Médico Dominicano y las Sociedades Médicas Especializadas, aprobaron la estrategia de aplicar una tercera dosis de refuerzo. La aplicación sería voluntaria a todos los ciudadanos que hubiesen completado el esquema de dos dosis con la CoronaVac o la vacuna AstraZeneca, también disponible en el país.
Los eventos adversos más comunes reportados en los estudios clínicos de la Pfizer fueron dolor en el sitio de la inyección (84.1 %), enrojecimiento e hinchazón del área de la inyección (9.5 y 10.5 %), fatiga (62.9 %), dolor de cabeza (55.1 %), dolor muscular (38.3 %), escalofríos (31.9 %) dolor en las articulaciones (23.6 %), y fiebre (14.2 %). La linfadenopatía fue otro evento adverso, posiblemente relacionado a la vacuna, que se reportó en 0.3 % de los participantes2.
Desde inicios del 2021, se han publicado varios reportes de casos sobre la presencia de adenopatía axilar y supraclavicular unilateral, posiblemente relacionadas a la vacunación de Pfizer y Moderna mRNA-12733-9. Estas adenopatías se evidenciaron entre las primeras 24 horas y 10 días post vacunación, resolviéndose espontáneamente entre las 4 y 12 semanas. En uno de los estudios citados, se tomaron dos biopsias ganglionares, reportando linfadenopatía reactiva secundaria a la vacunación.7
Hallazgos similares de linfadenopatías también han sido reportados luego de recibir las vacunas contra la viruela, el Bacilo de Calmette-Guerin (BCG), el virus del papiloma humano (VPH) y el virus de la influenza A H1N1.10-12
Este aumento del tamaño de los ganglios es debido a la proliferación de los linfocitos activados por su interacción con las proteínas virales, desencadenando una respuesta de memoria adquirida que generará y mantendrá la respuesta inmune.
En este artículo reportamos un caso de linfadenopatía asociado a la vacunación de refuerzo con la Pfizer, luego de haber completado el esquema de dos dosis de vacunación con la Coronavac/Sinovac.
Descripción del caso
Presentamos paciente masculino de 36 años, sin antecedentes mórbidos conocidos, que acude a revisión ecográfica en la Clínica Profamilia Evangelina Rodríguez. Refiere que al segundo/tercer día de aplicarse la tercera dosis de refuerzo con la vacuna Pfizer-BioNTech, al ajustarse el cinturón de seguridad del vehículo, percibió una molestia en el área supraclavicular izquierda, palpando la presencia de un nódulo. La vacuna de refuerzo fue administrada el 29 de junio del 2021 en el músculo deltoides del brazo izquierdo. Refiere haber recibido la primera y segunda dosis de la CoronaVac el 30 de abril y 28 de mayo del 2021, respectivamente.
Asiste al departamento de Ecografía para su evaluación ocho días después de la vacunación de refuerzo. Se realiza una sonografía con un sonógrafo Mindray DC-60 Exp, X-Insight con sonda lineal multifrecuencial de 14-6 MHz. Se observa cadena ganglionar reactiva, latero cervical izquierda, a nivel del triángulo anterior y posterior, así como supraclavicular, todos los ganglios menores de 1 cm, de morfología oval y redondeada, contornos delimitados, cortical ecogénica y ausencia de hilio vascular en la mayoría de los ganglios. A nivel supraclavicular, en su tercio medio, se observa ganglio anecogénico de morfología oval, midiendo 0.8 cm, con presencia de hilio ecogénico (figura 1). Estos ganglios presentan forma, criterio y hallazgos ecográficos distintivos de adenopatía no patológica13 y son compatibles a los reportados por Granata et al., en las linfadenopatías asociadas a la vacuna Pfizer-BioNTech para la prevención de la COVID 19.9
Al evaluar estas imágenes, y con la historia de una vacunación reciente de Pfizer, se presume que se trata de una linfadenopatía reactiva, secundaria a una respuesta inmune robusta al refuerzo con la vacuna. Se orienta al paciente a regresar en una semana para control ecográfico.
En el seguimiento ecográfico, se observa una remisión espontánea del tamaño y la morfología de los ganglios cervicales y el supraclavicular, hallazgos sugestivos de una remisión clínica normal de la linfadenopatía secundaria a la vacunación de refuerzo (figura 2).
De manera complementaria se realiza una medición de anticuerpos Anti-SARS-CoV-2 TrimericS IgG cuantitativa a los 15 días del refuerzo con Pfizer, reportando una elevada respuesta inmune de 10,600 BAU/mL (se considera resultado positivo > 33.8 BAU/mL).
Discusión
En el estudio clínico de eficacia y seguridad de la vacuna Pfizer se reportó linfadenopatía en un 0.3 % de los participantes (64/21720 vacunados), siendo más frecuente en los adultos menores de 55 años (0.5 %) que en los mayores de 55 años (0.1 %)2. Sin embargo, es probable que la frecuencia de la linfadenopatía sea aún mayor y que haya pasado desapercibida por algunos participantes del estudio, por ende, no reportados.
Una reciente publicación en el Journal of the American College of Radiology, alerta a los radiólogos sobre la adenopatía axilar o supraclavicular unilateral como un efecto secundario temporal provocado por la reciente vacunación (seis semanas previas) con la vacuna de Pfizer, así como con la Moderna10.
Las linfadenopatías pueden ser motivo de preocupación médica. Aunque la causa más común son las infecciones, también pueden tener un origen neoplásico. Estos ganglios inflamados pueden ser palpados por el mismo paciente, así como ser detectados en una consulta médica, o aparecer en una mamografía de una paciente que ha recibido la vacuna contra el virus COVID-19. Se aconseja, por tanto, a médicos y a pacientes vacunados contra COVID-19, que tengan en cuenta la posibilidad del aumento del tamaño de los ganglios linfáticos, así como posible molestia o dolor en el área afectada. Por ello, durante la interpretación de adenopatías unilaterales cervicales, supraclaviculares o axilares, el personal de salud deberá considerar el historial y la fecha de vacunas del paciente, el brazo de la aplicación, así como el tipo de vacuna inyectada. Si es un hallazgo aislado, subsecuente a la reciente vacunación, unilateral y del lado del brazo inyectado, esto deberá interpretarse inicialmente como un hallazgo benigno que no requerirá seguimiento adicional de imágenes, análisis sanguíneos, radiografías, tomografías y mucho menos de procedimientos invasivos como biopsias. La involución ganglionar puede ser evaluada con seguimiento clínico en un periodo de 6-12 semanas.
Conclusión
Las adenopatías cervicales, supraclaviculares y axilares unilaterales están relacionadas a la respuesta inmunológica post vacunación contra la COVID-19. Es de suma importancia informar a la comunidad médica, radiólogos y sonografistas de este hallazgo benigno, para evitar realizar estudios invasivos como las biopsias, seguimientos diagnósticos adicionales e innecesarios, los cuales generan mucha ansiedad al paciente, además de ser muy costosos y estresantes para los mismos. Adicionalmente, es imprescindible orientar y tranquilizar a los pacientes que presenten estas adenopatías.
La difusión de estos hallazgos adquiere más relevancia a medida que aumente el número de personas que reciban su tercera dosis de refuerzo con la vacuna Pfizer-BioNTech COVID-19 (BNT162b2), recientemente aprobada por la FDA/EE. UU. con el nombre comercial de Comirnaty.
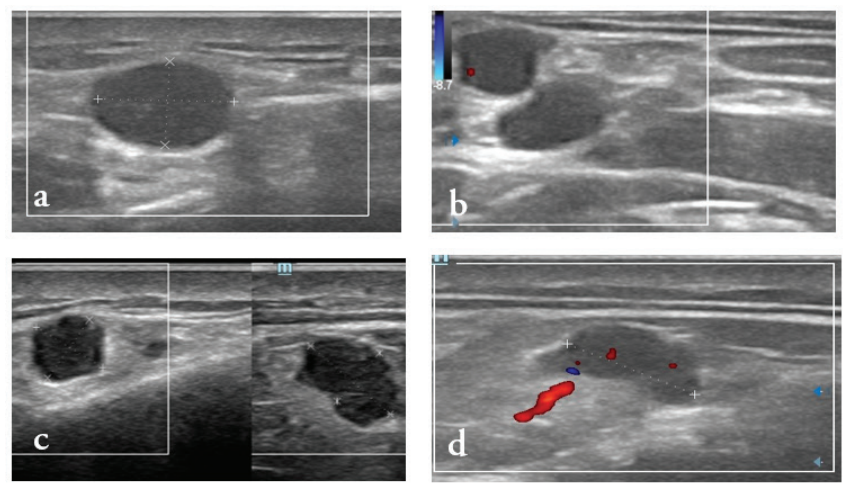
Figura 1. Sonografía realizada a los 8 días post vacunación (5 de julio del 2021). Imágenes realizadas en escala de grises y Color Doppler, con transductor lineal multifrecuencial. (a) Ganglio reactivo de 0.8 cm, de forma oval, bordes delimitados, ausencia de hilio vascular, anecogénico, localizado a nivel supraclavicular izquierdo. (b) Ganglios Cervicales Profundos Izquierdos, de bordes delimitados, redondeado y ovalado, anecogénicos y ausencia de hilio vascular (c) Dos ganglios laterales al margen medial de la Arteria Carótida Común Izquierda, midiendo en su eje largo 0.5 cm y 0.7 cm, respectivamente, de predominio hipoecogénico y ausencia de flujo vascular cortical. (d) Ganglio Paralaríngeo izquierdo, ovalado, bien delimitado y con hilio vascular presente, menor de 1 cm.

Figura 2. Sonografía control a los 15 días post vacunación (14 de julio del 2021): Imágenes realizadas en escala de grises y Color Doppler, con transductor lineal multifrecuencial. (a) y (b) Ganglio supraclavicular izquierdo mostrando disminución en su eje longitudinal midiendo 0.5 cm. (c) Ganglios laterales al margen medial de la Arteria Carótida Común Izquierda, reducidos en tamaño, midiendo el mayor de estos 0.4 cm, de predominio hiperecogénico y ausencia de flujo vascular cortical. (d) Ganglio Paralaríngeo Izquierdo, reducido a 0.5 cm, ovalado, bien delimitado y con hilio vascular presente.

