Ciencia y Salud, Vol. V, No. 3, septiembre-diciembre, 2021 • ISSN (impreso): 2613-8816 • ISSN (en línea): 2613-8824 • Sitio web: https://revistas.intec.edu.do/
SARS-COV-2 Y HEMOGLOBINA: ANÁLISIS ESTRUCTURAL Y PERSPECTIVAS DE LA VIDA REAL
SARS-CoV-2 and hemoglobin: structural analysis and real-life perspectives
Cómo citar:Grullón Rodríguez HM, Céspedes Batista Y, Ramírez Osoria L, Rosario Díaz E, Gutiérrez Martínez AJ. SARS-CoV-2 y hemoglobina: análisis estructural y perspectivas de la vida real. cysa [Internet]. 13 de octubre de 2021 [citado 15 de octubre de 2021];5(3):37-8. Disponible en: https://revistas.intec.edu.do/index.php/cisa/article/view/2309
Introducción
El SARS-CoV-2 apareció por primera vez en diciembre de 2019 en la ciudad de Wuhan, China, debido a una mutación aleatoria que contribuyó al recambio de huéspedes de murciélagos a humanos. Junto a otros coronavirus como el SARS-CoV y el MERS-CoV (coronavirus relacionado con el síndrome respiratorio de Oriente Medio), el SARS-CoV-2 pertenece al orden Nidovirales y a la familia Coronavirinae. Posteriormente, se dividió en dos subfamilias: Letovirinae y Orthocoronavininae. Este virus llevó a la OMS (Organización Mundial de la Salud) a declarar un estado pandémico el 11 de marzo del 2020 debido al brote de COVID-19, la enfermedad causada por el SARS-CoV-2. Los sistemas de salud internacionales se enfrentaron a un desafío debido a la naturaleza infecciosa y letal de este virus; reaccionando con una respuesta rápida, pero ineficaz al tratamiento, evidenciada por la ausencia de terapias que disminuyan la mortalidad. COVID-19 comprende una fisiopatología compleja con un mecanismo celular poco claro; aunque muchas teorías proponen el controvertido papel de la hemoglobina en este proceso como factor de riesgo, diana patológica y mediadora del daño, no hay consenso sobre los resultados clínicos de la interacción COVID-hemoglobina1, 2.
Ha surgido una respuesta académica global, generando evidencia a un ritmo acelerado, que sirve como herramienta para manejar esta enfermedad, con el fin de reducir su impacto en la salud humana3. No obstante, las deficiencias en plausibilidad biológica al explicar los resultados clínicos asociados al COVID-19 muestra la necesidad de investigaciones basadas en la evidencia de estas teorías con un enfoque morfológico y funcional sobre la estructura de la hemoglobina, siendo esta última una parte primordial y dinámica del intercambio de gases con susceptibilidad a una activación excesiva de la cascada inflamatoria causada por COVID-19. Por lo tanto, nuestro objetivo es identificar las implicaciones clínicas de COVID-19 en relación con la interacción SARS-CoV-2 y la hemoglobina, con base en la revisión de la literatura.
Materiales y métodos
La estrategia de búsqueda de literatura digital utilizada para el desarrollo de este artículo fue creada por los autores. Todos los datos y evidencias presentados en este artículo se obtuvieron a través de una búsqueda exhaustiva en bases de datos como PubMed y Google Scholar; con el uso del sistema de tesauros MeSH (Medical Subject Heading) para seleccionar los términos correctos para el tema elegido. Los términos clave incluyeron “SARS-CoV-2”, “hemoglobina”, “hemo”, “porfirina” e “interacción”. Se aplicaron filtros adicionales a la búsqueda como fecha de publicación menor a cinco años, artículos originales y de revisión y disponibilidad de textos completos. Los criterios de inclusión consistieron en artículos originales que discuten la interacción SARS-CoV-2 y hemoglobina. Los criterios de exclusión descartaron toda la literatura de fuente secundaria que no cumpliera con los criterios antes mencionados. Se encontraron un total de 98 artículos, que fueron evaluados en consecuencia en función de la relevancia de la información proporcionada y el objetivo principal. Se eligieron un total de seis artículos originales para este estudio.
Resultados
Tabla 1. Resumen de evidencia sobre los estudios asociados a hematimetría en COVID19
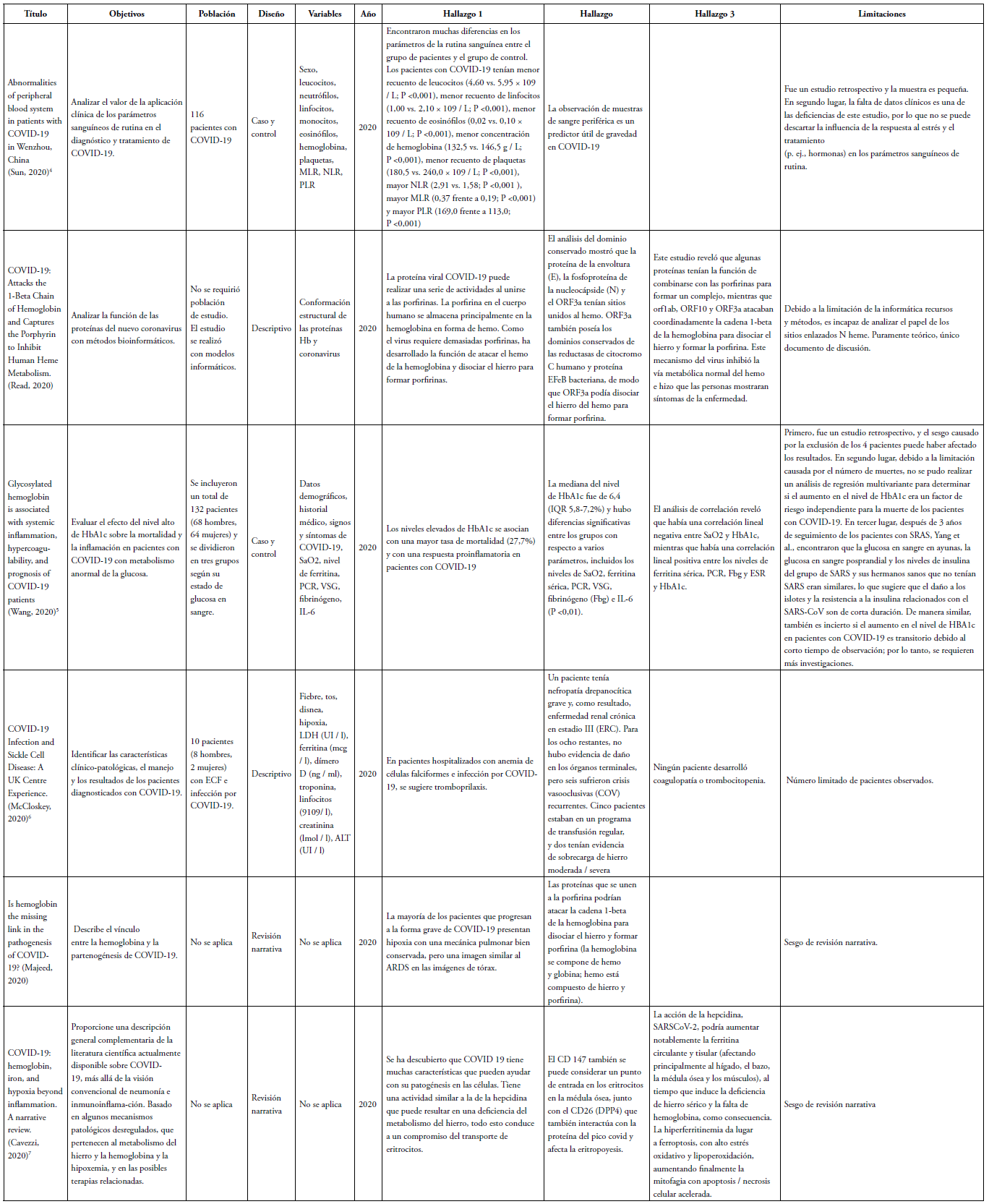
Discusión
Hemoglobina
La hemoglobina se compone de dos estructuras principales: un componente proteico de cuatro globinas y un grupo hemo formado por un anillo de protoporfirina ix con un átomo de hierro en el centro. La protoporfirina ix comprende cuatro anillos de pirrol denominados A, E, O y D en el sentido de las agujas del reloj, unidos entre sí por enlaces de metileno8. Este anillo confiere a la hemoglobina su característico color rojizo 9, 10. El átomo de hierro se encuentra en estado ferroso (Fe2+) que se une al oxígeno (O2), una vez unido, el hierro se oxida al estado férrico (Fe3+); puede coordinar seis enlaces, que permiten la retención del anillo de protoporfirina ix y facilitan los cambios conformacionales cuando O2 se une 11-13.
Las globinas son proteínas esféricas en forma de globo que son cruciales para el transporte correcto de oxígeno a través del torrente sanguíneo. Están formados por ocho hélices alfa nombradas de la A a la H; cada uno con dos extremos, un terminal amino (N) y un terminal carboxilo (C) conectados por segmentos cortos no helicoidales (AB) 14-16. Según la composición o los cambios estructurales de estas hélices, las globinas se designan con letras griegas (α, β, γ, δ, ε, ζ…); si hay más de un tipo de globina dentro de una molécula de hemoglobina, se agrega un subíndice numérico después del símbolo (α1). Existen diferentes tipos de hemoglobinas, cada una con pequeñas variaciones estructurales que dan como resultado propiedades distintivas.
La combinación de globinas da como resultado la gran variedad de hemoglobinas que se conocen hoy en día, algunas relacionadas con patologías o condiciones especiales14, 17, 18. Por ejemplo, la hemoglobina S, presente en la anemia de células falciformes, se caracteriza por la sustitución de un residuo de glutamato por un residuo de valina hidrófobo 13, 19, 20. Relevante para este caso, la hemoglobina adulta (α2β2) es el subtipo más común en humanos, constituyendo más del 97 % en la sangre. Por lo tanto, es muy conveniente utilizar este modelo para comprender la estructura y la fisiología subyacente. La variante α2β2 está compuesta por dos cadenas alfa (141 aa) y dos cadenas beta (146 aa) a las que se añade el compuesto metálico conocido, hemo. Juntas, estas estructuras constituyen la hemoglobina metaloproteica.12, 13, 15, 21-23
SARS-CoV-2
El SARS-CoV-2 es un virus icosaédrico envuelto de 60-140 nm de diámetro con un genoma de ARN monocatenario no segmentado de ~ 30 kb, siendo uno de los genomas de virus ARN más grandes conocidos hasta la fecha. Dos regiones no traducidas (UTR) y 10-14 genes codifican 24-27 proteínas virales. De hecho, los marcos de lectura abiertos (ORF) 1a y 1b constituyen la mayor parte del genoma viral y codifican la poliproteína 1ab (pp1ab) que luego se escinde en 16 proteínas no estructurales (NSPS 1-16), que tienen una amplia gama de funciones en la célula huésped. El genoma restante codifica las proteínas estructurales S (espiga), M (matriz), E (envoltura), N (nucleocápside) y las proteínas accesorias orf3a, orf6, orf7a, orf7b, orf8 y orf10, que median las interacciones intracelulares que se explican más adelante en esta revisión.24-26
Las proteínas codificadas tienen funciones específicas durante todas las etapas del ciclo de vida viral y la patogénesis. Las no estructurales tienen funciones enzimáticas durante el procesamiento del genoma: Nsp1 es un supresor de la inmunidad del huésped, nsp3 es una proteasa similar a la papaína, al igual que nsp5, que es una proteasa similar a 3c, nsp7 y nsp8 forman la primasa, nsp9 tiene unión de ARN / ADN actividad, nsp12 es la ADN polimerasa dependiente de ARN, nsp13 es la helicasa y nsp14 y nsp15 son una exonucleasa 3’-5 ‘y una endoribonucleasa, respectivamente.24, 27 Por otro lado, las proteínas estructurales contienen y protegen el genoma viral para su transporte a su próximo destino al interactuar con macromoléculas del hospedador. Primero, la proteína N es esencial para el procesamiento del ARN viral, permite la unión del genoma viral para evitar la degradación.28 En cuanto a la proteína M, apoya la fusión virión / célula huésped y la formación del virión al interactuar con orgánulos como el aparato de Golgi y el retículo endoplásmico. La proteína E ayuda en el ensamblaje del virión, la gemación y la formación de la envoltura durante la replicación, y también tiene actividad de canal iónico cuando se encuentra como una proteína transmembrana para regular el potencial de membrana mediante el control del flujo de iones.29, 30
Además, las proteínas S son responsables del “efecto corona” del coronavirus. Forman homotrímeros con un extremo N que encierra tres cabezas de unión al receptor (S1) en la parte superior de un tallo del extremo C (S2) que se adhiere a la membrana viral y las proteínas de la matriz. S1 tiene un dominio de unión al receptor (RBD) que reconoce la enzima convertidora de angiotensina 2 (ACE2). El RBD tiene dos conformaciones, estado erguido o estado activado donde la proteína S tiene la mayor probabilidad de interactuar con su receptor, y estado de reposo cuando la interacción del huésped es menos probable, lo que otorga un método eficiente de evasión inmune. Para interactuar con su receptor y fusionarse con la membrana celular, la proteína S debe estar en estado erguido. Para causar este cambio estructural se necesita la activación proteolítica por proteasas del huésped como la proteasa transmembrana, serina 2 (TMPRSS2) y catepsinas lisosomales en el sitio S1/S2. El SARS-CoV-2 contiene una proproteína convertasa (PPC) en el sitio S1 / S2 que se usa para la auto activación, pero este proceso está mediado principalmente por enzimas proteolíticas del huésped.27-31
Interacción Hemoglobina-SARS-CoV-2
Al abordar la evidencia actual de interacción COVID-hemoglobina, muchas referencias establecen una relación de causalidad por determinar entre los niveles de hemoglobina y el estado de un paciente infectado con COVID-19. Un ejemplo de tal premisa es el informe de un caso sobre un hombre de 80 años que mostró una recuperación impresionante a pesar de su edad después de la administración de eritropoyetina (EPO), una hormona que aumenta la producción de glóbulos rojos endógenos (RBC) (y la producción de hemoglobina concomitantemente), disminución de la respuesta inflamatoria y la apoptosis en los pulmones32. Otro informe de caso describe a una mujer de 55 años con hemogramas completos repetidos; inicialmente mostraba niveles disminuidos de hemoglobina y dos semanas después evidenciaba valores de hemoglobina normalizados a medida que mejoraba la condición. Como resultado de esto, los autores plantearon la hipótesis de que esto se debía a la supresión de la eritropoyesis.33 Estos hallazgos concuerdan con las observaciones que describen niveles bajos de hemoglobina4 y anemia normocítica combinada con una reacción leucoeritroblástica34; ambos en pacientes con COVID-19. El análisis de estos casos identifica un eslabón perdido entre el SARS-CoV-2 y la hemoglobina, pero hay más que agregar a tal afirmación. Resultados recientes en modelos de homología molecular evalúan la posibilidad de que COVID-19 ataque la cadena de la 1-beta globina, capturando la porfirina mediante proteínas estructurales y no estructurales para disociarla del hierro. Esta alteración metabólica puede conducir a la acumulación de hierro libre, lo que da como resultado una proteína C reactiva (PCR) elevada, marcador inflamatorio, dejando la porfirina disponible para el virus. Hay muchas teorías que proponen posibles mecanismos por los cuales el SARS-CoV-2 ataca la hemoglobina. Este se une a través de la proteína S a los receptores ACE2 expresados en las células plasmáticas, sintetiza proteínas virales como parte de la replicación viral. Las proteínas como nsp16-nsp10 (orf1ab) ORF3 y ORF10 se secretan junto con anticuerpos, aumentando la disponibilidad de hemoglobina extracelular presente debido a la hemólisis.
El virus también podría ingresar a los glóbulos rojos mediante una interacción entre su proteína S-CD147 con la membrana del eritrocito, obteniendo acceso a la hemoglobina intracelular; una vez disponible, el SARS-CoV-2 podría atacar la oxihemoglobina y la desoxihemoglobina de manera diferente. La oxihemoglobina es atacada primero por orf1ab que se acopla en la cadena α, luego del ataque de ORF3 y ORF10 en la cadena ß. La desoxihemoglobina es atacada por orf1ab en la cadena ß y posteriormente OFR3 y ORF10 atacan la misma cadena ß. Como resultado, la capacidad de transporte de oxígeno de la hemoglobina disminuye y la desoxihemoglobina es menos capaz de transportar dióxido de carbono y glucosa, lo que afecta el control glucémico de los pacientes diabéticos. Los desequilibrios previos conducen a un exceso de inflamación, resultando en dificultad respiratoria y daño orgánico1. A pesar de esto, el Departamento de Hematología de la Universidad de Cambridge encontró que no se ha proporcionado evidencia experimental para confirmar la asociación entre las proteínas SARS-CoV-2 y la cadena 1-beta globina de la hemoglobina. Además, sugieren que el análisis de la búsqueda de dominios funcionales comunes carece de un defecto conceptual en cómo es juzgada la importancia de los hallazgos. De manera similar, al evaluar los resultados de la búsqueda de motivos de secuencia y el modelado molecular de las proteínas del SARS-CoV-2 con hemoglobina, la interacción carece de significancia estadística.35
Aparte de la estructura y las interacciones de la hemoglobina, los distintos tipos de hemoglobina pueden alterar el pronóstico y el tratamiento de un paciente. Un ensayo comparó sujetos diabéticos con niveles variables de HbA1c, asignándolos en distintos grupos dependiendo de la medida de marcadores inflamatorios (ferritina, PCR, interleucinas, TNFα, ESR, LDH, fibrinógeno); mostrando que los casos con HbA1c más baja tenían menos mortalidad y gravedad de la enfermedad.5 Por otro lado, una alteración en la estructura de la hemoglobina, como la anemia de células falciformes, predispondría a los pacientes a disfunciones del bazo y vasculopatía, convirtiéndose los individuos infectados con COVID-19 en un grupo de alto riesgo36. Dichos sujetos son propensos a resultados indeseables debido a una infección concomitante por COVID-19, que conduce a una mayor frecuencia de crisis vasooclusivas6.
Otro punto de relación crucial entre este nuevo virus y los sujetos infectados es el grupo de antígenos ABO. Esta afirmación también se estudió en el pasado con respecto a su predecesor, SARS-CoV-1 y sus asociaciones con el grupo ABO37. La evidencia destaca la correlación entre el SARS-CoV-2 y los grupos sanguíneos, sugiriendo que el grupo sanguíneo A es el de mayor riesgo de infección y el grupo sanguíneo O el más bajo, considerándolo un factor protector. Esta premisa surgió a partir de observaciones realizadas en el hospital presbiteriano de Nueva York y en Wuhan en 2020, fortaleciendo su vigencia. Sin embargo, no encontraron diferencias entre los grupos sanguíneos y la mortalidad por SARS-CoV-2.38-40 Tal afirmación es cierta cuando los pacientes son Rh + 1.38 El mecanismo propuesto actual implica que los grupos O y B, que producen anticuerpos anti-A, bloquean la interacción entre ACE2 y la proteína S de SARS-CoV 41. En el estudio realizado por Zhao et al., descubrieron que la concentración de anticuerpos IgM anti-A del grupo sanguíneo B era significativamente mayor en comparación con el anticuerpo IgG anti-A del grupo sanguíneo O. Dado que ambos isotipos de anticuerpos anti-A son diferentes y menos pacientes del grupo sanguíneo O se están infectando, la conclusión es que la IgG anti-A del grupo O debe considerarse más protectora que la IgM anti-A. 42, 43
Hasta ahora, el acervo de información sobre la interacción hemoglobina-COVID es enorme, pero para obtener conclusiones reales en la toma de decisiones es necesario realizar más estudios experimentales que prueben la validez de tales premisas. El análisis molecular adecuado utilizando modelos in vitro o in vivo tiene más potencial para generar interacciones moleculares precisas para continuar desentrañando los misterios actuales sobre cómo la hemoglobina participa en la patogénesis de COVID-19. Alentamos el escrutinio crítico de cómo las variantes de hemoglobina puedan afectar la forma en que se desarrolla y progresa la infección, como la HbA1c, relacionada con el aumento del estado inflamatorio de los pacientes, especialmente los diabéticos; tal condición puede requerir un protocolo de tratamiento diferente. Las hemoglobinopatías como la talasemia y la anemia de células falciformes son una población de pacientes especial que permanece sin explorar y cuyo estudio tiene el potencial de establecer límites bien definidos al abordar la morbilidad, la mortalidad, la atención clínica y la gravedad de la infección por COVID-19 concomitante a su enfermedad.
Conclusión
El SARS-CoV-2 infecta las células huésped a través de ACE2 para causar COVID-19, produciendo así múltiples efectos sistémicos. Este rasgo pleiotrópico anima a la comunidad científica a investigar diferentes asociaciones fisiopatológicas potenciales del virus. Esta revisión narrativa presenta, con base en la literatura, las posibles interacciones entre el virus y los componentes estructurales de los glóbulos rojos (hemoglobina, grupo ABO). Aunque los mecanismos específicos aún son inciertos, las asociaciones descritas pueden explicar algunas manifestaciones clínicas de los pacientes con COVID-19. Las inferencias proporcionadas en esta revisión pueden inducir hipótesis clínicas y ensayos más sólidos para corroborar o refutar las asociaciones presentadas.
Referencias
- Wenzhong l, Hualan L. COVID-19:Attacks the 1-Beta Chain of Hemoglobin and Captures the Porphyrin to Inhibit Human Heme Metabolism; 2020.
- Majeed A, Shajar MA. Is hemoglobin the missing link in the pathogenesis of COVID-19? Anaesthesia, Pain & Intensive Care. 2020; 7;24(1):9-12.
- Helliwell J, Bolton W, Burke J, Tiernan J, Jayne D, Chapman S. Global academic response to COVID-19: Cross‐sectional study. Learned Publishing. 2020;33(4):385-93.
- Sun S, Cai X, Wang H, He G, Lin Y, Lu B et al. Abnormalities of peripheral blood system in patients with COVID-19 in Wenzhou, China. Clinica Chimica Acta. 2020;507:174-80.
- Wang Z, Du Z, Zhu F. Glycosylated hemoglobin is associated with systemic inflammation, hypercoagulability, and prognosis of COVID-19 patients. Diabetes Research and Clinical Practice. 2020 Jun 1;164:108214.
- McCloskey K, Meenan J, Hall R, Tsitsikas D. COVID‐19 infection and sickle cell disease: a UK centre experience. British Journal of Haematology. 2020;190(2).
- Cavezzi A, Troiani E, Corrao S. COVID-19: Hemoglobin, Iron, and Hypoxia beyond Inflammation. A Narrative Review. Clinics and Practice. 2020;10(2):24-30.
- Gomes A, Neves M, Cavaleiro J. Cancer, Photodynamic Therapy And Porphyrin-Type Derivatives. Anais Da Academia Brasileira De Ciências. 2018;90(1 Suppl 2):993-1026.
- Caughey WS, Ibers JA. Crystal and molecular structure of the free base porphyrin, protoporphyrin IX dimethyl ester. Journal of the American Chemical Society. 1977 Sep;99(20):6639-45.
- Sepúlveda, Vizcaíno P. Estudio de la excreción urinaria de porfirinas por diferentes técnicas analíticas: aspectos cuanti-y cualitativos. Universidad Complutense de Madrid, Servicio de Publicaciones, Madrid, España; 2003.
- Peñuela OA. Hemoglobina: una molécula modelo para el investigador. Colombia Médica. 2005;36(3):215-25.
- Perutz M. Mechanisms Regulating The Reactions Of Human Hemoglobin With Oxygen And Carbon Monoxide. Annual Review of Physiology. 1990;52(1):1-25.
- Thom C, Dickson C, Gell D, Weiss M. Hemoglobin Variants: Biochemical Properties and Clinical Correlates. Cold Spring Harbor Perspectives in Medicine. 2013;3(3):a011858-a011858.
- Berg J, Tymoczko J, Stryer L, Gatto G. Biochemistry. 7th ed. New York: W. H. Freeman and Company; 2012.
- Dickerson R, Geis I. Hemoglobin. Menlo Park, Calif.: Benjamin/Cummings Pub. Co.; 1983.
- Domingues-Hamdi, E., Vasseur, C., Fournier, J., Marden, M., Wajcman, H. and Baudin-Creuza, V. Role of α-Globin H Helix in the Building of Tetrameric Human Hemoglobin: Interaction with α-Hemoglobin Stabilizing Protein (AHSP) and Heme Molecule. PLoS ONE, 2014;9(11): p.e111395.
- Matsuoka M, Fujita A, Kawai Y, Kikuchi T. Similar Structures to the E-to-H Helix Unit in the Globin-Like Fold are Found in Other Helical Folds. Biomolecules. 2014;4(1):268-88.
- Giardine B, Borg J, Viennas E, Pavlidis C, Moradkhani K, Joly P et al. Updates of the HbVar database of human hemoglobin variants and thalassemia mutations. Nucleic Acids Research. 2013;42:D1063-D1069.
- Akinsheye I, Alsultan A, Solovieff N, Ngo D, Baldwin C, Sebastiani P et al. Fetal hemoglobin in sickle cell anemia. Blood. 2011;118(1):19-27.
- Frier, J. and Perutz, M. Structure of human foetal deoxyhaemoglobin. Journal of Molecular Biology, 1997;112(1):97-112.
- Perutz, M. Hemoglobin Structure and Respiratory Transport. (1 ed). Scientific American. 1978;239(6):92-125.
- Shaanan, B. Structure of human oxyhaemoglobin at 2·1 resolution. Journal of Molecular Biology; 1983.
- Rossmann M. Atlas of molecular structures in biology. Vol. 2. Haemoglobin and myoglobin by G. Fermi and M. F. Perutz. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 1982;38(7):2096-7.
- Mousavizadeh L, Ghasemi S. Genotype and phenotype of COVID-19: Their roles in pathogenesis. Journal of Microbiology, Immunology and Infection. 2021;54(2):159-63.
- Bar-On Y, Flamholz A, Phillips R, Milo R. SARS-CoV-2 (COVID-19) by the numbers. eLife. 2020;9.
- Wu Y, Guo C, Tang L, Hong Z, Zhou J, Dong X et al. Prolonged presence of SARS-CoV-2 viral RNA in faecal samples. The Lancet Gastroenterology & Hepatology. 2020;5(5):434-5.
- Smith, E. C., & Denison, M. R. (2012). Implications of altered replication fidelity on the evolution and pathogenesis of coronaviruses. Current Opinion in Virology, 2(5):519–24.
- Oguh C, Obiwulu E, Wisdom O, Uchechukwu O. Structure and Function of COVID-19 Encode Proteins in the Transcription and Replication Mechanism with Its Preventive Measures and Propose Efficacy Treatments: A Critical Systematic Review. 2020;3(1):15-29.
- Boopathi S, Poma A, Kolandaivel P. Novel 2019 coronavirus structure, mechanism of action, antiviral drug promises and rule out against its treatment. Journal of Biomolecular Structure and Dynamics. 2020:1-10.
- Neuman B, Kiss G, Kunding A, Bhella D, Baksh M, Connelly S et al. A structural analysis of M protein in coronavirus assembly and morphology. Journal of Structural Biology. 2011;174 (1):11-22.
- Shang J, Wan Y, Luo C, Ye G, Geng Q, Auerbach A et al. Cell entry mechanisms of SARS-CoV-2. Proceedings of the National Academy of Sciences. 2020;117(21):11727-34.
- Hadadi A, Mortezazadeh M, Kolahdouzan K, Alavian G. Does recombinant human erythropoietin administration in critically ill COVID‐19 patients have miraculous therapeutic effects? Journal of Medical Virology. 2020;92(7):915-8.
- Lu G, Wang J. Dynamic changes in routine blood parameters of a severe COVID-19 case. Clinica Chimica Acta. 2020;508:98-102.
- Mitra A, Dwyre D, Schivo M, Thompson G, Cohen S, Ku N et al. Leukoerythroblastic reaction in a patient with COVID ‐19 infection. American Journal of Hematology. 2020; 95(8):999-1000.
- Read R. Flawed methods in “COVID-19: Attacks the 1-Beta Chain of Hemoglobin and Captures the Porphyrin to Inhibit Human Heme Metabolism”;2020.
- Rees D, Williams T, Gladwin M. Sickle-cell disease. The Lancet. 2010;376(9757):2018-2031.
- ABO Blood Group and Susceptibility to Severe Acute Respiratory Syndrome. JAMA. 2005; 293(12):1447.
- Zietz M, Zucker J, Tatonetti N. Testing the association between blood type and COVID-19 infection, intubation, and death; 2020.
- Li J, Wang X, Chen J, Cai Y, Deng A, Yang M. Association between ABO blood groups and risk of SARS‐CoV‐2 pneumonia. British Journal of Haematology. 2020;190(1):24-7.
- Zhao J, Yang Y, Huang H, Li D, Gu D, Lu X et al. Relationship Between the ABO Blood Group and the Coronavirus Disease 2019 (COVID-19) Susceptibility. Clinical Infectious Diseases. 2020;73(2):328-31.
- Guillon P, Clément M, Sébille V, Rivain J, Chou C, Ruvoën-Clouet N et al. Inhibition of the interaction between the SARS-CoV Spike protein and its cellular receptor by anti-histo-blood group antibodies. Glycobiology. 2008; 18(12):1085-93.
- Gérard C, Maggipinto G, Minon J. COVID‐19 and ABO blood group: another viewpoint. British Journal of Haematology. 2020;190(2).
- Stussi G, Huggel K, Lutz H, Schanz U, Rieben R, Seebach J. Isotype-specific detection of ABO blood group antibodies using a novel flow cytometric method. British Journal of Haematology. 2005;130(6):954-63.

