Ciencia y Salud, Vol. V, No. 2, mayo-agosto, 2021 • ISSN (impreso): 2613-8816 • ISSN (en línea): 2613-8824 • Sitio web: https://revistas.intec.edu.do/
CÉLULAS MADRE MESENQUIMATOSAS Y SUS DIFERENTES USOS
Mesenchymal stem cells and their different uses
Cómo citar: Martínez-Sánchez LM, Vergara-Yanez D, Herrera-Almanza L. Células madre mesenquimatosas y sus diferentes usos. cysa [Internet]. 9 de junio de 2021 [citado 16 de junio de 2021];5(2):45-. Disponible en: https://revistas.intec.edu.do/index.php/cisa/article/view/2211
Introducción
Las células madre (CM) son células no especializadas, capaces de diferenciarse de cualquier célula del cuerpo, estas existen tanto en embriones como en células adultas, las cuales pueden ser totipotentes, que pueden desarrollar estructuras embrionarias y extraembrionarias; pluripotentes, las cuales pueden dar origen a cualquier estructura de las tres capas embrionarias, pero no estructuras extraembrionarias, un ejemplo de esto son las células madre embrionarias; las multipotentes tienen un espectro de diferenciación más reducido que las pluripotentes, en su representación se encuentra la CM hematopoyética, que da origen a varias células sanguíneas; la oligopotente, que tiene actividad más restringida como la célula mieloide y, finalmente, la unipotente, que tiene la actividad más limitada y en este grupo se encuentra, por ejemplo, los dermatocitos, en general se caracteriza por alta tasa de replicación lo que las hace excelentes para medicina regenerativa.1
Estas células son obtenidas principalmente de la médula ósea, sangre periférica y diversos tejidos2, sin embargo, pueden ser derivadas de otras fuentes humanas como de CU o sangre fetal, por ejemplo. Lo anterior, se debe a que las CM de los neonatos cuentan con bajos índices de inmunogenicidad y alta capacidad de diferenciación, mientras que, en el adulto, esta función es más limitada.3,4
Las CM presentes en circulación fetal, tiene altos niveles durante toda la vida uterina hasta el momento del nacimiento y presentan dos características fundamentales que son: su capacidad de autorrenovación, clásico de las CM en general y diferenciarse a múltiples linajes hasta especializarse, en este punto se llaman CM adultas pluripotenciales.5
Según el tipo de manipulación que se le den a la CM, estas pueden ser usadas en trasplantes o como medicamentos en terapias avanzadas, estas últimas se considera para tal fin cuando han sufrido modificaciones importantes o cuando se busca una función que es diferente a la original2.
El Comité de Células Madre de la Sociedad Internacional de Terapia Celular, determinó criterios para clasificar a una célula como CMM, los cuales son: ser adherentes al plástico cuando es mantenido en condiciones de cultivo estándar; expresar antígenos específicos en su superficie; y mostrar potencial de diferenciación celular multipotente in vitro6.
Las CMM tienen forma de huso multipotentes y alta capacidad de autorrenovación, se han posicionado como una gran alternativa terapéutica, pues, aparte de su capacidad de diferenciación múltiple, por medio de efectos paracrinos, promueven la angiogénesis, previene la apoptosis, suprimen la inflamación y modula la matriz extracelular, con lo cual reprimen de cierta manera el sistema inmunológico cuando ocurren lesiones e inician el proceso de reformación tisular7.
Estas son las CM adultas más importantes, las cuales pueden ser aisladas de CU, médula ósea, tejido adiposo, gelatina de Wharton, placenta de tejido cervical, músculo esquelético, líquido amniótico, tejido hepático, pulpa dental, membranas sinoviales, venas safenas, tejidos pulmonares y dérmicos y ligamentos periodontales. 8
Es importante resaltar que el CU es rico en CMM y por medio de su criopreservación al momento del nacimiento del neonato, se puede conservar hasta su futuro uso. 1
La capacidad de diferenciación de las CMM ha dado paso al desarrollo de un sinfín de posibles terapias en diversos tejidos del organismo, los cuales surgen de capas embrionarias como lo son el ectodermo, endodermo y mesodermo. 9,10
El objetivo de este artículo de revisión es precisar datos relevantes acerca de la utilidad, efectividad y seguridad de la terapia con CMM en el tratamiento de diversas enfermedades.
Materiales y métodos
Se revisaron varias publicaciones tales como artículos originales, reportes de caso, revisiones narrativas y sistemáticas en español e inglés, se excluyeron artículos que estaban disponibles en otros idiomas a inglés y español. Se utilizaron las bases de datos Pubmed, Clinicalkey y Science Direct; desde 2013 hasta 2020. Se usaron los términos sangre fetal, células madre, células madre mesenquimatosas, trasplante de células madre de Sangre del Cordón Umbilical y bancos de sangre. Se incluyeron artículos que en su título o resumen evidenciaran un amplio desarrollo de células mesenquimales y sus usos en la actualidad. Con dicha información se redactó un panorama amplio sobre las células mesenquimales y como estas participan en diversas áreas de la salud, con un énfasis importante en sus usos terapéuticos y lo referente a su procedencia.
Discusión
Campos de uso de las CMM
El uso de CMM derivadas de CU ha sido una opción cuando la recolección de estas células no se puede hacer vía sangre periférica o médula ósea; las patologías en las cuales ha sido más frecuente su uso son: leucemia aguda en un 37 %, talasemia o enfermedades de células falciformes en un 29 %, anemia de Fanconi 7 %, trastornos metabólicos, inmunes o metabólicos en 18 %.11
Diferenciación a tejido cartilaginoso
Para lograr la diferenciación condrogénica se puede hacer uso de diferentes compuestos químicos como ácido ascórbico, dexametasona, transferrina, entre otros. Estos compuestos modifican la morfología de una CMM a condrocito, mediante la inducción de factores de transcripción específicos de este tejido, dentro de los cuales destaca el gen SOX9 ubicado en el cromosoma 17q24.3, este es clave, pues promueve la formación de colágeno tipo 9 y el desarrollo condrogénico.12
La capacidad de desarrollo condrogénico a partir de CMM ha permitido realizar estudios acerca de su utilidad para el tratamiento de defectos cartilaginosos como ocurre en la osteoartritis, entre estas se combinan estas células con otros compuestos y se crean componente articulares fundamentales para su adecuado funcionamiento y rehabilitación de los pacientes.13
Diferenciación a tejido adiposo
Para la diferenciación hacia adipocitos, es necesario que las CMM se encuentren en medios de cultivos con factores agonistas de la diferenciación como 3 isobtutil 1 metilxantina, insulina, dexametasona, entre otros. Estos compuestos favorecen el proceso y permiten a las células llenar las vacuolas de lípidos. Durante la diferenciación se promueve la expresión
de factores reguladores como el receptor activado por proliferador de peroxisomas (PPARy), específicamente, y el PPARy2, que se sobreexpresa fundamentalmente en la adipogénesis.12
También el factor temprano de células beta (EBF-1) que induce diferenciación hacia condrocitos y adipocitos y, adicionalmente, el factor de transcripción dedos de zinc 2 (GATA2) que mantiene la diferenciación del linaje de células hematopoyéticas y de otros tejidos para la formación de tejido adiposo.12
Diferenciación a tejido óseo
Para la diferenciación a tejido óseo es necesaria la presencia en el medio de cultivo de B.glicerofosfato, dexametasona, ácido ascórbico y vitamina D3, los cuales inducen la interacción entre hormonas y la síntesis de factores de transcripción para la osteogénesis. 12
Así mismo en situaciones especiales como la hipoxia en médula ósea, se da la diferenciación de las CMM a osteocitos por el factor de unión al núcleo alfa 1(CBF1a) y el factor nuclear kappa beta (NF-kb). 12, 14
Diferenciación a cardiomiocitos
Para el desarrollo de cardiomiocitos a partir de CMM es importante el tratamiento con 5-Azacitidina, el factor de transcripción, en este proceso es el factor de transcripción dedos de zinc 4 (GATA4), el cual se sobreexpresa en las CMM para diferenciarse a cardiomiocitos. Por otra parte, la proteína llamada miocardina tiene una fuerte capacidad de inducir la diferenciación a cardiomiocitos, pues promueve factores de crecimiento, factores de transcripción y genes para el desarrollo. 12
Diferenciación a células endoteliales
Inicia con la modificación de ciertos genes que son claves en el proceso. Entre ellos se ha encontrado que el gen SOX18 es el más relevante, pues es el paso limitante en la diferenciación endotelial, para la diferenciación se puede hacer uso de métodos químicos, moleculares, físicos y mecánicos. 12
Otros usos:
Se ha utilizado en enfermedades infecciosas como el zika y el dengue, las cuales, afectan el sistema nervioso de los fetos durante el periodo de gestación. Con estas células se ha logrado desarrollar células de la microglía, astrocitos e inhibir las vías se señalización para la propagación del virus. 15
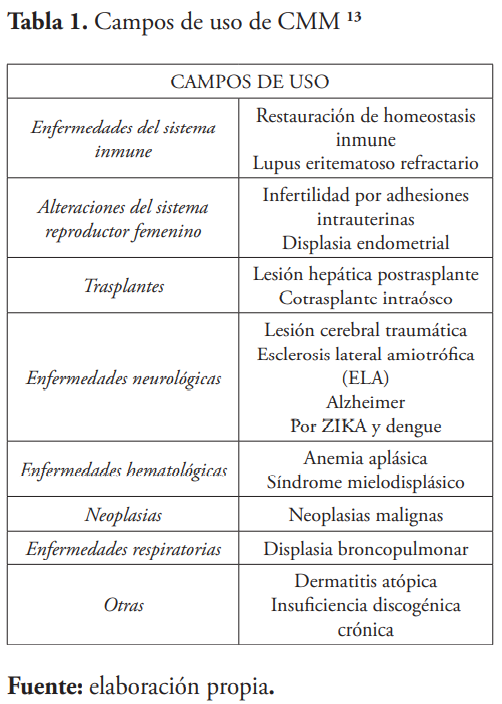
En pocas palabras, son innumerables los campos o tejidos en los cuales se han puesto a prueba la eficacia de las CMM de CU. La terapia con las mismas se basa en dos principios generales: disminución del proceso inflamatorio y la regeneración de los diferentes tejidos haciendo de estos tejidos u órganos completamente funcionales. 13 (Veáse tabla 1)
Métodos y fuentes de obtención de las CMM
Una de las principales fuentes de las CMM es la sangre de CU humano, cuya recolección ocurre durante la emisión de la placenta y membranas fetales, las cuales se conservan con solución salina hasta su procesamiento.3 Entre otras fuentes de CMM se encuentra: el estroma corneal, tejido dental, piel, folículo piloso, amígdalas, medula ósea y células foliculares del ovario.16-18
Por otra parte, el tejido adiposo es un recurso de CMM, ya que, en este caso, se extrae de un paciente sano sin discriminar grupo sanguíneo, se lava, se incuba y luego por una enzima recombinante, se recuperan las CMM y se ponen en un medio de cultivo.19
Luego de obtener las células, se inicia con el aislamiento introduciéndolas en un medio de cultivo en condiciones ideales de almacenamiento, con requerimientos de compuestos, temperatura y tiempo. Posteriormente, se realiza un lavado con fosfato amortiguador para retirar las células que no fueron adheridas. Por último, las células adheridas deben ser separadas, lo cual se realiza con tripsina o colagenasa. 20, 21
Para la visualización de su morfología, se usa un microscopio electrónico de barrido y emisión para poder evaluar la viabilidad que estas potencialmente tendrían. 22
Para asegurar esa viabilidad se implementa una coloración con calceína-ester de acetoximetilo y homodímero de etidio que permite visualizar en un microscopio de barrido de laser focal la cantidad de fluorescencia de las células, la cual se relaciona de manera directamente proporcional con la viabilidad de las mismas.22
Las CMM se caracterizan por expresar marcadores de membrana CD105, CD73 y CD90. 23
Finalmente, para determinar el fenotipo células se realiza una citometría de flujo o, en su defecto, un western blot para identificar y aislar las células correspondientes.20, 21
Por medio de la citometría de flujo se evidencia la presencia o ausencia de marcadores que permite asegurar que las células recolectadas son CMM con la facultad de diferenciarse a múltiples tejidos entre ellos adipocitos, osteocitos, condrocitos, cardiomiocitos, entre otros.3
Efectividad de la terapia con CMM de CU
La ventaja de utilizar como fuente el CU es la posibilidad de obtener las células sin necesidad de biopsias o métodos invasivos para los pacientes, además de la preferencia que muestran las CMM en el proceso de diferenciación y ausencia de mutaciones.24
Debido al uso de esta terapia, en los últimos años se ha podido evaluar la eficacia y la seguridad del tratamiento con CMM derivadas de CU, las cuales han demostrado que, independientemente del sitio de administración, el éxito de estas en cuanto a regeneración o modulación de la inflamación es total. 25
A nivel mundial la eficacia radica en la calidad de los bancos públicos, los cuales son financiados por el gobierno de cada Estado, para almacenar los CU que sean donados; en otras palabras, funciona como una red global de búsqueda de CU. Asimismo, cualquier paciente que lo necesite y sea compatible puede hacer uso de las donaciones del banco, independientemente de quién haya sido el donante, pues no hay disponibilidad o facultad de hacer reservas de CU por asuntos familiares u económicos.11
Estos bancos públicos están dirigidos a cualquiera que lo necesite, pero hace un especial énfasis en poblaciones étnicas y que presenten HLA poco comunes, gracias a la variedad de cordones que llegan a estos centros; por ello deben realizar una exhaustiva revisión y clasificación de las células viables para hacer efectivo.26
Es importante resaltar que el suero que proviene de estas muestras biológicas se adiciona a CMM derivadas de líquido amniótico, lo cual favorece el crecimiento y proliferación celular en los diferentes tejidos u órganos gracias a su composición rica en factores de crecimiento y proteínas.26
Se ha implementado en pacientes con esclerosis múltiple, los cuales mostraron resultados satisfactorios, con ausencia de riesgo contra la vida, cualquier tipo de alergia, meningitis, encefalopatía o convulsiones. Adicionalmente, se confirma la eficacia por medio de pruebas radiológicas, oftalmológicas y una completa evaluación clínica. De este modo, con pruebas de función de miembro superior, miembro inferior y función cognitiva se evidenció una mejoría significativa en un seguimiento a 12 meses tras la aplicación de las CMM.27
En cuanto a la distrofia muscular de Duchenne, se pudo ver que el uso de CMM incrementó los niveles de distrofina permitiendo la regeneración de las fibras musculares que en esta patología se ven disminuidos por la degeneración de sus células, por medio de la fusión de estas nuevas células con las ya existentes en los pacientes. 28
En la penumbra isquémica cerebral, se ha implementado el uso de las CMM diferenciadas hacia adipocitos, no se evidenció la presencia de efectos adversos como necrosis, inflamación, infecciones o crecimiento tumoral; por el contrario, se observó el crecimiento de vasos alrededor de la lesión supliendo, así, la irrigación que previamente se vio afectada por el evento isquémico.29
También estas células han sido utilizadas en mujeres con preeclampsia, en donde han mostrado reducir la apoptosis celular de la placenta e incrementar la vasogénesis; así mismo tuvo un cambio importante en la proteína urinaria en 24 horas y regulación de la presión arterial.30
Finalmente, se realizó profilaxis con esta terapia celular, para pacientes con enfermedades crónicas de injerto contra el huésped, y se observó que fue mucho más efectivo en pacientes pediátricos que en pacientes adultos, determinando que la edad es un factor importante al hacer la evaluación de la eficacia de este tipo de terapias. También se evidenció que los pacientes sometidos a este tratamiento no desarrollaron ningún tipo de infección o respuesta inmune. 31
Pero una gran limitante es que existe un gran desconocimiento médico sobre este tipo de terapia, lo cual se evidenció en una encuesta realizada por la Academia Americana de Pediatría que reveló que el 14 % de los pediatras desconocen este tipo de técnicas o la existencia de los BSCU. 32
Por otro lado, la cantidad de sangre de CU que hay en los bancos privados es tres veces mayor que la existente en los bancos públicos, por lo cual los recursos pueden considerarse escasos para las personas que no tengan cómo pagar y/o que no tengan acceso a bancos privados. 33
Otro aspecto importante en relación a la terapia con CMM es la existencia de los BSCU, los cuales se ha convertido en un gran éxito científico a la hora de disponer de estas células madre. Estos bancos tienen una infinidad de aspectos a tener en cuenta, desde su mantenimiento físico hasta la disponibilidad de células compatibles con cada paciente que lo requiera. En primera instancia hay que considerar la altitud a la cual se encuentran ubicados los bancos, pues en situaciones de hipoxia, es decir, a grandes altitudes, se puede inducir el proceso de eritropoyesis o el crecimiento descontrolado de células malignas. 34
Bancos
Los BSCU representan una eficaz alternativa para el tratamiento de múltiples enfermedades o regeneración de los tejidos deteriorados, esto se debe a la versatilidad del HLA, el cual permite que la diferenciación de las células que de allí se obtienen sea exitoso, con un riesgo bajo de rechazo; entre poblaciones étnicas varían ciertos aspectos de compatibilidad con los diferentes HLA existentes en los bancos, sin embargo, estudios han mostrado que el 95 % de los pacientes de origen étnico tenía 4/6 de compatibilidad con algún HLA de los cordones de los bancos a nivel mundial.35
El primer reservorio o lugar para la contención de los CU fue en Nueva York, Estados Unidos, en 1993 por el Dr. Gordon Douglas; posteriormente fueron enviados algunos cordones umbilicales a Paris para que se realizara por primera vez un trasplante de CMM, de esta procedencia, para el tratamiento de un niño de 5 años con insuficiencia medular secundaria a anemia de Fanconi.33,36 Hoy en día América del Norte cuenta con 28 BSCU y a nivel mundial se encuentran alrededor de 50 con más de 400.000 unidades biológicas.32,37
Se pueden distinguir tres tipos BSCU: los públicos, los cuales reciben donaciones que serán utilizados en terceros; los privados que ofrecen servicios a futuros padres para el almacenamiento de las CM de su futuro hijo y el tipo híbrido, que combina ambas modalidades, es decir, en un principio funciona como privado, pero en cualquier momento los dueños de las células allí almacenadas pueden donarlas a terceros. 38
Asimismo, los padres pueden tomar la decisión de almacenar y/o donar las CMM de CU en cualquier momento del proceso de gestación. Idealmente, debe tomarse en este periodo y no a lo hora del parto o durante los días próximos a esto, pues los padres concentran toda su atención y altos niveles de ansiedad en el neonato, por tanto, la decisión no se tomaría de una manera completamente consciente. Es importante mencionar que los padres tienen total autonomía de elegir determinado banco de sangre de CU, ya sea público, privado o familiar. 39
El propósito específicamente del banco privado es que el dueño de este CU al cumplir la mayoría de edad, sea autónomo de su decisión frente al uso que se le dará a este recurso biológico, sin embargo, la probabilidad que esto sea usado por la misma persona que lo donó es muy remota, por ejemplo, en India es de 1:1000 a 1:20000 casos. 11,33
Por lo anterior, se han desarrollado instituciones y bancos privados donde las familias de los neonatos pueden conservar por años sus CU para futuras terapias. Se ha visto que el trasplante autólogo ha sido eficaz en enfermedades como diabetes tipo 1, para el tratamiento de heridas o úlceras diabéticas, ya que las CMM exhiben alto contenido de colágeno y de factores de crecimiento de fibroblastos que potencian la epitelización y angiogénesis para regenerar el tejido. Adicionalmente, pueden ser utilizadas para la reparación cardiovascular, lesión cerebral traumática, parálisis cerebral, autismo, pérdida de la audición, entre muchas otras.11
Al presentarse como una excelente alternativa de tratamiento para miles de pacientes, la limitante para la progresiva expansión de los BSCU es la escasez de donaciones públicas que se realizan, por lo cual la cantidad de células obtenidas es muy reducida, llegando a obtener tan solo de 100 a 200 ml de células, lo cual en ciertos injertos o terapias implica prolongar el tiempo de realización del tratamiento y haciendo menos efectivo el procedimiento. Respecto a esta reducción en la disponibilidad de los CU, al mercado se ofrece la venta de estos donde los valores oscilan entre 25 000 y 40 000 dólares, precios excesivamente elevados para la clase social media o baja, que por lo general son quienes más requieren de estas terapias con CMM. 11
En los BSCU se tiene una alta estandarización del material biológico allí almacenado, por lo cual cuentan con sistemas computarizados para la búsqueda con las especificaciones necesarias para cada tipo de paciente; y a nivel mundial se cuenta con procesamientos que permiten que la hipoxia marginal o grandes altitudes no afecten la conservación del CU, la extracción del material celular y mucho menos la diferenciación necesaria para las células.11, 34
Conclusión
Las CMM, obtenidas de CU, sangre fetal o médula ósea son una excelente alternativa de tratamiento en enfermedades degenerativas, puesto que tienen la capacidad de diferenciarse y/o restablecer diferentes tejidos. Es por ello que, actualmente, se continúan investigaciones científicas con ellas con la finalidad de profundizar en el conocimiento de sus capacidades, la seguridad de su uso en humanos y en qué poblaciones se obtiene mayor cantidad de beneficios. La efectividad de la terapia dichas células se ha evaluado en enfermedades como esclerosis múltiple, distrofia muscular de Duchenne, isquemia cerebral, preeclampsia, entre otras, en las cuales ha demostrado ser una opción terapéutica que brinda a los pacientes buenos resultados.
Referencias
- Zakrzewski W, Dobrzyński M, Szymonowicz M, Rybak Z. Stem cells: past, present, and future. Stem Cell Res Ther. 2019;10(1):68. Doi:10.1186/s13287-019-1165-5
- Cuende N, álvarez-Márquez AJ, Díaz-Aunión C, Castro P, Huet J, Pérez-Villares JM. El negocio de la medicina regenerativa y las células madre: confusión con implicaciones legales [The regenerative medicine and stem cell business: confusion with legal implications] [published online ahead of print, 2020 Mar 9]. Gac Sanit. 2020;S0213-9111(20)30040-6. Doi: 10.1016/j.gaceta.2019.12.004
- Araújo AB, Furlan JM, Salton GD, Schmalfuss T, Röhsig LM, Silla LMR, et al. Isolation of human mesenchymal stem cells from amnion, chorion, placental decidua and umbilical cord: comparison of four enzymatic protocols. Biotechnol Lett. 2018;40(6):989-98. Doi: 10.1007/ s10529-018-2546-z.
- Wang X, Gao J, Ouyang X, Wang J, Sun X, Lv Y. Mesenchymal stem cells loaded with paclitaxel-poly (lactic-co-glycolic acid) nanoparticles for glioma-targeting therapy. Int J Nanomedicine. 2018;13:5231-48. Doi: 10.2147/IJN. S167142.
- Quesada L, Lázara Y, Fernández S, León CC, Nicolau E, Quinta E. Caracterización morfológica de las células de sangre de cordón umbilical. Rev cubana Hematol Inmunol Hemoter. 2020;36(1):e1090
- álvarez-Viejo M. Mesenchymal stem cells from different sources and their derived exosomes: A pre-clinical perspective. World J Stem Cells. 2020;12(2):100-9. Doi:10.4252/wjsc.v12.i2.100
- Jiang W, Xu J. Immune modulation by mesenchymal stem cells. Cell Prolif. 2020;53(1): e12712. Doi:10.1111/cpr.12712
- Yaghoubi Y, Movassaghpour A, Zamani M, Talebi M, Mehdizadeh A, Yousefi M. Human umbilical cord mesenchymal stem cells derived-exosomes in diseases treatment. Life Sci. 2019;233:116733. Doi: 10.1016/j.lfs.2019. 116733
- Macrin D, Joseph JP, Pillai AA, Devi A. Eminent Sources of Adult Mesenchymal Stem Cells Rev. 2017;13(6):741-56. Doi: 10.1007/s12015-017- 9759-8.
- Yu YB, Song Y, Chen Y, Zhang F, Qi FZ. Differentation of Umbilical Cord Mensenchymal Stem Cells. Mol Med Rep. 2018;18(2):2009- 16. Doi: 10.3892/mmr.2018.9181
- Armson BA, Allan DS, Casper RF. Umbilical Cord Blood: Counselling, Collection, and Banking. J Obstet Gynaecol Can. 2015;37(9):832-44. Doi: 10.1016/S1701-2163(15)30157-2.
- Almalki SG, Agrawal DK. Key transcription factors in the differentiation of mesenchymal stem cells. Differentiation. 2016;92(1-2):41-51. Doi: 10.1016/j.diff.2016.02.005.
- Olson AL, McNiece IK. Novel clinical uses for cord blood derived mesenchymal stromal cells. Cytotherapy. 2015;17(6):796-802. Doi: 10.1016/j.jcyt.2015.03.612.
- Ozkan S, Isildar B, Oncul M, Baslar Z, Kaleli S, Koyuturk M. Ultrastructural analysis of human umbilical cord derived MSCs at undifferentiated stage and during osteogenic and adipogenic differentiation. Ultrastruct Pathol. 2018; 42(3):199- 210. Doi: 10.1080/01913123.2018.1453905.
- Muffat J, Li Y, Omer A, Durbin A, Bosch I, Bakiasi G, et al. Human induced pluripotent stem cell derived glial cells and neural progenitors display divergent responses to Zika and dengue infections. Proc Natl Acad Sci U S A. 2018;115(27):7117-22. Doi: 10.1073/pnas. 1719266115.
- Matthyssen S, Ní Dhubhghaill S, Van Gerwen V, Zakaria N. Xeno-Free Cultivation of Mesenchymal Stem Cells from the Corneal Stroma. Invest Ophthalmol Vis Sci. 2017;58(5):2659- 65. Doi: 10.1167/iovs.17-21676.
- Heo JS, Choi Y, Kim HS, Kim HO. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue. Int J Mol Med. 2016;37(1):115-25. Doi: 10.3892/ijmm.2015.2413.
- Landa-Solís C, Olivos-Meza A, Olivos-Díaz B, Hernández-Rangel A, Cárdenas-Soria VH, Velasquillo-Martínez MC, et al. Behavior of multipotent stem cells isolated in mobilized peripheral blood from sheep after culture with human chondrogenic medium. Tissue Cell. 2018;52:116-23. Doi: 10.1016/j.tice.2018.05.007
- Escobar CH, Chaparro O. Xeno-Free Extraction, Culture, and Cryopreservation of Human Adipose-Derived Mesenchymal Stem Cells. Stem Cells Transl Med. 2016;5(3):358-65. Doi: 10.5966/sctm.2015-0094.
- Wu J, Sun Y, Block TJ, Marinkovic M, Zhang ZL, Chen R, et al. Umbilical cord blood-derived non-hematopoietic stem cells retrieved and expanded on bone marrow-derived extracellular matrix display pluripotent characteristics. Stem Cell Res Ther. 2016;7(1):176. Doi: 10.1186/ s13287-016-0437-6
- Ravishankar P, Zeballos MA, Balachandran K. Isolation of Endothelial Progenitor Cells from Human Umbilical Cord Blood. J Vis Exp. 2017; (127). Doi: 10.3791/56021.
- Agrawal P, Pramanik K, Biswas A. Chondrogenic differentiation of mesenchymal stem cells on silk fibroin: chitosan-glucosamine scaffold in dynamic culture. Regen Med. 2018;13(5):545- 58. Doi: 10.2217/rme-2017-0159.
- Arbos A, Nicolau F, Quetglas M, Ramis JM, Monjo M, Muncunill J, et al. Obtención de células madre mesenquimales a partir de cordones umbilicales procedentes de un programa altruista de donación de sangre de cordón. Inmunología. 2013;32(1):3-11. Doi: 10.1016/j.inmuno. 2012.11.002.
- Gao X, Yourick JJ, Sprando RL. Comparative transcriptomic analysis of endothelial progenitor cells derived from umbilical cord blood and adult peripheral blood: Implications for the generation of induced pluripotent stem cells. Stem Cell Res. 2017;25:202-12. Doi: 10.1016/j. scr.2017.11.004.
- López-Santalla M, Mancheño-Corvo P, Escolano A, Menta R, Delarosa O, Redondo JM, et al. Comparative Analysis between the In Vivo Biodistribution and Therapeutic Efficacy of Adipose-Derived Mesenchymal Stromal Cells Administered Intraperitoneally in Experimental Colitis. Int J Mol Sci. 2018;19(7). Doi: 10.3390/ijms19071853.
- Phermthai T, Thongbopit S, Pokathikorn P, Wichitwiengrat S, Julavijitphong S, Tirawanchai N. Carcinogenicity, efficiency and biosafety analysis in xeno-free human amniotic stem cells for regenerative medical therapies. Cytotherapy. 2017;19(8):990-1001. Doi: 10.1016/j. jcyt.2017.04.004.
- Dahbour S, Jamali F, Alhattab D, Al-Radaideh A, Ababneh O, Al-Ryalat N, et al. Mesenchymal stem cells and conditioned media in the treatment of multiple sclerosis patients: Clinical, ophthalmological and radiological assessments of safety and efficacy. CNS Neurosci Ther. 2017; 23(11):866-74. Doi: 10.1111/cns.12759.
- Dai A, Baspinar O, Yeşilyurt A, Sun E, Aydemir Çİ, öztel ON, et al. Efficacy of stem cell therapy in ambulatory and nonambulatory children with Duchenne muscular dystrophy - Phase I-II. Degener Neurol Neuromuscul Dis. 2018;26;8:63- 77. Doi: 10.2147/DNND.S170087.
- Gómez-Pinedo U, Sánchez-Rojas L, Benito-Martin MS, Lendinez C, León-Espinosa G, Rascón-Ramírez FJ, et al. Evaluation of the Safety and Efficacy of the Therapeutic Potential of Adipose-Derived Stem Cells Injected in the Cerebral Ischemic Penumbra. J Stroke Cerebrovasc Dis. 2018;27(9):2453-65. Doi: 10.1016/j. jstrokecerebrovasdis
- Xiong ZH, Wei J, Lu MQ, Jin MY, Geng HL. Protective effect of human umbilical cord mesenchymal stem cell exosomes on preserving & the morphology and angiogénesis of placenta in rats with preeclampsia. Biomed Pharmacother. 2018;105:1240-7. Doi: 10.1016/j.biopha. 2018.06.032.
- Wang L, Zhu CY, Ma DX, Gu ZY, Xu CC, Wang FY, et al. Efficacy and safety of mesenchymal stromal cells for the prophylaxis of chronic graft-versus-host disease after allogeneic hematopoietic stem cell transplantation: a metaanalysis of randomized controlled trials. Ann Hematol. 2018;97(10):1941-50. Doi: 10.1007/ s00277-018-3384-8.
- Shearer WT, Lubin BH, Cairo MS, Notarangelo LD. Cord Blood Banking for Potential Future Transplantation. Pediatrics. 2017;140(5).Doi: 10.1542/peds.2017 2695.
- Sachdeva A, Gunasekaran V, Malhotra P, Bhurani D, Yadav SP, Radhakrishnan N, et al. Umbilical Cord Blood Banking: Consensus Statement of the Indian Academy of Pediatrics. Indian Pediatr. 2018;55(6):489-94. PMID: 29978816.
- Chandramoorthy HC, Bajunaid AM, Kariri HN, Al-Hakami A, Sham AA, Al-Shahrani MBS, et al. Feasibility of cord blood bank in high altitude Abha: preclinical impacts. Cell Tissue Bank. 2018;19(3):413-22. Doi: 10.1007/s10561-018- 9687-0.
- Stritesky G, Wadsworth K, Duffy M, Buck K, Dehn J. Evaluation of the impact of banking umbilical cord blood units with high cell dose for ethnically diversepatients. Transfusion. 2018;58(2):345-51. Doi: 10.1111/trf.14410.
- Ballen KK, Verter F, Kurtzberg J. Umbilical cord blood donation: public or private? Bone Marrow Transplant. 2015;50(10):1271-8. Doi: 10.1038/bmt.2015.124.
- Souri M, Nikougoftar M, Rasouli M, Golzadeh K, Nakhlestani M, Ezzati N et al. Comparison of human umbilical cord blood processing with or without hydroxyethyl starch. Transfusión. 2017;57(11):2758-66. Doi: 10.1111/trf.14290.
- Mora-Magaña I, Quiroz A, Altamirano MM. Los bancos de células madre de cordón umbilical y su necesidad de regulación en México. BIOETHICS UPdate. 2017;43(1):1-47. Doi: 10.1016/j.bioet.2017.12.001.
- Grieco D, Lacetera N, Macis M, Di Martino D. Motivating Cord Blood Donation with Information and Behavioral Nudges. Sci Rep. 2018;8(1):252. Doi: 10.1038/s41598-017-18679-y
