1. INTRODUCCIÓN
El gas Hidrógeno (H2) es el combustible ideal para el mundo, porque su uso adecuado como tal, reduciría la contaminación del aire, el calentamiento global y el medio ambiente estaría protegido de manera sustentable. El uso conjunto del Hidrógeno y la electricidad, proveen opciones atractivas en la generación de energía y en el transporte. La ínter‐conversión de estas dos formas de energía, sugiere la utilización de Hidrogeno para generar electricidad. El mayor problema en el establecimiento de H2 como fuente de energía en el futuro es la generación renovable y ambientalmente amigable de grandes cantidades de este gas. Aunque el proceso está conceptualmente presente en la naturaleza, necesita ser más investigado, hasta llegar a los niveles de comercialización.
Las investigaciones realizadas hasta el momento revelan que una de las vías de generación de Hidrógeno de manera ambientalmente sostenible es la utilización de algas verdes en presencia de luz. La absorción de la luz por el aparato fotosintético es esencial para la generación del gas Hidrógeno porque la luz facilita la oxidación de las moléculas de agua, liberando electrones y protones y el endergónico transporte de esos electrones a la Ferrodoxina fotosintética facilita el proceso. La Ferrodoxina sirve como donante de electrones a la Ferrohidrogenasa en transporte de Fe/cadena de los cloroplastos de algas verdes.
El aprovechamiento de un proceso que ocurre normalmente en la naturaleza, para generar un combustible que contribuya a la solución de los problemas energéticos, es sin dudas un reto tanto para países desarrollados como en vías de desarrollo.
Presentación del Problema:
La generación de energía a partir de combustibles fósiles ha sido una de las causas principales de contaminación del ambiente tanto del aire, como el agua y los suelos. Durante los últimos tres siglos, la humanidad ha utilizado dichas fuentes de combustible por su abundancia y relativo bajo costo. Sin embargo a partir de la crisis petrolera de 1973, y el agotamiento de las reservas de carbón en muchos países, la generación de energía empezó a impactar seriamente en la economía mundial, en particular en aquellos países no productores de petróleo, que tienen que invertir enormes cantidades de divisas en la adquisición de los hidrocarburos. A esto se suma la gran crisis ambiental de finales del Siglo XX e inicios del Siglo XXI, caracterizada por el agotamiento de los recursos naturales y por el gran impacto que en la naturaleza y en la salud de los seres vivos, genera la producción energética y su consumo para satisfacer necesidades perentorias de la sociedad. Este impacto se ha reflejado en la producción de Gases de Efecto Invernadero (GEI) que han alterado sensiblemente los ecosistemas terrestres y acuáticos, así como cambiado el clima de la tierra, generándose fenómenos tales como el calentamiento global y la desertificación.
La situación antes descrita amerita que los países consideren las posibilidades de nuevas alternativas de generación de energía, que puedan abaratar los costos y que por su bajo impacto ambiental contribuyan al desarrollo sostenible. Este es el caso de la República Dominicana, razón por la cual este problema adquiere una relevancia estratégica.
2. OBJETIVOS:
Determinar en República Dominicana la existencia de microalgas clorofíceas fotolíticas con potencial para la producción anaeróbica de Hidrogeno (H2), en ausencia de azufre, y bajo condiciones controladas de laboratorio.
3. JUSTIFICACIÓN
La Republica Dominicana es un país del Caribe insular con una población de 8,595,000 aproximadamente. En el 2002 la demanda de energía fue de 11,762.6 GWh y se estima un incremento anual de la misma entre un 4.49% y un 7.86%. La capacidad instalada al año 2002 era de 3,003.6 MW, dependiéndose para su generación principalmente de hidrocarburos.
La conjunción e incremento continuo de estos elementos colocaría a la Republica Dominicana , país no productor de petróleo, en la obligación de buscar fuentes o vías alternativas de obtención de energía. La producción de Hidrogeno, por Biofotólisis es una de esas alternativas, sobre todo si se consideran las magnificas condiciones climatológicas que permanentemente reinan en el país; condiciones optimas para el cultivo de cualquier microalga que necesite elevadas temperaturas.
La República Dominicana no es un país productor de petróleo. Sin embargo, en el año 2003 consumió 49.3 millones de barriles, más que el consumo de toda centroamérica. El comportamiento de la factura petrolera en los años 1998 y 2000 destaca la dependencia de la economía dominicana con relación al petróleo. En el 1998 ésta factura representó el 5.3% del producto bruto interno y el 7.3 por ciento del total de las importaciones.
En el 2000, debido al incremento del precio del petróleo a nivel internacional, que alcanzó un tope máximo de treinta y tres dólares (US$33) el barril, la factura petrolera dominicana (1,500 millones de dólares) representó el 11.6 % del PBI y el 13.7% de las importaciones(7).
Estos datos parecen sugerir que si el país no cambia su estructura de consumo de hidrocarburos, no tendrá condiciones para enfrentar variables incontrolables como son las variaciones de ese combustible en los mercados internacionales.
En este sentido, el desarrollo de fuentes alternas de energía, sobretodo aquellas que son renovables, es de gran interés para el país, toda vez que reduciría nuestra dependencia de las importaciones de los derivados del petróleo.
Entre las diferentes fuentes de energías renovables se encuentra el hidrógeno. La tecnología de producción energética a partir del hidrógeno se ha venido desarrollando exitosamente. El uso de este gas como fuente de energía limpia para la generación de electricidad por medio de celdas de combustible se encuentra ya en fase de expansión.
La producción del gas Hidrógeno como fuente alternativa de energía se presenta hoy en día como una opción de gran relevancia por su carácter limpio, libre de contaminación, en contraposición a las fuentes de energía tradicionales basadas en el uso de combustibles fósiles, que generan y vierten anualmente a la atmósfera millones de toneladas de emisiones gaseosas contaminantes como son los gases de efecto invernadero, tales como Dióxido de Carbono(CO2), Monóxido de Carbono (CO); Metano (CH4), Óxidos de Nitrógeno (NOx); y Dióxido de Azufre (SOx).
En adición a los problemas de tipo ambiental, se encuentran los de índole económica relacionados con la importación de los combustibles, significando un alto costo en divisas para los países no productores de petróleo, como es el caso de la República Dominicana. Una de las ventajas de la producción de Hidrógeno es que el producto final de su combustión es agua, en lugar de gases del Carbono, Azufre o Nitrógeno; que es transportable (relación peso por unidad de energía es muy baja, a diferencia de las baterías eléctricas) y que se produce a partir de radiación solar.
El desarrollo de un proceso tecnológico práctico para la producción de hidrógeno a partir de luz, agua, dióxido de carbono y algas (producción fotobiológica), está llamado a convertirse en la mayor fuente biológica de energía renovable y sustentable, sin emisiones de gases de efecto invernadero, ni contaminación ambiental.
En la actualidad, la producción de Hidrógeno se realiza a partir de combustibles fósiles, una tecnología no sostenible. Por tal motivo, la producción fotobiológica surge como una alternativa económicamente viable.
De acuerdo con un análisis de costos publicado en enero del 2004 por el National Renewable Energy Laboratory, el futuro precio de venta estimado del hidrógeno usando la tecnología fotobiológica se encuentra entre $0.57/kg y $13.53/kg, dependiendo de las características del sistema de producción, almacenaje y distribución.
Sin embargo, la producción de Hidrógeno a través de algas verdes fotolíticas plantea una serie de interrogantes e incógnitas relativas al desarrollo de reactores biológicos; de explotación a alta escala (miles o millones de hectáreas); de modificaciones genéticas para mejorar eficiencias (después de todo, las algas buscan su desarrollo mientras que para esta tecnología su desarrollo es totalmente innecesario) y de validación de los conocimientos científicos y empíricos pertinentes a la fotosíntesis en condiciones extrañas a la operación típica de estos microorganismos.
El punto de partida de todo esto se encuentra en las especies a ser usadas. Las especies nativas han de ser siempre preferidas a las importadas, debido a la cantidad de factores extraños que se evitan (introducción de especies invasoras, tolerancia a los factores ambientales, etc...). En este sentido, el presente proyecto procura sentar las bases biológicas en la República Dominicana para el desarrollo de la tecnología de producción de hidrógeno como fuente de energía renovable, a través de la identificación de la existencia de algas verdes con potencial para la producción fotobiológica de Hidrógeno.
En este sentido, el presente proyecto procura iniciar las bases biotecnologicas para la producción de hidrogeno como fuente de energía renovable en la Republica Dominicana, a través de la identificación y cultivo de algas clorofíceas (verdes) con potencial para la producción fotobiológica de Hidrogeno.
4. ANTECEDENTES BIBLIOGRÁFICOS
Seibert et. al(1) y Ghirardi M et al(2) abordaron diferentes métodos de utilización de algas en la producción de Hidrógeno. Wade Amos(3) destacó la producción de Hidrogenasas por parte de las algas verdes evaluando los costos de un proceso de producción de Hidrógeno por esta vía. Ghirardi et. al(4) y Happe(5) destacaron la importancia de la presencia de la luz en la producción de hidrógeno mediante algas verdes. La mayor parte de las Hidrogenasas (enzimas importantes en la producción fotobiologica del H2) se encuentran en Archaea y Bacteria, pero algunas están presentes en Eucarya también. Estas enzimas suelen ser agrupadas en tres clases: [Fe]-H2asas, [NiFe]-H2asas, y las H2asas metal‐libre, según el tipo de núcleo catalítico de la enzima. La gran mayoría de las H2asas conocidas pertenecen a las primeras dos clases, y más de 100 de estas enzimas han sido caracterizadas genética y/o bioquímicamente. Por su parte Vignais PM, Billoud B, y Meyer J.(6) señalan que Las hidrogenasas (H2-asas) son enzimas que catalizan la oxidación reversible del hidrógeno molecular y desempeñan un papel central en el metabolismo energético microbiano. Janssen et. al(8) propusieron en el año 2000 diseños de fotobioreactores (reactores en que se desarrollan reacciones biológicas controladas, que son cerrados pero que permiten la interacción del material biológico con radiación luminosa) más eficientes para la obtención de biomasa con rendimientos que bordean el 10 % en términos de la energía radiante recibida versus la expresada como hidrógeno.
Durante la década de los Noventa se realizaron significativos avances en este campo, tanto en la caracterización bioquímica de los microorganismos que producen hidrógeno; bajo condiciones adecuadas (anaerobiosis y separación temporal en la producción de oxígeno e hidrógeno), como en el manejo fisiológico de los cultivos. Destacada importancia han tenido los planteamientos de Melis y sus colaboradores en el año 2000 (09), así como los aportes de Ghirardi M.L.et. al, (10) y los de Wykoff, D.D. et.al.1998 (11).
Desde que Gaffron y Rubin(12) descubrieran hace más de 60 años, la habilidad de las algas unicelulares de producir H2 (gas Hidrógeno) a través de la iluminación, la producción fotobiologica ha sido considerada hasta hace poco, como una curiosidad biológica.
Históricamente se conoce la producción de Hidrógeno en las algas verdes producto de la respiración anaeróbica en la luz, a través de los descubrimientos de Greenbaum en 1982(13), Roessler y Lien(14) en 1984 y de los aportes de Happe y Naber en 1994(5). De acuerdo a estos diferentes estudios, una enzima, la hidrogenasa se expresa bajo tales circunstancias y cataliza la producción de H2. Tanto Adams(15), como Meyer y Gagnon(16) investigaron la forma monomérica de la enzima, la cual pertenece a la clase de las ferrohidrogenasas, determinándose que ésta es codificada en el núcleo del alga unicelular, en tanto que la localización y funciones de la proteína se encuentran en el estroma del cloroplasto.
Otros trabajos similares fueron llevados a cabo por Van den Hoek(17), Bourelly(18), Fox(19) y Ghirardi(20). Recientemente Melis, Melnicki y Matthew(21) han trabajado en el desarrollo de procesos que permitan optimizar la producción de Hidrógeno tanto a través del uso de algas como de bacterias. Sobre el mecanismo de transporte fotosintético de electrones en ausencia de nutrientes se destacan los aportes de Dennis D. Wykoff y colaboradores(22). Por su parte Tsygankov, Kosourov, Tolstygina, Ghirardi y Seiber(23) demostraron que la fotoproducción sostenible de H2 a través de algas verdes del género Chlamydomonas reinhardtii en ausencia de azufre es posible bajo condiciones estrictamente autotróficas en ausencia de acetato o de cualquier otro sustrato orgánico en el medio de cultivo. Sobre la necesidad de un fotosistema para el crecimiento autotrófico, la fijación de CO2 y la fotoproducción de H2, Redding y colaboradores(24) realizaron un aporte de extraordinaria importancia.
Marco teórico o conceptual
En la actualidad la producción de hidrógeno a partir de reacciones fotosintéticas se ha verificado en dos tipos de organismos, a saber:
- Microalgas fotoautótrofas
- Cianobacterias
Microalgas fotoautótrofas
La producción de hidrógeno por microalgas fotoautótrofas se basa en la utilización de la energía solar para la fotodisociación del agua y la consecuente transferencia de los electrones a través de una cadena transportadora, ubicada en estructuras llamadas Tilacoides, tanto para cianobacterias como para microalgas. En la membrana de estas estructuras está la serie de proteínas y compuestos que en último término transportan los electrones desde el agua hacia moléculas como NADH (Dinucleótido de Adenina y Nicotinamida) y el H2.
Esta transferencia de electrones hacia la enzima reversible Hidrogenasa, reduce los protones del hidrogeno, oxidando a la ferrodoxina, que pasa de su estado reducido al estado oxidado.
Se ha confirmado que bajo ciertas condiciones de limitación de nutrientes, con un medio libre de azufre (como sulfato) y en condiciones anaerobias, algunas microalgas como Chlamydomonas reiinhardtii son capaces de producir hidrogeno de manera sostenida en el tiempo(9).
Cianobacterias
Las cianobacterias son organismos con una talla que se sitúa de manera general entre 1 y 10 micras. Su pared es de tipo gram‐negativo clásico. Son verdaderas procariotas (organismos desprovistos de membrana nuclear), a pesar de su sistema fotosintético cercano del de las eucarióticas ya que contienen clorofila‐a y un fotosistema ii (PS-ii). A este grupo pertenecen bacterias de los géneros Spirulina, Arthrospira, Clostridium, Chromatium, entre otras.
Es interesante notar que la cianobacteria no tiene organelos celulares y toda la maquinaria fotosintética estará ubicada en estructuras como tilacoides. Esto puede ser una ventaja en el momento de la difusión del oxigeno y el hidrógeno.
5. METODOLOGÍA
El primer paso para la realización de este estudio fue la revisión bibliográfica, tanto impresa como electrónica, con el fin de conocer los métodos más adecuados para el cultivo de las algas y la selección del mejor medio de cultivo. Luego se procedió a la identificación de posibles lugares, en la periferia de la ciudad, con posibilidades para la recolección de las muestras en cuerpos de agua corrientes (Ríos Ozama, Isabela, y en aguas de escorrentía urbana en la ciudad de Santo Domingo) con evidencia o posibilidades de presencia de algas.
5.1 Muestreo:
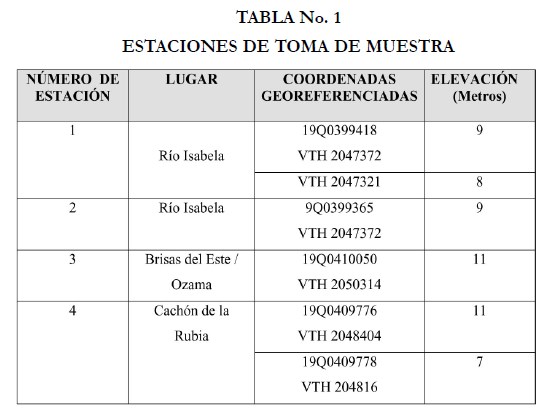
Las muestras de agua se colectaron en envases estériles de boca ancha, y se trasladaban al laboratorio en un plazo de una a dos horas después de colectadas a fin de evitar la muerte de los microorganismos por anoxia o por maltrato físico producto del traslado. Las muestras se dividieron en dos partes de 50 ml cada una, antes de ser trabajadas. Una parte era filtrada en papel de filtro para observación e identificación de los microorganismos y microalgas colectadas, y la otra parte se reservaba para el cultivo. Las estaciones seleccionadas para la toma de muestras se muestran en la tabla No. 1:
5.2 Identificación de las muestras
La identificación se inicio observando al microscopio las muestras previamente filtradas con papel de filtro marca Whatman, No.1. Se colocó gota a gota la muestra en un portaobjeto, con su correspondiente cubreobjeto, y se observaron en un microscopio Marca Leica‐Gallen iii, con aumentos de 4x, 10x, 40x y 100 X con aceite de inmersión. Los organismos observados se identificaron con claves de identificación de algas contenidas en la sección 110900D de la edición 17 del Standard Methods de la AWWA(29) y en la bibliografía citada.
5.3 Medios de Cultivo
De los medios de cultivo evaluados, el que presentó mayor potencialidad para el cultivo de algas, siendo seleccionado, fue el Medio TAP (Tris –Acetato Fosfato) por ser el más recomendado en las bibliografías consultadas, por su facilidad de preparación y obtención de sus componentes en el país. (Ver anexos).
5.4 Cultivo y aislamiento de las algas
Las muestras colectadas, fueron sembradas en medio de cultivo TAP, sólido y liquido. El medio de cultivo sólido se preparo añadiendo 15 gr. de Agar por cada 1,000 ml de solución de TAP previamente esterilizada y luego vertida en placas de Petri estériles hasta su solidificación. Para el medio de cultivo líquido se disolvieron los reactivos correspondientes del TAP según la fórmula, en 1000 ml de agua bidestilada y se procedió a esterilizar, dejando el uso según demanda de medio de cultivo.
Las muestras se sembraron en placas de Petri, bajo condiciones de esterilidad total tanto de las agujas como de las asas, según el método de siembra estría por agotamiento utilizado comúnmente en el manejo de cultivos bacteriológicos, se colocaron por espacio de tres días bajo iluminación constante de 2,000 lux, para el crecimiento y concentración de la densidad poblacional.
Pasado este periodo, se procedió a su aislamiento, observación, caracterización e identificación y resiembra. La identificación se realizó observando las características macroscópicas de las colonias y posteriormente en el microscopio. Para la identificación macroscópica de las colonias se tomaba en cuenta la forma, bordes, elevación y el color.
Se hicieron 2das y 3ras resiembras de los cultivos para aislar las colonias y provocar el desarrollo de cultivos axénicos (puros). Las resiembras se realizaron en medio de cultivo sólido y en medio de cultivo liquido, en volúmenes de 50, 100 y 200 ml, colocados en erlenmeyers esterilizados, con tapones de gasa estéril.
Estos cultivos se mantuvieron bajo condiciones de iluminación y temperatura constante (2000 luxes y de 25‐27° C). Se lograron aislar y se mantuvieron con siembras y resiembras de mantenimiento cultivos de los Géneros Chlamydomonas (2 especies), Chlorella y Closterium.
5.5 Selección de las muestras
Durante las observaciones microscópicas realizadas se observaron 17 especies de algas, pertenecientes a 15 géneros. Se seleccionaron tres de los géneros que presentaron mayores facilidades para su cultivo y mantenimiento. Estos fueron: Chlamydomonas, Chlorella y Closterium. Los géneros de algas verdes encontradas fueron los siguientes:
Géneros de Algas Verdes:
- Chlamydomonas
- Chlorella
- Chlorococum
- Anacystis
- Closterium
- Euglena
De las algas encontradas se seleccionaron y se aislaron para darle continuidad al estudio los géneros Chlamydomona, Chlorella y Closterium, por ser estas las más fáciles de reproducir y mantener los cultivos.
5.6 Iluminación
La iluminación fue constante y permanente, las 24 horas. Se realizó mediante la colocación de un conjunto de lámparas fluorescentes (12 unidades) con una iluminación total, de 2000 lux. La permanencia de la energía eléctrica se aseguró con la instalación de un inversor o sistema de almacenamiento de energía de 1.5 kilowatts, con 2 baterías de ciclo profundo de 6 voltios marca Trojans.
5.7 Parámetros Físico‐Químicos
Los parámetros físico‐químicos fueron controlados en la investigación, tomándose en horas matutinas. Estos parámetros fueron tomados con un medidor multiple, YSI Instrument, Modelo 550 A. Se tomaron los parámetros de Oxigeno Disuelto (mg/l), pH, Salinidad (%o), Temperatura (C) y Luz (lux).
- Luz: fuente artificial de lámparas fluorescentes de luz blanca. Fue medido con Luxómetro Marca Extech Instrument, Modelo 401025
- Temperatura: tomada con termómetro manual con rango de 0 a 40°C
- pH: tomado, con pH‐Metro Marca Thermo‐Orion modelo 210
- Salinidad: tomada, con YSI 550 A
- Oxigeno disuelto: tomado, con YSI 550 A
- Otras observaciones adicionales fueron tomadas en cuenta, tales como, presencia de protozoarios u otros microorganismos presentes. En los casos de microorganismos se procedía a eliminarlos con Mebendazol.
5.8 Generación de Hidrógeno (H2)
Una vez culminado el proceso de selección de las muestras se procedió a la segunda etapa o producción de Hidrógeno. Esta etapa consiste en la producción de Hidrógeno por las algas bajo las condiciones de ausencia de Azufre en forma de Sulfato. El Hidrógeno producido fue recogido en tubos de ensayo invertidos. Las especies seleccionadas son las que mostraron mejores cualidades y condiciones para la producción de Hidrógeno. Previo a la generación de Hidrógeno se midió el contenido de Azufre en forma de Sulfato al inicio y tras un período de 72 horas, en el cual las algas habrían consumido todo el Azufre presente, se determinó de nuevo el contenido de Azufre para garantizar que su ausencia fuese total en el medio de cultivo. Al llegar a ese punto las algas inician la descomposición del agua generando Oxígeno e Hidrógeno. El Hidrógeno producido se recoge en un tubo de ensayo que contiene una solución de Permanganato de Potasio (KMnO4 ), la identificación de la presencia de Hidrógeno tiene lugar a través del método de Reducción de Permanganato de Potasio (KMnO4) a Ión Manganeso ii (Mn +2)(25) el cual se presenta a continuación:
Se hace burbujear el gas proveniente del cultivo de algas en un tubo de ensayo conteniendo una solución 0.001M de KMnO4 acidificada con HCl. El gas H2, reductor fuerte, produce la reducción del permanganato a ion Mn +2 (color rosado pálido) según la siguiente reacción:
MnO4-1 (AC) + H 2(G) ? Mn +2(AC) + 4H 2O
En el fondo de los tubos se observa un precipitado negro debido a que parte del MnO 4 -1 se reduce a Mn +4 el cual prácticamente no forma iones sino que precipita MnO 2.H2O, de color negro. Se descarta que fuera un sulfuro porque estos no precipitan en medio acido.
6. MATERIALES Y EQUIPOS
Equipo para Irradiación de luz; Botellas de recolección de muestras; Refrigerador; Medios de cultivos especiales para algas; Cristalería / utensilios de laboratorio -Bolsas plásticas de cultivo; Redes de Plancton; Microscopios; Ph‐Metro; Luxómetro; Medidor de Oxígeno Disuelto y Salinidad; Botellas de Roux.
7. RESULTADOS:
Se logró la producción exitosa de Hidrógeno en tres especies de algas, una del género Chlorella y las otras dos del género Chlamydomonas. El tiempo transcurrido entre la evidencia de ausencia de Azufre y la producción de Hidrógeno fue inferior a 48 horas para la Chlorella vulgaris, en tanto que para la Chlamydomonas angustae fue inferior a las 72 horas y finalmente la Chlamydomonas reinhardtii lo generó al cabo de 72 horas. La generación de Hidrógeno se produjo en un rango de temperatura de 25 a 32 Grados Centígrados. En la tabla No. 2 se presenta la relación de especies y sus tiempos de producción.

Cabe destacar la gran tendencia de estas especies a contaminarse, razón por la cual se hace necesario tomar medidas extremas de seguridad en el laboratorio para garantizar que el proceso pueda tener lugar sin la presencia de elementos extraños que alteran la capacidad de generación de Hidrógeno.
La especie Chlorella vulgaris resultó ser la más rápida en la producción de Hidrógeno, ocurriendo el proceso antes de 48 horas, en tanto que la Chlamydomonas angustae y la Chlamydomonas reinhardtii consumieron mayor tiempo, generando el Hidrógeno antes de o en 72 horas respectivamente.
8. CONCLUSIONES:
- Se identificaron tres especies de algas clorofíceas (verdes) en la República Dominicana con capacidad de fotoproducción de Hidrógeno en ausencia Azufre, las cuales son Chlorella vulgaris, Chlamydomonas angustae y Chlamydomonas reinhardtii. Todas presentes en cuerpos de agua naturales del país, lo que facilita su obtención y manejo.
- Una de las algas produjo Hidrógeno antes de 48 horas de la supresión de Oxígeno, otra antes de 72 horas y la tercera a las 72 horas.
- La generación de Hidrógeno tuvo lugar en un intervalo de temperaturas entre 25 y 32 Grados Centígrados.
- Existe en la República Dominicana la posibilidad de generar Hidrógeno a partir de algas verdes fotolíticas, lo cual sería una fuente alternativa importante de generación de energía.
Agradecimientos: Agradecemos a la Unión de Universidades de América Latina (UDUAL) y al Instituto Tecnológico de Santo Domingo (INTEC) el financiamiento de la presente investigación que fue galardonada con el Premio UDUAL de Apoyo a la Investigación 2004, en la categoría de Ciencia y Tecnología.
9. BIBLIOGRAFÍA
1. Michael Seibert, Paul King, Liping Zhang, Lauren Mets*, and Maria Ghirardi. 2002. Molecular Engineering of Algal H2 Production. Proceedings of the 2002 U.S. DOE Hydrogen Program Review NREL/CP‐610‐32405
2. Maria L. Ghirardi, Sergey Kosourov, Anatoly Tsygankov1, Andrew Rubin2 and Michael Seibert. 2002. Cyclic photobiological algal H2 production. Proceedings of the 2002 U.S. DOE Hydrogen Program Review NREL/ CP‐610‐32405
3. Wade A. Amos 2004. Updated Cost Analysis of Photobiological Hydrogen Production from Chlamydomonas reinhardtii Green Algae. Milestone Completion Report. January NREL/MP‐560‐35593.
4. Maria L. Ghirardi and Michael Seibert 2003 Algal Hydrogen Photoproduction. National Renewable Energy Laboratory, Golden, CO. Program Review Meeting Berkeley, CA
5. Happe, Thomas. Induction, localization and metal content of Hydrogenases in the Green Alga Chlamydomonas reinhardtii. Eur J. Biochem 222 p 769774
6. Vignais PM, Billoud B, Meyer J. 2001. Classification and phylogeny of hydrogenases. FEMS Microbiol Rev. 2001 Aug; 25(4):455‐501. En.
7. Peña Taveras, Marino S. 2003. Perspectivas del Sector Eléctrico Dominicano. xix Congreso Panamericano de Energía Mecánica, Eléctrica, Industrial y Ramas Afines, COPIMERA 2003. Santo Domingo, República Dominicana
8. Janssen, M.; M., Winter; M., Tramper; J. Mur; L. Snel; J. Wijffel, Journal of Biotechnology, (2000) Vol.78, 123‐137.
9 Anastasios Melis; Liping Zhang, Marc Forestier, Maria L. Ghirardi, and Michael Seibert “Sustained Photobiological Hydrogen Gas Production upon Reversible Inactivation of Oxygen Evolution in the Green Alga Chlamydomonas reinhardtii” Plant Physiol, January 2000, Vol. 122, pp 127‐136
10. Ghirardi, LM., Huang, Z., Forestier, M., Smolinski, S., Posewitz, M. and Seibert, M., (2000), Proceeding of the 2000 DOE Hydrogen Program Review, NREL/ CP‐570‐28890.
11. Wykoff, Dennis D.; John P. Davies, Anastasios Melis; Arthur R. Grossman The regulation of photosynthetic electron transport during nutrient deprivation in chlamydomonas reinhardtiiPlant Physiology, 1998, Vol. (117), pp 129‐139.
12. Gaffron H.; J. Rubin Fermentative and photochemical production of Hydrogen in algae Journal of General Physiol 26, 219‐240.
13. Greenbaum, E. Photosynthetic Hydrogen and Oxygen production: Kinetic studies Science (1982) 196, 879‐880
14. Roessler P.G. ; S. Lien Activation and Novo Synthesis of hydrogenase in Chlamydomonas Plant Physiol (1984) 76, 1086‐1089
15. Adams M. W.W The structure and mechanism of iron‐hydrogenases Biochim Biophys Acta (1990)1020, 115‐145
16. Meyer J. ; J. Gagnon Primary structure of hydrogenase I from Clostridium pasterianum Biochemistry (1991) 30, 9697‐9704
17. Van Den Hoek, ; D. G. Mann and H.M.Jahns. “Algae, an Introduction to Phicology”. 1995. Cambridge University Press. 1th Edition.
18. Bourrelly, Pierre. Les Algues d’eau douce . Tome I. Les Algues Vertes. Edition N. Boubee & Cie. 1967.
19. Fox, Richard An Introduction to the Algae” . 2004. Laboratory Exercises for ES 300, Biodiversity. 24 nov (2004). Lander University.
20. Ghirardi, Maria L. and Michael Seibert Algal Hydrogen Photoproduction Nacional Renewable Energy Laboratory, Goleen , CO. Program Review Meeting. Berkeley, CA. (2003).
21. Melis,Anastasios; Matthew R. Melnicki, Integrated biological hydrogen production. International Journal of Hydrogen Energy; Sep2006, Vol. 31 Issue 11, p1563‐1573
22. Dennis D. Wykoff*, John P. Davies, Anastasios Melis, and Arthur R. Grossman. The Regulation of Photosynthetic Electron Transport during Nutrient Deprivation in Chlamydomonas reinhardtii1. Plant Physiol 117, 129‐139
23. Tsygankov, Anatoly; Kosourov, Sergey; Tolstygina,Irina; Ghirardi, Maria; Seibert, Michael Hydrogen production by sulfur‐deprived Chlamydomonas reinhardtii under photoautotrophic conditions. International Journal of Hydrogen Energy; Sep2006, Vol. 31 Issue 11, p15741584, 11p
24. Redding, Kevin; Laurent Cournac; Ilya R. Vassilievi, John H. Golbecki, Gilles Peltier; and Jean‐David Rochaix Photosystem I is indispensable for photoautotrophic growth, CO2 fixation, and H2 photoproduction by Chlamydomonas reinhardtii, J. Biol Chem 274, 18466‐10473
25. Burriel, Lucena y Arribas. Química Analítica Cualitativa. Séptima edición. Editora Paraninfo. Madrid 1970. p.245‐246.
26. Bourrelly Pierre Les Algues d´eaux Douce, Iniciation a la Systematique. Tome 1 : Les Algues Vertes Collection Faunes et Flores Actuelles Edition N. BOUBEE & Cie.,1972
27. Systema Naturae 2000 http://www.taxonomy.nl/sn2000/
28. The taxonomyc classification of Prescott http://www.glerl.noaa.gov.seagrant/GLWL/algae/chlorophyta/chlorophita.html
29. Standard Methods American Waste Water Association (AWWA) 17th. Edition, 1989
30. Gorman, D. S.; R. P. Levine Proc. Natl. Acad. Sci. Vol 54, 1665‐1669
31. Hutner et. Al. Methods in Enzymology, Vol. 23, 68
