Ciencia y Salud, Vol. 9, No. 3, septiembre-diciembre, 2025 • ISSN (impreso): 2613-8816 • ISSN (en línea): 2613-8824
EVALUACIÓN DE LA RESPUESTA PATOLÓGICA A LA TERAPIA NEOADYUVANTE EN PACIENTES CON CÁNCER DE MAMA TRATADAS EN ONCOSERV
Evaluation of Pathological Response to Neoadjuvant Therapy in Breast Cancer Patients Treated at ONCOSERV
DOI: https://doi.org/10.22206/cisa.2025.v9i3.3496
Recibido: 13/03/2025 ● Aceptado: 06/05/2025
Cómo citar: Prestol Puesan, R. S., Báez Jiménez, M., & Patricio Baldera, J. (2025). Evaluación de la respuesta patológica a la terapia neoadyuvante en pacientes con cáncer de mama tratadas en ONCOSERV. Ciencia y Salud, 9(3), 81-95. https://doi.org/10.22206/cisa.2025.v9i3.3496
Resumen
Introducción: La respuesta patológica completa (RPC) tras terapia neoadyuvante en cáncer de mama es un marcador pronóstico clave, asociado con una mejor supervivencia. Sin embargo, en República Dominicana, la información sobre los factores asociados a la RPC es limitada. Este estudio evalúa la frecuencia de RPC y sus factores asociados en pacientes tratadas en ONCOSERV. Métodos: Se realizó un estudio observacional, retrospectivo y analítico de corte transversal basado en expedientes clínicos de pacientes con cáncer de mama tratadas con terapia neoadyuvante entre 2021 y 2023. Se analizaron variables sociodemográficas, clínicas y terapéuticas. Se realizaron análisis de regresión logística para evaluar asociaciones con la RPC. Resultados: Se incluyeron 110 pacientes, con una tasa de RPC del 30%. La probabilidad de RPC fue menor en pacientes con estadios clínicos avanzados (OR=0.287; IC 95%: 0.117-0.637; p=0.004) y en aquellas con peor estatus funcional (OR=0.281; IC 95%: 0.089-0.738; p=0.017). La RPC fue mayor en pacientes con tumores HER2+/RH+ (OR=4.373; IC 95%: 1.141-17.970; p=0.034). Se identificó que retrasos >5 semanas en el diagnóstico redujeron significativamente la RPC en pacientes con estadios avanzados (OR=0.066; IC 95%: 0.010-0.350; p=0.002) y en aquellas con seguro subsidiado (OR=0.158; IC 95%: 0.026-0.874; p=0.037). Conclusiones: El estadio clínico, el estatus funcional, el perfil molecular, el nivel educativo y el tipo de seguro de salud influyen en la RPC. Los retrasos en el diagnóstico impactan negativamente en la respuesta al tratamiento, lo cual resalta la necesidad de estrategias para mejorar el acceso y la equidad en la atención oncológica.
Palabras clave: cáncer de mama, terapia neoadyuvante, respuesta patológica completa, inequidades en salud.
Abstract
Introduction: Pathological complete response (pCR) following neoadjuvant therapy in breast cancer is a key prognostic marker associated with improved survival. However, in the Dominican Republic, data on factors associated with pCR remain limited. This study evaluates the frequency of pCR and its associated factors in patients treated at ONCOSERV. Methods: We conducted an observational, retrospective, and analytical cross-sectional study based on medical records of breast cancer patients who underwent neoadjuvant therapy between 2021 and 2023. Sociodemographic, clinical, and therapeutic variables were analyzed. Logistic regression models were used to assess associations with pCR.
Results: A total of 110 patients were included, with a pCR rate of 30%. The probability of pCR was lower in patients with advanced clinical stages (OR=0.287; 95% CI: 0.117-0.637; p=0.004) and those with poorer functional status (OR=0.281; 95% CI: 0.089-0.738; p=0.017). pCR was more frequent in patients with HER2+/HR+ tumors (OR=4.373; 95% CI: 1.141-17.970; p=0.034). A diagnostic delay of more than five weeks significantly reduced pCR in patients with advanced stages (OR=0.066; 95% CI: 0.010-0.350; p=0.002) and those with subsidized health insurance (OR=0.158; 95% CI: 0.026-0.874; p=0.037). Conclusions: Clinical stage, functional status, molecular profile, educational level, and health insurance type influence pCR. Diagnostic delays negatively impact treatment response, underscoring the need for strategies to improve access and equity in oncological care.
Keywords: breast cancer, neoadjuvant therapy, pathological response, health inequities.
Introducción
El cáncer de mama es una de las principales causas de morbilidad y mortalidad en mujeres a nivel mundial. La terapia neoadyuvante ha emergido como una estrategia clave en el tratamiento del cáncer de mama, particularmente en pacientes con tumores localmente avanzados. Este enfoque terapéutico, administrado antes del tratamiento quirúrgico, tiene como objetivos principales reducir el tamaño tumoral, facilitar la resección quirúrgica y evaluar la sensibilidad del tumor a los regímenes quimioterapéuticos1.
La respuesta patológica completa (RPC) se define como la ausencia de enfermedad residual invasiva tanto en la mama como en los ganglios linfáticos tras el tratamiento neoadyuvante. Se considera un marcador subrogado de supervivencia a largo plazo, ya que se ha demostrado que los pacientes que logran una RPC presentan una mayor probabilidad de supervivencia libre de enfermedad y supervivencia global2. Además, la RPC permite identificar subgrupos de pacientes que podrían beneficiarse de estrategias terapéuticas más personalizadas o intensivas.
Diversos estudios han señalado que la probabilidad de lograr una RPC está influenciada por múltiples factores clínicos y demográficos, tales como la edad y estado menopáusico, subtipo molecular del tumor, tamaño tumoral inicial, estado de los ganglios linfáticos, grado histológico y proliferación celular, estatus de rendimiento, factores genéticos y biomarcadores3. Estos factores no solo tienen implicaciones pronósticas, sino también terapéuticas, permitiendo guiar decisiones clínicas y personalizar los tratamientos posteriores a la neoadyuvancia.
Estudios internacionales han demostrado que la tasa de RPC varía según los subtipos moleculares del cáncer de mama. Por ejemplo, Restrepo-Mejía et al. observaron que los subtipos HER2 positivo y triple negativo presentaban mayores tasas de RPC tras la neoadyuvancia, en comparación con los subtipos luminales4. Sin embargo, estos hallazgos pueden no ser directamente extrapolables a nuestra población debido a diferencias genéticas, ambientales y socioeconómicas5. Esto resalta la necesidad de evaluar cómo estas variables afectan la respuesta en distintos contextos clínicos y poblacionales.
En República Dominicana, la información sobre la eficacia de la terapia neoadyuvante y los factores que influyen en la RPC es limitada. Aunque se han realizado estudios sobre temas relacionados, como la eficacia de la capecitabina adyuvante en pacientes con cáncer de mama triple negativo y enfermedad residual6, la evidencia disponible no abarca otras poblaciones ni explora en profundidad estos factores determinantes. Esta carencia de información representa un desafío para el diseño de protocolos de tratamiento basados en evidencia local, lo que podría afectar la equidad en el acceso a terapias más efectivas. La recopilación de información sobre la respuesta a la neoadyuvancia en nuestra población permitirá identificar patrones específicos y optimizar la toma de decisiones terapéuticas.
El presente estudio tiene como objetivo principal evaluar la respuesta patológica tras la terapia neoadyuvante en pacientes con cáncer de mama tratadas en la clínica ONCOSERV, República Dominicana, identificando los factores socio-demográficos, clínico-patológicos y moleculares asociados a la probabilidad de alcanzar una RPC.
Material y métodos
Diseño del estudio
Se llevó a cabo un estudio unicentrico, observacional, retrospectivo y analítico de corte transversal, basado en la revisión de expedientes clínicos de pacientes con cáncer de mama tratadas en la sede de Santo Domingo de ONCOSERV, República Dominicana, entre enero de 2021 y diciembre de 2023.
Población y muestra
La población del estudio incluyó a 193 pacientes con diagnóstico de cáncer de mama atendidas en ONCOSERV durante el periodo de estudio. Oncoserv es una red internacional de clínicas oncológicas con presencia en la República Dominicana, especializada en el tratamiento del cáncer. Para la selección de la muestra, se aplicaron los siguientes criterios de inclusión y exclusión:
•Criterios de inclusión: i) pacientes con diagnóstico confirmado de cáncer de mama, ii) que hubieran recibido terapia neoadyuvante completa en el centro y iii) que contaran con la información completa en su expediente clínico, como son las características sociodemográficas, tratamiento neoadyuvante y sobre la respuesta patológica.
•Criterios de exclusión: i) pacientes que no recibieron o no habían recibido el tratamiento neoadyuvante completo al momento del levantamiento de los datos y ii) expedientes con información desconocida sobre la respuesta al tratamiento.
Tras la aplicación de estos criterios, la muestra final quedó conformada por 110 pacientes. El proceso de selección de la muestra se detalla en la figura 1.
Figura 1. Diagrama de flujo del proceso de selección de la muestra
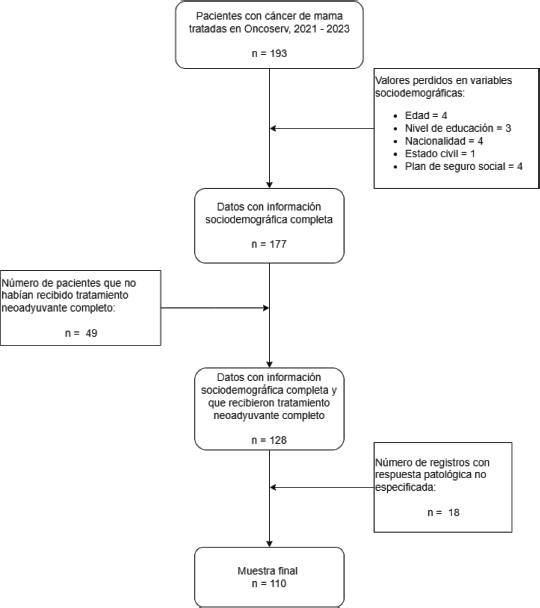
Nota: Se muestra el proceso de inclusión y exclusión de pacientes con cáncer de mama tratadas con terapia neoadyuvante en ONCOSERV entre 2021 y 2023. De un total de 193 pacientes, se excluyeron aquellas con datos sociodemográficos incompletos, sin tratamiento neoadyuvante completo o sin respuesta patológica especificada, resultando en una muestra final de 110 pacientes.
Recolección y digitalización de datos
Para la obtención de la información, se diseñó un cuestionario estructurado alineado con los objetivos del estudio, basado en los expedientes clínicos físicos y electrónicos de las pacientes tratadas en ONCOSERV, aprobado por el comité de expertos de la institución. Una vez recolectada, la información fue digitalizada aplicando criterios estandarizados de entrada y se implementaron controles de calidad y validación para corregir posibles inconsistencias. Para garantizar la confidencialidad y anonimización de los datos, no se capturó información que pudiera identificar a las pacientes, y el equipo encargado de la digitalización no tuvo acceso a datos identificables.
Variables del estudio
La variable principal del estudio fue la respuesta patológica completa (RPC), definida como la ausencia de enfermedad residual invasiva en la mama y los ganglios linfáticos tras el tratamiento neoadyuvante7, de acuerdo con los reportes histopatológicos postquirúrgicos. Adicionalmente, se analizaron las variables clínicas, sociodemográficas y terapéuticas, las cuales se listan a continuación: variables sociodemográficas: edad al diagnóstico, escolaridad, estado civil, nacionalidad y seguro social de salud; variables clínicas y tumorales: estado funcional (evaluado mediante la Escala Eastern Cooperative Oncology Group (ECOG))8, estadio clínico inicial (según la clasificación TNM)9, tipo histológico del tumor y perfil molecular; variables relacionadas con el tratamiento: tipo de tratamiento neoadyuvante, régimen empleado, procedimiento quirúrgico, el tiempo transcurrido entre la llegada al centro y el diagnóstico, y el tiempo transcurrido entre la llegada al centro e inicio del tratamiento.
Análisis estadístico
Se realizó un análisis descriptivo de las variables incluidas en el estudio por medio de frecuencias y porcentajes de las categorías. Se realizó una comparación de grupos entre mujeres de 50 años o menos y aquellas mayores de 50 años. Se utilizó la prueba de chi-cuadrado para conocer las asociaciones entre variables.
Para evaluar la asociación entre la RPC y las variables del estudio, se ajustaron modelos de regresión logística (no ajustados y ajustados por edad, escolaridad y seguro social). Se verificó la colinealidad entre las variables de control y exposición mediante el factor de inflación de la varianza (VIF) y se identificaron valores atípicos influyentes utilizando la distancia de Cook. Los resultados se presentan como odds ratios (OR) con intervalos de confianza del 95%, representados gráficamente. El análisis se realizó en R Studio (versión 4.3.1), considerando un nivel de significación estadística de 0.05.
Resultados
Se incluyeron 110 pacientes con cáncer de mama tratadas con terapia neoadyuvante en ONCOSERV entre 2021 y 2023. El 57.3% tenía más de 50 años. La respuesta patológica completa (RPC) se alcanzó en el 30% de los casos, mientras que el 63.6% presentó respuesta parcial, el 3.6% no tuvo respuesta y el 2.7% presentó progresión de la enfermedad. La Tabla 1 muestra la distribución detallada de las características demográficas, clínicas y de tratamiento.
Tabla 1. Características sociodemográficas, clínicas y terapéuticas de las pacientes con cáncer de mama tratadas con terapia neoadyuvante en ONCOSERV, según grupo de edad, 2021-2023
Características de las pacientes |
General (n = 110) |
Grupo de edad |
p value |
|
50 o menos (n = 47) |
Mayor de 50 (n = 63) |
|||
Escolaridad |
||||
Básica |
33 (30.0%) |
6 (12.8%) |
27 (42.9%) |
0.003 |
Secundaria |
47 (42.7%) |
24 (51.1%) |
23 (36.5%) |
|
Universitaria |
30 (27.3%) |
17 (36.2%) |
13 (20.6%) |
|
Estado civil |
||||
Soltera |
39 (35.5%) |
20 (42.6%) |
19 (30.2%) |
0.010 |
Casada |
25 (22.7%) |
10 (21.3%) |
15 (23.8%) |
|
Unión libre |
30 (27.3%) |
16 (34.0%) |
14 (22.2%) |
|
Viuda |
16 (14.5%) |
1 (2.1%) |
15 (23.8%) |
|
Nacionalidad |
||||
Dominicana |
104 (94.5%) |
44 (93.6%) |
60 (95.2%) |
0.999 |
Haitiana |
6 (5.5%) |
3 (6.4%) |
3 (4.8%) |
|
Seguro social |
||||
Privado |
50 (45.5%) |
25 (53.2%) |
25 (39.7%) |
0.281 |
Subsidiado |
59 (53.6%) |
22 (46.8%) |
37 (58.7%) |
|
No aplica (Pensionado) |
1 (0.9%) |
0 (0%) |
1 (1.6%) |
|
Estado funcional inicial |
||||
0 |
10 (9.1%) |
2 (4.3%) |
8 (12.7%) |
0.254 |
1 |
78 (70.9%) |
36 (76.6%) |
42 (66.7%) |
|
2 |
15 (13.6%) |
7 (14.9%) |
8 (12.7%) |
|
3 |
2 (1.8%) |
0 (0%) |
2 (3.2%) |
|
Desconocido |
5 (4.5%) |
2 (4.3%) |
3 (4.8%) |
|
Estadio clínico inicial |
||||
I |
1 (0.9%) |
0 (0%) |
1 (1.6%) |
0.865 |
II |
47 (42.7%) |
20 (42.6%) |
27 (42.9%) |
|
III |
53 (48.2%) |
22 (46.8%) |
31 (49.2%) |
|
IV |
7 (6.4%) |
3 (6.4%) |
4 (6.3%) |
|
Desconocido |
2 (1.8%) |
2 (4.3%) |
0 (0%) |
|
Tipo histológico |
||||
Carcinoma ductal infiltrante |
96 (87.3%) |
42 (89.4%) |
54 (85.7%) |
0.112 |
Carcinoma lobulillar infiltrante |
8 (7.3%) |
1 (2.1%) |
7 (11.1%) |
|
Otro |
2 (1.8%) |
0 (0%) |
2 (3.2%) |
|
Desconocido |
4 (3.6%) |
4 (8.5%) |
0 (0%) |
|
Perfil molecular |
||||
Luminal A |
36 (32.7%) |
7 (14.9%) |
29 (46.0%) |
0.002 |
Luminal B |
26 (23.6%) |
9 (19.1%) |
17 (27.0%) |
|
Triple negativo |
26 (23.6%) |
17 (36.2%) |
9 (14.3%) |
|
Her 2 sobre expresado RH- |
3 (2.7%) |
2 (4.3%) |
1 (1.6%) |
|
Her 2+ con RH+ |
17 (15.5%) |
10 (21.3%) |
7 (11.1%) |
|
Desconocido |
2 (1.8%) |
2 (4.3%) |
0 (0%) |
|
Tratamiento neoadyuvante |
||||
Quimioterapia |
104 (94.5%) |
47 (100%) |
57 (90.5%) |
0.094 |
Hormonoterapia |
5 (4.5%) |
0 (0%) |
5 (7.9%) |
|
Inmunoterapia |
1 (0.9%) |
0 (0%) |
1 (1.6%) |
|
Régimen empleado |
||||
A/C/ taxanos |
42 (38.2%) |
22 (46.8%) |
20 (31.7%) |
0.061 |
Taxanos |
32 (29.1%) |
8 (17.0%) |
24 (38.1%) |
|
Platinos + taxanos/ A/C |
9 (8.2%) |
5 (10.6%) |
4 (6.3%) |
|
Pembrolizumab + QT |
2 (1.8%) |
1 (2.1%) |
1 (1.6%) |
|
BHC |
2 (1.8%) |
0 (0%) |
2 (3.2%) |
|
Otro |
14 (12.7%) |
9 (19.1%) |
5 (7.9%) |
|
Desconocida |
9 (8.2%) |
2 (4.3%) |
7 (11.1%) |
|
Procedimiento quirúrgico |
||||
Mastectomía radical modificada |
89 (80.9%) |
38 (80.9%) |
51 (81.0%) |
0.627 |
Cuadrantectomía + Biopsia de ganglio centinela |
9 (8.2%) |
3 (6.4%) |
6 (9.5%) |
|
Ninguno |
5 (4.5%) |
3 (6.4%) |
2 (3.2%) |
|
No aplica |
2 (1.8%) |
1 (2.1%) |
1 (1.6%) |
|
Desconocido |
5 (4.5%) |
2 (4.3%) |
3 (4.8%) |
|
Respuesta clínica |
||||
Respuesta completa |
54 (49.1%) |
21 (44.7%) |
33 (52.4%) |
0.842 |
Respuesta parcial |
38 (34.5%) |
18 (38.3%) |
20 (31.7%) |
|
Enfermedad Estable |
13 (11.8%) |
6 (12.8%) |
7 (11.1%) |
|
Progresión |
3 (2.7%) |
1 (2.1%) |
2 (3.2%) |
|
Desconocida |
2 (1.8%) |
1 (2.1%) |
1 (1.6%) |
|
Respuesta patológica |
||||
Respuesta patológica completa (RPC) |
33 (30.0%) |
16 (34.0%) |
17 (27.0%) |
0.036 |
Respuesta patológica parcial (RPP) |
70 (63.6%) |
27 (57.4%) |
43 (68.3%) |
|
Sin respuesta |
4 (3.6%) |
4 (8.5%) |
0 (0%) |
|
Progresión |
3 (2.7%) |
0 (0%) |
3 (4.8%) |
|
Tiempo transcurrido entre llegada al centro y diagnóstico |
||||
1-2 semanas |
13 (11.8%) |
6 (12.8%) |
7 (11.1%) |
0.579 |
3-4 semanas |
39 (35.5%) |
16 (34.0%) |
23 (36.5%) |
|
5-7 semanas |
27 (24.5%) |
9 (19.1%) |
18 (28.6%) |
|
8-12 semanas |
12 (10.9%) |
5 (10.6%) |
7 (11.1%) |
|
13 o más semanas |
19 (17.3%) |
11 (23.4%) |
8 (12.7%) |
|
Tiempo transcurrido entre llegada al centro e inicio tratamiento |
||||
1-2 semanas |
47 (42.7%) |
22 (46.8%) |
25 (39.7%) |
0.194 |
3-4 semanas |
48 (43.6%) |
17 (36.2%) |
31 (49.2%) |
|
5-7 semanas |
9 (8.2%) |
3 (6.4%) |
6 (9.5%) |
|
8-12 semanas |
4 (3.6%) |
3 (6.4%) |
1 (1.6%) |
|
13 o más semanas |
2 (1.8%) |
2 (4.3%) |
0 (0%) |
|
Notas: Los datos se presentan en frecuencias absolutas y porcentajes (%). Se evaluaron diferencias entre grupos de edad (≤50 años vs. >50 años) utilizando la prueba de chi-cuadrado. Las categorías "Desconocido" y "No aplica" fueron excluidas del análisis estadístico. Se destacan en negrita las asociaciones con significación estadística (p<0.05).
Al segmentar las pacientes por grupo de edad (≤50 años vs. >50 años), se encontraron asociaciones significativas con la escolaridad (p=0.003), el estado civil (p=0.010), el perfil molecular (p=0.002) y la RPC (p=0.036). Además, el tipo de tratamiento neoadyuvante (p=0.094) y el régimen empleado (p=0.061) mostraron asociaciones marginales. No se identificaron diferencias significativas en otras variables.
Características demográficas y su asociación con la RPC
En la tabla 2 se muestra que las características demográficas como el nivel educativo y el seguro de salud mostraron asociaciones con la RPC. Las pacientes con educación universitaria tuvieron una mayor probabilidad de RPC en comparación con aquellas con educación básica (OR=3.763; IC 95%: 1.101-15.280; p=0.044). Asimismo, las pacientes con seguro subsidiado presentaron una menor probabilidad de RPC en comparación con aquellas con seguro privado (OR=0.309; IC 95%: 0.109-0.803; p=0.020). Ver tabla 2 para conocer las asociaciones con las demás variables.
Tabla 2. Asociación entre características sociodemográficas y la respuesta patológica completa (RPC)
Variables de exposición |
OR |
IC 95% |
P valor |
|
Inferior |
Superior |
|||
Edad: ≤ 40 (Ref.) |
||||
Edad: 40 - 49 |
0.642 |
0.166 |
2.585 |
0.520 |
Edad: 50 - 64 |
0.587 |
0.157 |
2.297 |
0.428 |
Edad: ≥ 65 |
0.373 |
0.071 |
1.821 |
0.225 |
Escolaridad: Básica (Ref.) |
||||
Escolaridad: Secundaria |
3.047 |
0.969 |
11.699 |
0.073 |
Escolaridad: Universitaria |
3.763 |
1.101 |
15.280 |
0.044 |
Seguro social: Privado (Ref.) |
||||
Seguro social: Subsidiado |
0.309 |
0.109 |
0.803 |
0.020 |
Nacionalidad: Dominicana (Ref.) |
||||
Nacionalidad: Haitiana |
1.177 |
0.157 |
6.362 |
0.855 |
Estado civil: Soltera (Ref.) |
||||
Estado civil: Casada o unida |
0.799 |
0.334 |
1.919 |
0.613 |
Estado civil: Viuda |
0.255 |
0.037 |
1.093 |
0.098 |
Nota: Los valores corresponden a los odds ratios (OR) con sus respectivos intervalos de confianza al 95% (IC 95%). Las referencias para cada categoría se indican entre paréntesis (Ref.). Los valores en negrita indican asociaciones estadísticamente significativas (p<0.05).
Factores clínicos asociados a la RPC
En la tabla 3 se muestra el análisis de factores clínicos asociados a la RPC. Este mostró que las pacientes con estadios clínicos más avanzados presentaron una menor probabilidad de alcanzar RPC (OR=0.287; IC 95%: 0.117-0.637; p=0.004), siendo esto diferencial de acuerdo con el seguro de salud de la paciente, como se puede apreciar en la figura 2. De manera similar, un peor estado funcional inicial se asoció con una menor probabilidad de lograr RPC (OR=0.281; IC 95%: 0.089-0.738; p=0.017). Entre las características tumorales, las pacientes con cáncer de mama HER2 positivo con receptores hormonales positivos (HER2+/RH+) presentaron una mayor probabilidad de alcanzar RPC en comparación con aquellas con tumores luminal A (OR=4.373; IC 95%: 1.141-17.970; p=0.034).
Tabla 3. Asociación entre características clínicas y tumorales y la respuesta patológica completa (RPC)
Variables de exposición |
OR |
IC 95% |
P valor |
|
Inferior |
Superior |
|||
Modelos ajustados |
||||
Estadio |
0.287 |
0.117 |
0.637 |
0.004 |
Estado funcional inicial |
0.281 |
0.089 |
0.738 |
0.017 |
Tipo histológico: Carcinoma ductal infiltrante (Ref.) |
||||
Tipo histológico: Otro |
0.202 |
0.010 |
1.228 |
0.147 |
Perfil molecular: Luminal A (Ref.) |
||||
Perfil molecular: Luminal B |
2.501 |
0.728 |
9.081 |
0.149 |
Perfil molecular: Triple negativo |
2.803 |
0.779 |
10.744 |
0.119 |
Perfil molecular: Her 2 sobre expresado RH- |
* |
* |
* |
* |
Perfil molecular: Her 2+ con RH+ |
4.373 |
1.141 |
17.970 |
0.034 |
Nota: Los valores corresponden a los odds ratios (OR) con sus respectivos intervalos de confianza al 95% (IC 95%). Se presentan ajustados por edad, escolaridad y seguro social. Las referencias para cada categoría se indican entre paréntesis (Ref.). Los valores en negrita indican asociaciones estadísticamente significativas (p<0.05). * Categoría excluida debido a la poca cantidad de observaciones.
Figura 2. Relación entre el estadio clínico al diagnóstico y la probabilidad estimada de respuesta patológica completa (RPC) según tipo de seguro de salud
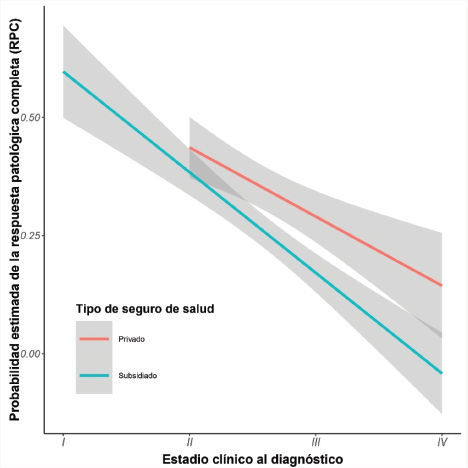
Nota: Las líneas representan las probabilidades estimadas de alcanzar RPC según el estadio clínico al diagnóstico, estratificadas por tipo de seguro de salud. Las bandas sombreadas indican los intervalos de confianza al 95%.
Factores terapéuticos y acceso a la atención asociados con la RPC
En la tabla 4 se muestra que no se observaron diferencias significativas en la probabilidad de RPC según el tipo de tratamiento neoadyuvante, el régimen empleado o el procedimiento quirúrgico; sin embargo, se identificaron interacciones significativas entre el seguro de salud y el tiempo transcurrido entre la llegada al centro y el diagnóstico, (OR=0.158; IC 95%: 0.026-0.874; p=0.037), así como entre el estadio clínico al diagnóstico y el tiempo transcurrido entre la llegada al centro y el diagnóstico (OR=0.066; IC 95%: 0.010-0.350; p=0.002).
Tabla 4. Asociación entre características terapéuticas y tiempos de atención con la respuesta patológica completa (RPC)
Variables de exposición |
OR |
IC 95% |
P valor |
|
Inferior |
Superior |
|||
Tratamiento: Quimioterapia (Ref.) |
||||
Tratamiento: Otro |
1.845 |
0.250 |
37.878 |
0.598 |
Régimen empleado: A/C/ taxanos (Ref.) |
||||
Régimen empleado: Taxanos |
0.880 |
0.301 |
2.506 |
0.812 |
Régimen empleado: Otro |
1.122 |
0.389 |
3.169 |
0.829 |
Procedimiento quirúrgico: Mastectomía radical modificada (Ref.) |
||||
Procedimiento quirúrgico: Cuadrantectomía + Biopsia de ganglio centinela |
3.191 |
0.732 |
14.834 |
0.121 |
Tiempo de diagnóstico: 1-2 semanas (Ref.) |
||||
Tiempo de diagnóstico: 3-4 semanas |
0.968 |
0.243 |
4.351 |
0.964 |
Tiempo de diagnóstico: 5-7 semanas |
1.447 |
0.346 |
6.821 |
0.621 |
Tiempo de diagnóstico: 8-12 semanas |
1.179 |
0.208 |
6.771 |
0.850 |
Tiempo de diagnóstico: 13 semanas o más |
0.647 |
0.112 |
3.719 |
0.619 |
Tiempo inicio tratamiento: 1-2 semanas (Ref.) |
||||
Tiempo inicio tratamiento: 3-4 semanas |
0.770 |
0.305 |
1.929 |
0.577 |
Tiempo inicio tratamiento: 5-7 semanas |
0.528 |
0.071 |
2.579 |
0.464 |
Tiempo inicio tratamiento: 8-12 semanas |
0.524 |
0.024 |
4.731 |
0.597 |
Tiempo de diagnóstico: superior de 5 semanas * Seguro social: subsidiado |
0.158 |
0.026 |
0.874 |
0.037 |
Tiempo de diagnóstico: superior de 5 semanas * Estadio al diagnóstico |
0.066 |
0.010 |
0.350 |
0.002 |
Nota: Los valores corresponden a los odds ratios (OR) con sus respectivos intervalos de confianza al 95% (IC 95%). Se presentan ajustados por edad, escolaridad y seguro social. Las referencias para cada categoría se indican entre paréntesis (Ref.). Los valores en negrita indican asociaciones estadísticamente significativas (p<0.05).
Discusión
Los hallazgos de este estudio proporcionan una visión detallada de los factores clínicos y sociodemográficos que influyen en la respuesta patológica completa (RPC) en pacientes con cáncer de mama tratadas con terapia neoadyuvante en ONCOSERV, República Dominicana, 2021-2023. Se identificaron asociaciones significativas entre la RPC y las siguientes variables: estadio clínico al diagnóstico, el estatus funcional inicial, el perfil molecular del tumor, el nivel educativo y el tipo de seguro de salud. Además, se observó que retrasos en el diagnóstico impactan negativamente en la respuesta al tratamiento, especialmente en pacientes con estadios avanzados y en aquellas con seguro subsidiado.
Nuestros resultados coinciden con estudios previos que han identificado el estadio clínico y el estatus funcional como predictores clave de la respuesta a la terapia neoadyuvante10, 11. Investigaciones internacionales han demostrado que pacientes con estadios avanzados tienen menor probabilidad de lograr RPC, lo que concuerda con nuestros hallazgos12, 13.
El perfil molecular del tumor también desempeña un papel crucial en la respuesta a la terapia neoadyuvante. Nuestros datos muestran que las pacientes con tumores HER2 positivos con receptores hormonales positivos (HER2+/RH+) tuvieron una mayor probabilidad de alcanzar RPC en comparación con aquellas con tumores luminal A. Este hallazgo es coherente con estudios que han documentado una mejor respuesta a la quimioterapia en estos subtipos tumorales13, 14.
Desde el punto de vista sociodemográfico, encontramos que las pacientes con educación universitaria tuvieron una mayor probabilidad de lograr RPC, comparadas con aquellas mujeres con educación básica, lo que sugiere que factores como el conocimiento sobre la enfermedad, la adherencia al tratamiento y el acceso a información médica pueden influir en los resultados. Además, la menor tasa de RPC en pacientes con seguro subsidiado resalta posibles disparidades en el acceso a tratamientos óptimos, fenómenos documentados en estudios sobre equidad en cáncer15, 16.
Uno de los hallazgos más relevantes fue la interacción entre el tiempo de diagnóstico y el estadio clínico al diagnóstico. Se identificó que un retraso superior a cinco semanas en el diagnóstico disminuye significativamente la probabilidad de RPC en pacientes con estadios avanzados. Esto sugiere que garantizar el acceso a la evaluación y tratamiento oncológico es un factor determinante en la respuesta al tratamiento para mejorar los resultados en pacientes con cáncer de mama17.
Desde una perspectiva de Salud Pública, la influencia del tipo de seguro de salud en la RPC refuerza la necesidad de garantizar el acceso equitativo a terapias eficaces. El tipo de seguro de salud supone una desigualdad en el acceso oportuno al tratamiento, ya que, en pacientes con seguro subsidiado, un tiempo superior a cinco semanas entre la llegada al centro y el diagnóstico redujo significativamente la probabilidad de alcanzar RPC. Este hallazgo concuerda con investigaciones previas que han reportado que el tipo de aseguramiento influye en la rapidez con la que las pacientes acceden a diagnóstico y tratamiento, lo que a su vez impacta los desenlaces clínicos17–19. En línea con estos hallazgos, otros autores han documentado que las disparidades en cobertura de salud y nivel educativo afectan los desenlaces del cáncer en la República Dominicana20, destacando la importancia de garantizar acceso equitativo a servicios de salud enfocados en prevención del cáncer y fortalecimiento de políticas de cobertura universal en poblaciones vulnerables.
Programas de apoyo financiero y políticas de cobertura universal podrían mitigar estas desigualdades y mejorar los desenlaces en poblaciones vulnerables. La identificación de retrasos en el diagnóstico como un factor que reduce la probabilidad de RPC subraya la importancia de mejorar la eficiencia en la referencia y el inicio del tratamiento. La implementación de rutas de atención rápida en oncología podría ser una estrategia clave para reducir estos tiempos y mejorar la efectividad de la terapia neoadyuvante.
Por otro lado, es de destacar que este estudio presenta algunas limitaciones que deben considerarse al interpretar los resultados. En primer lugar, el tamaño de la muestra puede haber limitado la precisión de algunas estimaciones, lo que resalta la importancia de realizar estudios con mayor tamaño de muestra y mayor representatividad. En segundo lugar, dado que el estudio se llevó a cabo en un único centro oncológico, la generalización de los hallazgos a otros entornos es limitada, por lo que se recomienda interpretar estos resultados con cautela. Investigaciones multicéntricas permitirían evaluar la reproducibilidad de estos resultados en diferentes contextos clínicos y poblacionales21, 22.
Futuras investigaciones podrían enfocarse en analizar cómo el tiempo de atención influye en la supervivencia a largo plazo, identificar biomarcadores predictivos de la respuesta patológica completa (RPC) y diseñar intervenciones dirigidas a reducir las demoras en la atención oncológica en poblaciones con acceso limitado a los servicios de salud.
Conclusiones: Este estudio aporta evidencia sobre los factores clínicos y sociodemográficos asociados a la RPC en pacientes con cáncer de mama tratadas con terapia neoadyuvante en ONCOSERV. Se identificó que el estadio clínico, el estatus funcional, el perfil molecular, el nivel educativo y el tipo de seguro de salud influyen en la probabilidad de alcanzar RPC. Además, se observó que los retrasos en el diagnóstico impactan negativamente en la respuesta al tratamiento, especialmente en pacientes con estadios avanzados y en pacientes con seguro subsidiado.
Estos hallazgos resaltan la importancia de estrategias dirigidas a mejorar la equidad en el acceso al tratamiento y optimizar los tiempos de diagnóstico en oncología. El desarrollo de estudios multicéntricos permitirá confirmar estos resultados y contribuir a la implementación de políticas de salud basadas en evidencia para mejorar el manejo del cáncer de mama en la República Dominicana.
Financiamiento
Este estudio recibió apoyo financiero de AstraZeneca para cubrir costos de recolección y procesamiento de datos. AstraZeneca no participó en el diseño, recolección de datos, análisis, interpretación ni en la aprobación final del manuscrito.
Contribución de los autores
Concepción y diseño del estudio: RSPP; recolección de datos: RSPP, JPB; análisis e interpretación de resultados: JPB, RSPP, MBJ; preparación del manuscrito preliminar: JPB. Todos los autores revisaron los resultados y aprobaron la versión final del manuscrito.
Declaración ética
Se garantizó la confidencialidad de los datos mediante la anonimización de la información obtenida de los expedientes clínicos. No se requirió el consentimiento informado de las pacientes debido a la naturaleza retrospectiva del estudio.
Descargo de responsabilidad
Las conclusiones de este artículo son únicamente responsabilidad de los autores y no reflejan necesariamente las opiniones, políticas o posiciones de Ciencia y Salud, sus editores, o del Instituto Tecnológico de Santo Domingo (INTEC).
Referencias
1. Burgués O, Terrádez L, Buch E, Martínez MT, Cejalvo JM, Bermejo B. Tratamiento neoadyuvante en el cáncer de mama. El papel del patólogo. Rev Senol y Patol Mamar [Internet]. 2022 Jul;35:S87–100. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0214158222000743
2. Ramírez-Torres N, Pérez-Puentes A, Rivas-Ruiz R, Talavera JO, Astudillo-de la Vega H. Impacto pronóstico de la respuesta patológica completa y del estado ganglionar en pacientes con cáncer de mama avanzado tratadas con dosis alta de epirrubicina neoadyuvante. Gac Mex Oncol [Internet]. 2016 May;15(3):128–37. Available from: http://linkinghub.elsevier.com/retrieve/pii/S1665920116300281
3. Allué Cabañuz M, Arribas del Amo MD, Güemes Sánchez AT. Factores relacionados con la obtención de respuesta patológica completa tras quimioterapia neoadyuvante en cáncer de mama y su efecto sobre la reconstrucción tras mastectomía ahorradora de piel. Cirugía Española [Internet]. 2020 Mar;98(3):149–53. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0009739X19303100
4. Restrepo-Mejía M, Guarín-García AM, Bonilla-Sepúlveda ÓA, Rincón-Medina M, Barrera-Arenas LM. Respuesta tumoral a la quimioterapia neoadyuvante en subtipos moleculares de cáncer de mama en Medellín, Colombia. Estudio de cohorte retrospectivo. Rev Colomb Obstet Ginecol [Internet]. 2023 Jun 30;74(2):143–52. Available from: https://revista.fecolsog.org/index.php/rcog/article/view/3925
5. Giménez-Martínez PL, Flores-Rodríguez LE. Respuesta al tratamiento neoadyuvante en pacientes con cáncer de mama del Departamento de Oncología Médica del Hospital de Clínicas. Gac Mex Oncol [Internet]. 2019 Mar 14;18(1). Available from: http://www.gamo-smeo.com/frame_eng.php?id=103
6. Rojas Crousset MB. Eficacia de capecitabina adyuvante en pacientes postquirúrgicos de cáncer de mama triple negativo y enfermedad residual en el Instituto de Oncología Dr. Heriberto Pieter, 2016- 2018 [Internet]. Universidad Nacional Pedro Henríquez Ureña; 2022. Available from: https://repositorio.unphu.edu.do/handle/123456789/5291
7. Cortazar P, Zhang L, Untch M, Mehta K, Costantino JP, Wolmark N, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet [Internet]. 2014 Jul;384(9938):164–72. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0140673613624228
8. ECOG-ACRIN cancer research group. ECOG Performance Status Scale [Internet]. [cited 2025 Mar 1]. Available from: https://ecog-acrin.org/resources/ecog-performance-status/
9. International Agency for Research on Cancer. Guía del Usuario TNM Esencial [Internet]. 2022. Available from: https://gicr.iarc.fr/static/public/docs/EssentialTNMUsersGuide_2ndEd_May2022_SPA.pdf
10. Margelí M, Rosell R, Barnadas Molins A. Factores pronósticos y predictivos de respuesta a la quimioterapia neoadyuvante con antraciclinas en una serie de cáncer de mama [Internet]. 2012. Available from: https://ddd.uab.cat/record/103717
11. Braman N, Adoui M El, Vulchi M, Turk P, Etesami M, Fu P, et al. Deep learning-based prediction of response to HER2-targeted neoadjuvant chemotherapy from pre-treatment dynamic breast MRI: A multi-institutional validation study. 2020 Jan 22; Available from: http://arxiv.org/abs/2001.08570
12. Liedtke C, Mazouni C, Hess KR, André F, Tordai A, Mejia JA, et al. Response to Neoadjuvant Therapy and Long-Term Survival in Patients With Triple-Negative Breast Cancer. J Clin Oncol [Internet]. 2008 Mar 10;26(8):1275–81. Available from: https://ascopubs.org/doi/10.1200/JCO.2007.14.4147
13. Goorts B, van Nijnatten TJA, de Munck L, Moossdorff M, Heuts EM, de Boer M, et al. Clinical tumor stage is the most important predictor of pathological complete response rate after neoadjuvant chemotherapy in breast cancer patients. Breast Cancer Res Treat [Internet]. 2017 May 15;163(1):83–91. Available from: http://link.springer.com/10.1007/s10549-017-4155-2
14. Román Guindo A, Martí Álvarez C, Hardisson Hernáez D, de Santiago García FJ, Sánchez Méndez JI. Evaluación de la respuesta patológica a la quimioterapia neoadyuvante en mama y axila según los fenotipos moleculares del cáncer de mama. Rev Senol y Patol Mamar [Internet]. 2016 Jul;29(3):120–4. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0214158216300093
15. Madariaga B, Mondschein S, Torres S. Inequities in Breast Cancer Outcomes in Chile: An Analysis of Case Fatality and Survival Rates (2007-2018). 2022 Oct 19; Available from: http://arxiv.org/abs/2210.10930
16. National Cancer Institute. Breast Cancer Treatment (PDQ®)–Health Professional Version [Internet]. 2024. Available from: https://www.cancer.gov/types/breast/hp/breast-treatment-pdq
17. Martínez-Pérez DC, Gómez-Wolff LR, Ossa-Gómez CA, Hernández-Herrera GN, Rivas-Bedoya Y, García-García HI. Asociación entre retraso en el diagnóstico y estadio clínico avanzado de cáncer de mama al momento de la consulta en cuatro centros oncológicos de Medellín, Colombia, 2017. Estudio de corte transversal. Rev Colomb Obstet Ginecol [Internet]. 2020 May 20;71(2). Available from: https://revista.fecolsog.org/index.php/rcog/article/view/3410
18. Bonilla-Sepúlveda ÓA. Retrasos en el diagnóstico y tratamiento del cáncer de mama en Medellín, Colombia. Ginecol Obs Méx [Internet]. 2022;90(12):943–50. Available from: https://www.scielo.org.mx/scielo.php?pid=S0300-90412022001200943&script=sci_arttext
19. Egurrola-Pedraza JA, Gómez-Wolff LR, Ossa-Gómez CA, Sánchez-Jiménez V, Herazo-Maya F, García-García HI. Diferencias en supervivencia debidas al aseguramiento en salud en pacientes con cáncer de mama atendidas en un centro oncológico de referencia en Medellín, Colombia. Cad Saude Publica [Internet]. 2018;34(12). Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0102-311X2018001205009&tlng=es
20. Puello A, Polanco Vargas V, Drame M, Carabali M, Joachim C. EPH1 Universal Health Coverage and Education Are the Decisive Socio-Economic Disparities in Cervical Cancer Mortality in the Dominican Republic: A Multi-Dimensional Ecological Approach in a Middle-Income Caribbean Country. Value Heal [Internet]. 2024 Dec;27(12):S223. Available from: https://linkinghub.elsevier.com/retrieve/pii/S1098301524039974
21. Curigliano G, Burstein HJ, Winer EP, Gnant M, Dubsky P, Loibl S, et al. De-escalating and escalating treatments for early-stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Ann Oncol [Internet]. 2017 Aug;28(8):1700–12. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0923753419321817
22. Esserman LJ, Berry DA, DeMichele A, Carey L, Davis SE, Buxton M, et al. Pathologic Complete Response Predicts Recurrence-Free Survival More Effectively by Cancer Subset: Results From the I-SPY 1 TRIAL—CALGB 150007/150012, ACRIN 6657. J Clin Oncol [Internet]. 2012 Sep 10;30(26):3242–9. Available from: https://ascopubs.org/doi/10.1200/JCO.2011.39.2779
_______________________________
1 Departamento de Oncología Médica, ONCOSERV, Santo Domingo, República Dominicana. ORCID: https://orcid.org/0009-0003-6089-6945, email: prestolrogelio@gmail.com
2 Departamento de Oncología Médica, Instituto Nacional del Cáncer Rosa Emilia Sánchez Pérez de Tavares (INCART), Santo Domingo, República Dominicana República Dominicana. ORCID: https://orcid.org/0009-0003-9390-1106, email: marienbaezjimenez@gmail.com
3 Instituto de Investigación en Salud (INSIS), Facultad de Ciencias de La Salud de La Universidad Autónoma de Santo Domingo, Santo Domingo, República Dominicana. Centre for Age-Related Medicine (SESAM), Stavanger University Hospital, Stavanger, Noruega. Fundación Etikos, inc., Santo Domingo, República Dominicana. ORCID: https://orcid.org/0000-0003-4719-5362, email: Jonathanp.baldera@gmail.com
