Introducción
Los neonatos, principalmente los prematuros en estadios críticos, deben ser expuestos a productos sanguíneos1; estos, normalmente, tienen niveles de factores de coagulación reducidos, los cuales provocan tiempos de tromboplastina parcial activa (aPTT) y protrombina (PT) más prolongados de lo normal2, que aumentan el riesgo de complicaciones hemorrágicas complejas que pueden llevar a secuelas graves del sistema nervioso, como el caso de la hemorragia intraventricular5.
En la práctica médica, estos valores son indicativos de riesgo inminente para la supervivencia del neonato y el peligro de hemorragia se ve aumentado fisiológicamente por la presencia de trastornos plaquetarios, deficiencia de factores de coagulación, desequilibrio entre los procesos antitrombóticos y protrombóticos, y coagulopatías congénitas, que alteran el equilibrio hemostático2.
La indicación principal para la transfusión de plasma es corregir la deficiencia de los factores de coagulación, cuando no se dispone de una concentración específica en pacientes con hemorragia activa. Sin embargo, la práctica clínica ha demostrado que un porcentaje grande de las transfusiones de FFP en neonatología no siguen las recomendaciones de las guías actuales, al usar la transfusión para casos de sangrado sin coagulopatía, expansión de volumen y neonatos sépticos, sin ninguna de las anteriores4, pudiendo evitar la exposición de los recién nacidos a dichas condiciones; en conocimiento de que el cribado rutinario de coagulación al ingreso de la unidad de cuidados intensivos neonatales (UCIN), además de ser algunas veces innecesario y mal interpretado, conduce a la detección de aPTT y PT prolongados, anemia neonatal y el uso exagerado de transfusiones de FFP en ausencia de hemorragias, con el fin de corregir estas deficiencias5.
Cabe resaltar que, el aPTT y el PT prolongado no son predictores de un mayor riesgo de hemorragia en la coagulopatía neonatal, ya que se elevan a favor de los principales factores procoagulantes; además, en edades más tempranas la hemostasia neonatal se mantiene cuando se reducen los precursores procoagulantes y anticoagulantes, en casos de evaluar la coagulación por medio de pruebas globales, como la tromboelastografía (TEG) y el procedimiento de generación de trombina6.
La TEG es una herramienta de evaluación viscoelástica del coágulo7; anteriormente, no era muy valorada en el ámbito clínico, pero, desde la incorporación del concepto integrador de la vía intrínseca y extrínseca de la coagulación con funciones que no eran aisladas e independientes, se ha rescatado su valor8. La TEG considera componentes celulares y plasmáticos de la hemostasia, permitiendo un análisis dinámico del proceso con aceptable reproducibilidad en neonatología7,9.
Es por esto que nace la necesidad de rescatar esta prueba como complemento a la hora de evitar la exposición de riesgos de la transfusión de FFP en situaciones innecesarias, sirviendo de guía para el uso de productos sanguíneos en el manejo profesional médico, para la clasificación de coagulopatías y reduciendo en cirugía pediátrica el uso de FFP intraoperatorio con impacto beneficioso en términos de resultados10,11.
Materiales y métodos
Se realizó una revisión de la literatura en base de datos como PubMed y Elsevier, usando palabras clave como: tromboelastografía, transfusión de plasma en neonatos, hemostasia neonatal.
Generalidades de la transfusión de plasma fresco congelado
En primera instancia, es necesario conocer el estado hemostático del paciente antes de realizar una intervención transfusional, gracias a la utilización de estudios de laboratorio y su relación con las manifestaciones clínicas, para hacer una valoración integral. Existen múltiples enfoques para realizar un diagnóstico con base en los tiempos de coagulación, sin embargo, los más utilizados son los esquematizados en el Tabla 112.
Discusión
Tabla 1. Interpretación de tiempos de coagulación12
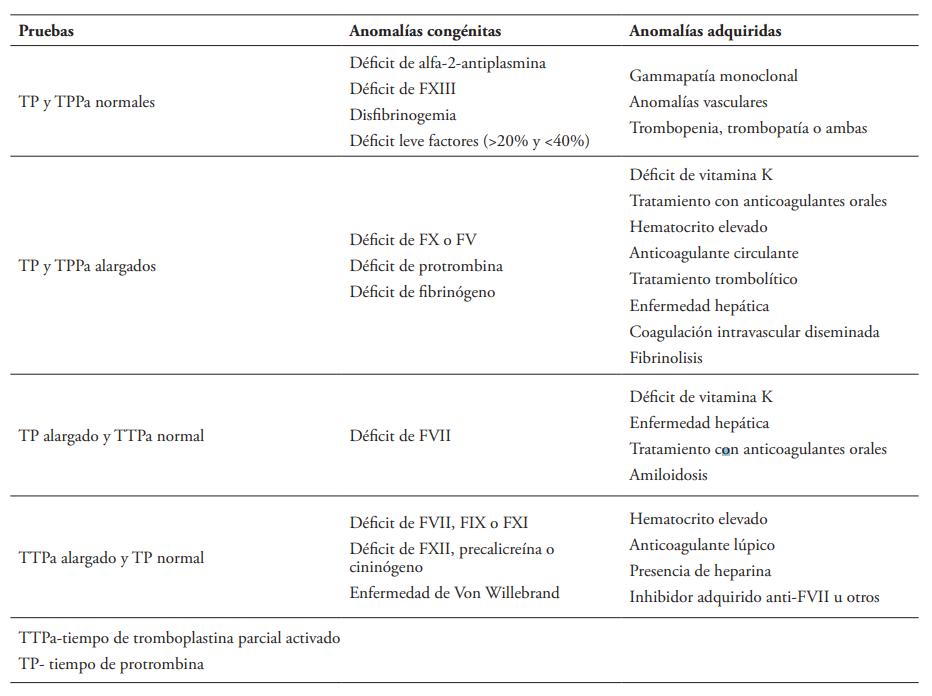
Fuente:
adaptado de Gil-García12.
La transfusión de FFP es una intervención terapéutica que se utiliza en múltiples escenarios clínicos, dentro de los cuales se incluye: transfusión masiva, cirugía, reversión de Warfarina con y sin hemorragia grave, hemorragia crítica, enfermedad hepática, deficiencias de factor de coagulación, púrpura trombocitopénica y complicaciones quirúrgicas13, 14, sin embargo, se ha encontrado que la decisión de transfundir FFP a pacientes en UCI va arraigada con las experiencias que los médicos tienen respecto a esta práctica, es por esto que muchas de estas transfusiones son inapropiadamente frecuentes durante la enfermedad crítica15.
El FFP es plasma de donante humano, producido a partir de una sola unidad de donante de sangre entera u obtenido por plasmaféresis16; los productos disponibles son: plasma fresco congelado (PFC), plasma que ha sufrido inactivación con tratamiento solvente/ detergente (S/D FFP), entre otros3,17. A menudo, es transfundido con base en dos suposiciones: presencia de hemorragia, que se corrobora con las pruebas realizadas, y que la transfusión reducirá notablemente el riesgo de esta. Sin embargo, la administración de plasma se relaciona con una serie de eventos secundarios que pueden traer consecuencias negativas para los pacientes, por lo que la práctica debe ser considerada minuciosamente antes de realizarse en pacientes críticamente enfermos, analizando correctamente riesgos y beneficios18.
Riesgos de la transfusión de FFP
Actualmente, los efectos adversos de las transfusiones han disminuido en gran medida, gracias a los esfuerzos para mejorar el reconocimiento temprano y la mitigación de estos en comparación con los años anteriores, sin embargo, los riesgos aún persisten15.
Una reacción transfusional se define como cualquier evento adverso relacionado con la transfusión, que ocurre durante o después de la administración de sangre o sus derivados19; estas se clasifican, según el tiempo de instauración, en agudas y retardadas. Las primeras se caracterizan por ser producidas durante las primeras 24 horas posteriores a la transfusión y las retardadas son aquellas en las que se presenta cualquier síntoma o signo 24 horas después de la intervención20.
Dentro de las reacciones transfusionales agudas resalta la reacción transfusional hemolítica aguda (AHTR), reacciones febriles, reacciones transfusionales alérgicas (ATR), reacción transfusional no hemolítica (FNHTR), sobrecarga circulatoria asociada a la transfusión (TACO), lesión pulmonar aguda relacionada con la transfusión (TRALI) y reacciones metabólicas21, donde la ATR es la forma más común, cursa con urticaria, prurito, erupción eritematosa, angioedema, broncoespasmo y/o hipotensión, y en estadios graves anafilaxia20. Cabe resaltar que las reacciones difieren entre niños y adultos, siendo mayor la incidencia en pacientes pediátricos que en adultos22,23.
Los riesgos de las transfusiones se pueden clasificar como riesgos conocidos y riesgos teóricos. Los riesgos conocidos comprenden transmisión de infecciones y reacciones secundarias a los constituyentes del plasma24.
Ahora bien, a pesar de los riesgos y las limitadas indicaciones para el uso de FFP en neonatos en las Unidades de Cuidados Intensivos Neonatales (UCIN), las transfusiones parecen ser un procedimiento relativamente común, pero en su mayoría innecesario. Tales transfusiones, aunque ordenadas con buenas intenciones, pueden no brindar ningún beneficio al receptor25, sin embargo, lo más preocupante en la actualidad es la proporción significativa del uso inapropiado de FFP con fines, en su mayoría, profilácticos, sin presencia de hemorragia o coagulopatía asociada, aumentando la exposición a los riesgos mencionados con anterioridad4.
Transfusión de plasma y hemostasia en neonatos
En el período neonatal, la hemostasia es un proceso que se desarrolla desde la vida intrauterina y continúa presentando cambios hasta la adultez; a esta maduración con estrecha relación con la edad se le conoce como “hemostasia del desarrollo”26.
El sistema hemostático evoluciona y madura continuamente durante la vida, más que nada durante los primeros meses de vida. Los factores de coagulación maternos no atraviesan la barrera placentaria debido a su tamaño, sin embargo, la síntesis del factor de coagulación en el feto comienza durante la quinta semana de gestación y en la semana 11, y es allí cuando la sangre se vuelve coagulable, demostrando estrecha relación con la edad gestacional y la edad posnatal del lactante27,28.
De ahí que al nacer sea llamativo que los factores de coagulación sean aproximadamente la mitad del porcentaje plasmático de los adultos y, por consiguiente, los prematuros conserven valores mucho más disminuidos de factores procoagulantes y anticoagulantes, en relación con los bebés a término29.
En el recién nacido, las concentraciones plasmáticas de los factores procoagulantes (II, VII, IX, X, XI, XII) y anticoagulantes (proteína S, C y antitrombina) están disminuidos y, por consiguiente, su actividad; sin embargo, el equilibrio se mantiene constante, gracias a que el hematocrito alto, glóbulos rojos nucleados grandes y las altas concentraciones del factor de Von Willebrand (VWF) contrarrestan la hiporreactividad30.
A pesar de ser un tema muy común, la hemostasia es uno de los campos más desdibujados de la fisiopatología neonatal. Los neonatos y los prematuros sanos tienen un sistema hemostático con tiempos de coagulación más prolongados, que no indican riesgo de hemorragia en todos los casos. Estos resultados anormales de las pruebas de coagulación, en ausencia de síntomas o riesgo hemorrágico, no son una indicación para una transfusión de FFP, debido a que corresponden a procesos fisiológicos normales que indican ausencia de enfermedad en la población neonatal31.
Este hecho contradice la infusión de FFP cuando se administra de forma profiláctica y/o basándose únicamente en la prolongación del PT o el aPTT5.
Por la errada interpretación y la necesidad de evitar hemorragias graves, la administración de FFP sigue siendo una práctica común en la UCIN, pero se expresa preocupación sobre la idoneidad de su uso, a raíz de esto, nace la necesidad de identificar y eliminar cualquier transfusión innecesaria para mejorar la atención, disminuir costos y buscar la preservación más cuidadosa de los recursos de componentes sanguíneos32.
Usos y beneficios de la Tromboelastografía (TEG)
La TEG es una herramienta que evalúa la hemostasia global, midiendo cambios viscoelásticos globales que se producen durante el proceso de coagulación, desde la iniciación y el desarrollo del coágulo hasta la fibrinólisis, que proporciona información en tiempo real33. Además, permite que el impacto de las intervenciones hemostáticas pueda evaluarse rápidamente y las decisiones puedan ser tomadas con base en los resultados de la prueba34,35.
La TEG se considera una prueba más confiable para evaluar la coagulación que las pruebas tradicionales como el PT, PTTa, INR (índice internacional normalizado), nivel de fibrinógeno y recuento de plaquetas, sistemas que reflejan solo componentes parciales de la hemostasia36,debido a que la TEG evalúa la interacción compleja entre los factores de coagulación, lisis y fuerza del coágulo, velocidad de formación y todos los componentes que mantienen el equilibrio en la formación del trombo, sin dejar de lado la interacción dependiente de ambas vías de la hemostasia y solo con una muestra pequeña (0,36 ml) de sangre entera7,37.
El resultado obtenido proporciona una curva gráfica que representa la interacción de factores de coagulación, fibrinógeno/fibrina, endotelio, plaquetas y, en general, la formación, estabilización y lisis del coágulo; es decir, un análisis integral de la hemostasia38.
Otra de las ventajas que ofrece esta prueba es la rapidez que proporciona la herramienta, ya que los primeros resultados son obtenidos a los treinta minutos, permitiendo la toma de decisiones rápida y eficaz, teniendo en cuenta la importancia de esto en el ámbito clínico39.
Esta herramienta tiene utilidad en ciertas situaciones clínicas, por ejemplo, durante la intervención quirúrgica en pacientes sangrantes, en pacientes con trastornos hemorrágicos, cuando se requieren transfusiones masivas, para monitorear ciertos medicamentos o para facilitar diagnósticos como el de hiperfibrinólisis, que suele ser difícil; pero, al ser una prueba que evalúa las propiedades viscoelásticas de la sangre, puede ofrecer información importante para respaldarlos40,41.
Adicionalmente, se han descrito ventajas en la terapia hemostática guiada por la TEG que se demostraron en pacientes sometidos a cirugía cardíaca42, abriendo la posibilidad de reducir la pérdida de sangre, la necesidad de unidades de plasma fresco congelado durante cirugías y las demandas perioperatorias de hemoderivados43.
Tromboelastografía en relación con neonatos
Como se ha mencionado anteriormente, el sistema de la coagulación y fibrinólisis es inmaduro en los neonatos con actividad de plasmina reducida, niveles bajos de inhibidor de plasminógeno y factores procoagulantes. Es por esto que los exámenes tradicionales de la coagulación que se hacen en plasma no son muy útiles para la detección del procedimiento hemostático in vivo, ya que no reflejan la dinámica del coágulo, la función plaquetaria ni la capacidad fibrinolítica, haciendo que su valor pronóstico sea limitado, más aún, para decidir transfundir FFP neonatal innecesariamente44,45.
Mientras tanto, la TEG, al ser parte de las pruebas de análisis viscoelásticos de la sangre, supera los obstáculos que los exámenes tradicionales no pueden determinar. Este avance permite la evaluación integral de la sangre del neonato, sin abrir paso a errores que perjudiquen la salud de los pacientes, y poder hacer pronósticos e intervenciones acertadas, con base en lo que limitadamente se conoce en cuanto a la fisiopatología del mismo38.
Además de lo mencionado, esta prueba no solo determina riesgos de sangrado, también permite la detección del tipo de coagulopatía con la que el neonato cursa, constituyendo una herramienta útil para su diagnóstico y tratamiento39.
Esta prueba ha sido ampliamente estudiada en adultos y niños, especialmente en cirugía cardíaca, trasplante, trauma, y pacientes con oxigenación por membrana extracorpórea y obstetricia37,46,47. En cuanto a los neonatos, los datos disponibles son escasos y su uso clínico no está muy extendido, debido a la falta de rangos de referencia para este grupo de edad; no obstante, muchos autores han decidido tomar iniciativa para definir los valores y parámetros correctos para permitir la mejor interpretación y facilitar la elección de tratamientos que se ofrecen a los pacientes. Entre estos, la transfusión de FFP48-50.
Conclusión
En definitiva, se puede determinar que la implementación de la TEG, para el análisis del equilibrio hemostático en pacientes es una buena herramienta que evita el uso profiláctico de transfusión de FFP en neonatos, permite hacer prescripciones con relación a la evidencia, mejora la atención médica a los pacientes, logra hacer diagnósticos rápidos y concretos, reduce costos y abre la posibilidad de brindar tratamientos oportunos, principalmente, en situaciones que involucren la toma inmediata de decisiones como en UCIN.

