Ciencia y Salud, Vol. VI, No. 3, septiembre-diciembre, 2022 • ISSN (impreso): 2613-8816 • ISSN (en línea): 2613-8824 • Sitio web: https://revistas.intec.edu.do/
Identificación molecular de Virus del Papiloma Humano de Alto Riesgo en carcinomas epidermoides: un piloto de implementación en entornos de recursos limitados
Molecular identification of High-Risk Human Papillomavirus in epidermoid carcinomas: a pilot implementation study in limited resource settings
Cómo citar: . Benítez A, Sánchez Marte E, Suero Guzmán C, Peguero A, Paulino-Ramírez R. Identificación molecular de Virus del Papiloma Humano de Alto Riesgo en carcinomas epidermoides: un piloto de implementación en entornos de recursos limitados. cysa [Internet]. 19 de noviembre de 2022 [citado 18 de noviembre de 2022];6(3):17-26. Disponible en: https://revistas.intec.edu.do/index.php/cisa/article/view/2687
Introducción
La familia papillomaviridae (PV) tiene una amplia distribución en la naturaleza con capacidad de replicación en múltiples especies, desde conejos, homínidos no humanos, a humanos. Se conocen más de 200 tipos de papilomavirus que afectan distintos epitelios en humanos, con un alto tropismo a las células de las mucosas1. Los PVs son virus de ADN con genoma circular, cerrado, de doble hebra, de aproximadamente 8 kb y una cápside icosaédrica2. Los virus del Papiloma humano (VPH) son bien reconocidos como un importante factor oncogénico en el desarrollo de un gran subconjunto de cánceres y lesiones epiteliales premalignas. Según su potencial oncogénico, se clasifican como de alto riesgo y bajo riesgo3. Los VPH de bajo riesgo, regularmente, se asocian con verrugas ano-genitales y papilomatosis respiratoria recurrente (PRR). La infección persistente con distintos tipos de VPH de alto riesgo es el factor predisponente más importante en el desarrollo de distintos tipos de cáncer, incluidos el de cuello uterino (cérvix), pene, ano, vagina, y de cabeza/cuello4. La Agencia Internacional para la Investigación del Cáncer (IARC)/Organización Mundial de la Salud (OMS) definió en 2012 un total de 12 tipos de VPH como carcinógenos de clase I (habitualmente denominados tipos de alto riesgo): VPH16, VPH31, VPH33, VPH35, VPH52 Y VPH58 (EN ALFA-9); VPH18, VPH39, VPH45 Y VPH59 (ALFA-7); VPH51 (ALFA-5); Y VPH56 (ALFA-6). Específicamente, los tipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, y 685.
La morbi-mortalidad asociada al VPH es considerable, se estima que en mujeres el VPH es causante cada año de aproximadamente 500,000 nuevos casos de cáncer de cuello uterino y 250,000 muertes a nivel mundial5. Según lo establecido por el Colegio Americano de Patólogos (CAP), se recomienda que se realice una identificación especifica de VPH de alto riesgo en las muestras de carcinomas de cabeza y cuello o sus metástasis6, siendo esta una recomendación de reciente incorporación en los estándares de la CAP. En algunas situaciones, su identificación debe realizarse en muestras FFPE (Tejido fijados en formalina y embebidos en parafina)7.
En el ámbito local, en la República Dominicana, no existen, basado en la literatura científica disponible, fundamentos para la comprensión de su aplicabilidad, sensibilidad y especificidad. Por otro lado, su identificación en los servicios de patología no se realiza de forma rutinaria, ni en los sectores públicos ni privados.
El proceso de preparación de la muestra permite la preservación de tejidos en estado óptimo hasta por 12 años7. Esto indica que los tejidos FFPE son una fuente de información útil para realizar la identificación de VPH en muestras de carcinomas escamosos de cuello uterino para estudios que nos permitan conocer la distribución de los genotipos asociados a lesiones malignas causadas por el virus, de manera longitudinal, así como estudios de vigilancia molecular de forma retrospectiva. Esto es cónsono con las estrategias de vigilancia molecular recomendadas por la Organización Mundial de la Salud (OMS), como elemento preparatorio ante futuras emergencias causadas por nuevas variantes virales, o la introducción de estas en una población determinada8.
Nuestro país se encuentra en un área de baja cobertura de vacunación contra el virus del papiloma humano, además de ser un área de alta frecuencia de cáncer de cérvix9. Lo anterior supone la necesidad de identificar los genotipos más frecuentes, a fin de diseñar las estrategias de prevención más acertadas y la selección de los tipos de vacuna más convenientes10.
Además, otros aspectos a tomar en cuenta incluyen el manejo de las muestras, el proceso de extracción y purificación del material genético, particularmente el manejo técnico; y los costos de las pruebas regulares de genotipificación en el mercado. En este sentido, es necesaria la exploración de técnicas que sean costo-efectivas para la identificación de los genotipos de VPH de alto riesgo de forma sustentable en un medio de recursos limitados.
Se han desarrollado varias técnicas moleculares para la detección del VPH, que incluyen ensayos de hibridación de ácido nucleico, ensayos de amplificación en cadena de la polimerasa (PCR), y ensayos basados en amplificación e hibridación in situ de fluorescencia11, 12. Sin embargo, la mayor parte de métodos implican un uso significativo de recursos, incluyendo el gasto de la prueba, equipo sofisticado y reactivos especializados, que pueden ser difíciles de obtener para países cuyos recursos son limitados. Esto plantea una limitante en cuanto al acceso a pruebas en el manejo rutinario de programas de cribado y diagnósticos complementarios en lesiones malignas. Está situación afecta en particular a países con menor abastecimiento económico y con sistemas de salud de bajos ingresos.
Una de las técnicas más utilizadas para la detección sistemática del material genético viral es la amplificación isotérmica mediada por bucle (LAMP). El LAMP es una variante de la reacción de cadena de polimerasa (PCR) convencional, esta requiere un calentamiento constante a la temperatura de reacción deseada y, cuando sea necesario, fluorescencia en tiempo real para las mediciones cuantitativas.13, 14 Gracias al incremento de los estudios con LAMP se han desarrollado varios ensayos de genotipificación para distintas afecciones, como AmpFire Genotyping HR HPV (Atila Biosystems, Mountain View, California), el cual está diseñado para la detección e identificación cualitativa, rápida, simple y precisa de 15 genotipos de VPH de alto riesgo.15
La importancia del ensayo AmpFire es la capacidad de procesamiento de muestras tumorales FFPE. Gracias a esta característica se puede valorar la introducción de este método de genotipificación en el país, como propuesta para la mejora del cribado de los pacientes con CACYC y CAC. Por el momento no hay estudios disponibles que corroboren que este ensayo funciona sin ninguna dificultad frente a las muestras del sistema de auto-toma, pero, por las características descritas de la técnica, como el gran número de distintos tipos de muestras admitidas para el ensayo y la ausencia del paso de extracción de ADN antes de la amplificación, se puede inferir que con el muestreo correcto el ensayo en cuestión puede ser factible.
Una de las características principales del ensayo AmpFire es su precio y su disponibilidad, representando un medio accesible ante los demás métodos de diagnóstico disponibles en el país, contribuyendo así a la mejora de los servicios de salud en entornos de bajos recursos. El propósito de esta investigación es explorar un método de detección del VPH de alto riesgo en tejidos fijados en formalina y embebidos en parafina como estrategia de identificación específica para estudios epidemiológicos y clínica en carcinomas de cérvix uterino y de cabeza y cuello.
Metodología
Población
El grupo estudiado comprende pacientes con carcinomas escamosos de cérvix y cabeza y cuello en muestras de tejido FFPE. Estas muestras fueron recogidas por los patólogos del Instituto de Medicina Tropical y Salud Global (IMTSAG) durante el período agosto-diciembre de 2021, a través de la biblioteca de bloques de parafina del Laboratorio de Patología del IMTSAG y de solicitudes a varios patólogos dominicanos. Se obtuvieron 20 muestras y 2 controles (tabla 1). Las muestras incluyeron carcinomas escamosos del aparato genitourinario inferior (cérvix), cabeza y cuello (amígdalas palatinas, cuerdas vocales y lengua) y como control negativo se tomaron muestras de adenocarcinoma de pulmón y vesícula biliar. El tejido FFPE fue obtenido a partir de un corte de 10 µm de los bloques de parafina que contenían la muestra de tejido obtenida para ser usado con fines de diagnóstico o terapéuticos por parte del personal de salud.
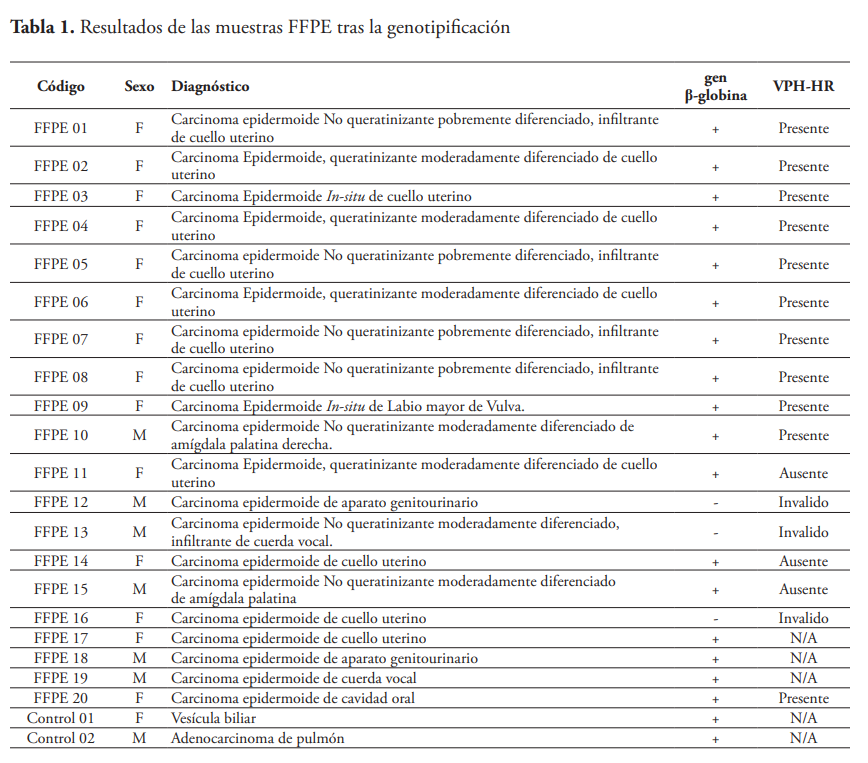
Examen Histopatológico
Mediante un estudio retrospectivo de muestras de tejido FFPE recolectadas en la biblioteca de bloques de parafina del Laboratorio de Patología celular y molecular del IMTSAG-UNIBE, se examinaron bajo microscopía óptica las muestras correspondientes a carcinomas epidermoides de cérvix y cabeza y cuello, donde se evidencia grupos de células malignas infiltrando el estroma con queratinización individual (figura 1A) y células pleomórficas con hipercromatismo y nucléolos visibles (figura 1B).
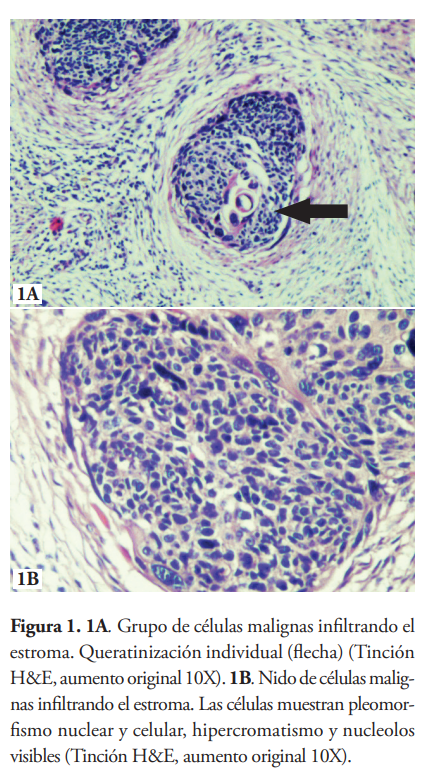
Genotipificación
Para la genotipificación de las muestras se utilizó una variante de la PCR llamada Amplificación Isotérmica mediada por Bucles con detección por fluorescencia a tiempo real (Real Time-LAMP). Para esto, utilizamos un kit AmpFire Genotype HR HPV (Atila BioSystems, Mountain View CA). Este kit incluía los siguientes reactivos: reaction mix, el cual contiene: bts polimerasas, tampón isotérmico, MgSO4 y dNTP, y las mezclas de cebadores 1, 2, 3 y 4, que cubren los genotipos de VPH 31/51/39/16, 35/68/18/59, 33/66/CI/45 y 58/56/53/52, respectivamente15. Como el ensayo Ampfire se realiza en condiciones isotérmicas, se utilizan 4-6 cebadores a la vez que reconocen 6-8 regiones del genoma de cada genotipo de VPH, esencialmente de las regiones E6 y E7. Los cebadores para cada genotipo se encuentran integrados en las distintas mezclas de cebadores del kit. El cebador para el gen de la β-globina humana (IC) se incluye para amplificar este gen en la misma reacción, sirviendo, así como control interno de la calidad y adecuación de la muestra: muestras negativas para VPH y el control de β-globina indican una muestra inadecuada.15
Los cebadores específicos para los genotipos del VPH 16/59/45/52, 39/18/66/53, 31/35/33/58 y 51/68/IC/56 y gen de β-globina fueron etiquetadas con CY5 (infrarrojo cercano), ROX (rojo), FAM (azul) y HEX (verde), respectivamente. Para cada muestra, los resultados de la genotipificación se codificaron e identificaron basándose en curvas de amplificación exponencial en los canales CY5, ROX, FAM y HEX en la disposición anterior de cuatro tubos de reacción. La ausencia de curva de amplificación exponencial en el canal HEX del primer mix 3 se interpretó como un resultado no válido, dado que contiene el control interno de la reacción (IC)15. Para este ensayo, los controles negativos y positivos proporcionados por el kit se incluyeron en cada experimento para garantizar la calidad13.
Ensayo de genotipificación de HPV
Todos los procedimientos siguieron las instrucciones del fabricante del kit comercial AmpFire HPV Genotyping assay (número de catálogo: GHPVF-100).
Preparación de las muestras
Para preparar las muestras FFPE se tomaron 10µm de la muestra en el portaobjetos y se introdujeron en un tubo de 1.5 mL. Se agregaron 200 µL de la solución A (PRMVR-10) para la separación de la muestra de la parafina. Se sometió a vórtex el tubo con la muestra por 30 segundos, luego se agregaron 50 µL del buffer de lisis. Se colocó el tubo con la muestra en un heat block y se incubó a 95 °C por 90 minutos.
Preparación reactivos para la reacción
Preparamos cuatro mezclas maestras combinando los reactivos provistos por el kit y siguiendo las indicaciones del fabricante, se agregó 23 μL de las mezclas en los pocillos correspondientes.
Preparación de la reacción
Agregamos 2 μL de cada muestra a cada uno de cuatro pocillos ue contenían las mezclas maestras. Luego ocupamos ocho pocillos adicionales con 2 μL de control positivo y 2 μL negativo por cada mezcla maestra. Colocamos las tiras en un termociclador Tianlong Gentier 96 con un volumen final de 25 μL por pocillo.
Preparación del termociclador
La reacción de PCR se llevó a cabo en un termociclador Tianlong Gentier 96 (Xi’an TianLong Science and Technology Co., Ltd.) con una desnaturalización inicial de 60 °C durante 30 segundos, seguido por 60 °C por 30 segundos en un total de 60 ciclos. El tiempo total de amplificación fue de 60 minutos.
Identificación de los genotipos
El sistema de software utilizado fue MDTL, el cual informa automáticamente los resultados de los valores de CT para cada curva de amplificación en todos los canales de fluorescencia. Como AmpFire es isotérmico, no hay ciclos y la TC es simplemente un marcador del tiempo de reacción (minutos). La falta de una curva de amplificación exponencial en el canal HEX se interpretó como un resultado no válido, esto dado que el control interno se encuentra en la mezcla de cebadores3.
La identificación de los genotipos se determinó mediante la tabla 2. Cada genotipo se identifica según el primer mix y el canal de fluorescencia en el que este se amplifica (figura 2).
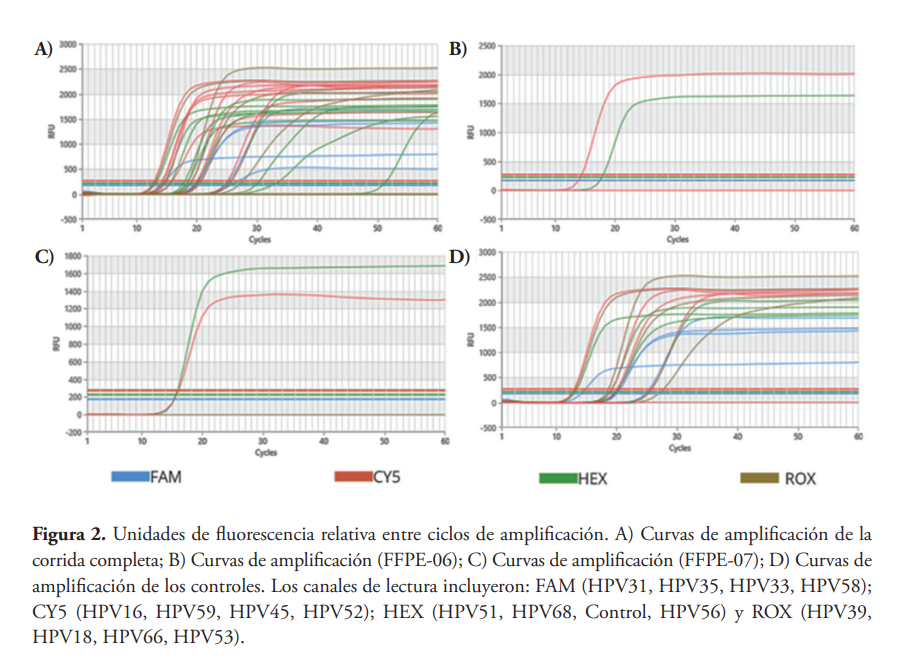
Resultados
Durante el piloto se recolectaron veinte casos de carcinomas epidermoides, los cuales se obtuvieron a partir de bloques de tejido en parafina o láminas no teñidas, las cuales se distribuyeron según su localización (tabla 1). En 17/20 (85 %) de las muestras se obtuvo un resultado válido de amplificación, esto debido a la amplificación del gen de la β-globina humana que se usó como control interno de la reacción. En el 70.5 % de las muestras con corridas válidas, se identificó la presencia del virus del papiloma humano en el tejido. Las muestras analizadas corresponden a carcinomas escamosos. Se identificaron 12 casos con presencia de VPH. De estos, 9/12 correspondieron al VPH16, las demás mostraron presencia de los genotipos VPH33, VPH39, y VPH52.
Comparación entre la frecuencia de genotipos de los subgrupos analizados
El genotipo con mayor frecuencia fue el 16. El resultado fue el esperado, puesto que el 90 % de los cánceres de cérvix son generados por VPH, principalmente por el genotipo 16 (en el caso de los CACYC, estos en su mayoría no se amplificaron correctamente por la falta del control interno en el ensayo (tabla 2).
Discusión
Los resultados obtenidos fueron similares a los de Tang et al., 2020, en donde se tomaron de igual forma carcinomas escamosos de cabeza/cuello y de cérvix. Encontraron que el genotipo más frecuente dentro de los dos grupos fue el 16, seguido por el 18.16 En nuestras muestras no identificamos el genotipo 18. Sin embargo, este piloto se realiza con un número reducido de muestras, lo cual no es necesariamente representativo de la realidad. A pesar de ser una nueva tecnología, por los resultados obtenidos podemos inferir que este ensayo puede ser un buen candidato para la genotipificación de muestras FFPE, principalmente en la República Dominicana, donde hasta la fecha no hay pruebas disponibles para realizar este proceso. Además, este ensayo cumple con las recomendaciones del CAP, dando una herramienta de bajo costo para empezar a realizar las pruebas en el país.
Los resultados inválidos (15 % de las muestras) pueden estar asociados al proceso de desparafinado, el cual es en este campo un reto conocido. Estas muestras, al ser colectadas en laboratorios de diagnóstico, no se sometieron a un riguroso control de verificación del grosor en micras del tejido, esto supone la presencia de acceso de material y, por ende, de potenciales inhibidoras de PCR.
Conclusión
Las muestras de tejidos FFPE permitieron obtener muestras válidas para la identificación de VPH de alto riesgo. El ensayo estudiado demostró ser un buen candidato para la introducción de técnicas de genotipificación en tejidos FFPE en la República Dominicana, cumpliendo así las recomendaciones establecidas por el Colegio Americano de Patólogos (CAP) para los pacientes con carcinoma epidermoide de cabeza y cuello y estudios epidemiológicos en cáncer de cérvix uterino. La determinación del costo estimado bruto de la técnica la sitúan como una gran alternativa costo-efectiva frente a otros métodos disponibles en el país, ya que este es significativamente más bajo que todas las opciones de mercado y el ensayo está validado para identificación de VPH en tejidos. El genotipo con mayor frecuencia en pacientes con carcinoma epidermoide de cuello uterino fue el HPV16, el cual, según lo establecido por el CAP, es el genotipo con mayor incidencia en los casos de cáncer cervical. Es necesario realizar estudios a mayor escala y con controles de producción de los cortes.
Agradecimientos
Los autores quieren agradecer al Laboratorio Medipath SRl por facilitar algunas láminas no teñidas para la obtención de tejidos. Todos los autores participaron por igual en la redacción del manuscrito y las conclusiones.
Aspectos Éticos
Todos los procedimientos fueron realizados siguiendo los estándares éticos del Comité de investigación institucional y nacional con la declaración de Helsinki de 1964 y sus posteriores modificaciones o estándares éticos comparables. Este estudio fue aprobado por el Comité de Bioética Institucional de la Universidad Iberoamericana cuyo código de aprobación corresponde al número CEI2021-6.
Conflictos de Interés
Ninguno de los autores informó ningún conflicto de intereses. La asistencia financiera para este estudio fue otorgado a los autores por la Universidad Iberoamericana (UNIBE).
Referencias
- Almonte M, Albero G, Molano M, Carcamo C, García PJ, Pérez G. Risk factors for Human Papillomavirus Exposure and Co-factors for Cervical Cancer in Latin America and the Caribbean. Vaccine. 2008;26:L16–36.
- Dunne EF, Park IU. HPV and HPV-Associated Diseases. Infectious Disease Clinics of North America. 2013;27(4):765–78.
- Acheampong LK, Effah K, Amuah JE, Tekpor E, Wormenor CM, Gedzah I, et al. Determining the prevalence of high-risk human papillomavirus infection using a novel cervical precancer screening approach in incarcerated women at the Nsawam Medium Security Prison, Ghana. Ecancermedicalscience, 2021;15:1248. Disponible en: https://pubmed.ncbi.nlm.nih.gov/34267804/ [cited 2022 May 26].
- Cao C-H, Liu R, Lin X-R, Luo J-Q, Cao L-J, Zhang Q-J, et al. LRP1B mutation is associated with tumor HPV status and promotes poor disease outcomes with a higher mutation count in HPV-related cervical carcinoma and head & neck squamous cell carcinoma. Int J Biol Sci, 2021;17(7):1744–56. Disponible en: http://dx.doi.org/10.7150/ijbs.56970 [citado el 26 de mayo de 2022].
- Lin C, Franceschi S, Clifford GM. Human papillomavirus types from infection to cancer in the anus, according to sex and HIV status: a systematic review and meta-analysis. The Lancet Infectious Diseases, 2018;18(2):198–206. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5805865/#:~:text=HPV16%20is%20by%20far%20the [cited 2021 May 29].
- Ferguson D, Mehrad M, Ely K, Shinn J, Lewis J. Human Papillomavirus Testing in Head and Neck Squamous Cell Carcinoma: Impact of the 2018 College of American Pathologists Guideline Among Referral Cases at a Large Academic Institution. Arch Pathol Lab Med, 2021;145(9):1123–31. Disponible en: https://doi.org/10.5858/arpa.2020-0220-OA
- Human Papillomavirus Testing in Head and Neck Carcinomas [Internet]. College of American Pathologists. Available from: https://www.cap.org/protocols-and-guidelines/cap-guidelines/current-cap-guidelines/human-papillomavirus-testing-in-[cited 2022 May 26].
- Global genomic surveillance strategy for pathogens with pandemic and epidemic potential, 2022–2032. Geneva: World Health Organization; 2022. Licence: CC BY-NC-SA 3.0 IGO.
- Liebermann E, Hammer MJ, Gúzman NF, Van Devanter N, Ompad D. Dominican Provider Practices for Cervical Cancer Screening in Santo Domingo and Monte Plata Provinces. Journal of Cancer Education, 2020;36(4):693–701.
- St. Laurent J, Luckett R, Feldman S. HPV vaccination and the effects on rates of HPV-related cancers. Current Problems in Cancer, 2018;42(5): 493–506.
- Guglielmo ZD, Rodríguez A. Métodos utilizados en la identificación del virus de papiloma humano. Anales del Sistema Sanitario de Navarra, 2010;33(1).
- Kocjan BJ, Hošnjak L, Poljak M. Detection of alpha human papillomaviruses in archival formalin-fixed, paraffin-embedded (FFPE) tissue specimens. Journal of Clinical Virology. 2016;76: S88–97.
- Vo DT, Story MD. Facile and direct detection of human papillomavirus (HPV) DNA in cells using loop-mediated isothermal amplification (LAMP). Molecular and Cellular Probes, 2021;59:101760. Available from: https://pubmed.ncbi.nlm.nih.gov/34364994/ [cited 2022 May 26].
- Notomi T. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research, 2000;28(12):63e63
- Effah K. Introducing AmpFire HPV testing in cervical precancer screening activities: experience from Battor. Ghana. 2021; HPV Newsletter. Disponible en: https://www.hpvworld.com/articles/introducing-ampfire-hpv-testing-in-cervical-precancer-screening-activities/
- Tang Y-W, Lozano L, Chen X, Querec TD, Katabi N, Moreno-Docón A, et al. An Isothermal, Multiplex Amplification Assay for Detection and Genotyping of Human Papillomaviruses in Formalin-Fixed, Paraffin-Embedded Tissues. The Journal of molecular diagnostics: JMD, 2020;22(3):419–28. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31978559/ [cited 2022 May 26].

