Ciencia y Salud, Vol. 8, No. 2, abril-junio, 2024 • ISSN (impreso): 0378-7680 • ISSN (en línea): 2613-8751 • Sitio web: https://revistas.intec.edu.do/
DETERMINACIÓN DEL GEN RAS COMO FACTOR PRONÓSTICO Y PREDICTIVO EN CÁNCER COLORRECTAL METASTÁSICO EN EL INSTITUTO DE ONCOLOGÍA DR. HERIBERTO PIETER, ENERO 2019 - DICIEMBRE 2021
Determination of the Ras gene as a prognostic and predictive factor in metastatic colorectal cancer at the Institute of Oncology Dr. Heriberto Pieter Oncology. January 2019 to December 2021
DOI: https://doi.org/10.22206/cysa.2024.v8i2.2655
Sui Lanni María Ceballos Sang1, Visanlly Carolina Laureano Páez2, Yordano Montesano3
1 Instituto de Oncología Dr. Heriberto Pieter. ORCID: https://orcid.org/0000-0002-7729-2131
2 Instituto de Oncología Dr. Heriberto Pieter. ORCID: https://orcid.org/0000-0003-4802-9753
3 Foundation for peace: Santo Domingo. ORCID: https://orcid.org/0000-0003-2338-9007
Recibido: 28 de octubre, 2022 • Aprobado: 18 de marzo, 2024
Cómo citar: Ceballos Sang S. L. M., Laureano Páez V. C., & Montesano Y. (2024). Determinación del gen Ras como factor pronóstico y predictivo en cáncer colorrectal metastásico en el Instituto de Oncología Dr. Heriberto Pieter, enero 2019 – diciembre 2021. Ciencia y Salud, 8(2), 65-75. ORCID: https://doi.org/10.22206/cysa.2024.v8i2.2655
Resumen
Objetivo: Determinar el gen RAS como factor pronóstico y predictivo en cáncer colorrectal metastásico.
Método: Es un estudio descriptivo y retrospectivo donde se examinaron 67 expedientes de pacientes con cáncer colorrectal metastásico, centrándose en la determinación del gen RAS como factor pronóstico y predictivo.
Resultados: Se halló que el 56.7% de los pacientes tenían tumores Wild-type y el 43.3% mostraba tumores con mutaciones KRAS, sin detectarse mutaciones en el gen NRAS. Tanto en el colon derecho como en el izquierdo, los tumores Wild-type fueron algo más comunes que los tumores con mutaciones KRAS. El codón 12 fue el más afectado en un 75.9% de los casos de tumores KRAS mutados. El adenocarcinoma fue el tipo histológico predominante (82%), seguido del adenocarcinoma mucinoso (16.5%). La mayoría de los pacientes (56.7%) se hallaban en estadio IV al diagnóstico. Los tumores KRAS mutados mostraron una mayor tendencia a la recurrencia y metástasis múltiples en comparación con los tumores Wild-type, siendo el hígado y el pulmón los sitios más comunes de metástasis. También se observaron diferencias en la supervivencia libre de progresión y la supervivencia global según el estado mutacional del gen RAS, con una mayor progresión en pacientes con tumores KRAS mutados.
Conclusión: Estos hallazgos sugieren que las mutaciones en el gen KRAS podrían asociarse con peor pronóstico en términos de progresión de la enfermedad y supervivencia. La determinación del estado del gen KRAS podría tener implicaciones clínicas significativas en la estratificación del riesgo y la planificación del tratamiento para pacientes con cáncer colorrectal metastásico.
Palabras claves: Cáncer colorrectal, gen RAS, KRAS, valor pronostico, valor predictivo, caracterización molecular, análisis de supervivencia, evaluación de biomarcadores.
Abstract
Objetive: Determining the RAS gene as a prognostic and predictive factor in metastatic colorectal cancer.
Method: This is a descriptive and retrospective study where 67 records of patients with metastatic colorectal cancer were examined, focusing on determining the RAS gene as a prognostic and predictive factor.
Results: It was found that 56.7% of patients had Wild-type tumors, while 43.3% showed tumors with KRAS mutations, with no mutations detected in the NRAS gene. Both in the right and left colon, Wild-type tumors were slightly more common than tumors with KRAS mutations. Codon 12 was the most affected in 75.9% of cases of KRAS mutated tumors. Adenocarcinoma was the predominant histological type (82%), followed by mucinous adenocarcinoma (16.5%). Most patients (56.7%) were at stage IV at diagnosis. KRAS mutated tumors showed a higher tendency for recurrence and multiple metastases compared to Wild-type tumors, with the liver and lungs being the most common sites of metastasis. Differences in progression-free survival and overall survival were also observed based on the mutational status of the RAS gene, with higher progression rates in patients with KRAS mutated tumors.
Conclusion: These findings suggest that mutations in the KRAS gene could be associated with a poorer prognosis in terms of disease progression and survival. Determining the status of the KRAS gene could have significant clinical implications in risk stratification and treatment planning for patients with metastatic colorectal cancer.
Keywords: Colorectal cancer, RAS gene, KRAS, prognostic value, predictive value, molecular characterization, survival analysis, biomarker evaluation.
Introducción
El cáncer colorrectal es una de las neoplasias más comunes y la segunda causa principal de muerte por cáncer a nivel mundial. Se proyectaba que para el 2020 habría más de 1,9 millones de nuevos casos y 935,000 muertes relacionadas con esta enfermedad. Un 20-25% de los pacientes son diagnosticados con enfermedad metastásica, con una mediana de supervivencia de aproximadamente cinco meses con terapia de soporte. A pesar de los avances en quimioterapia y terapias biológicas, la tasa de supervivencia a cinco años es solo del 14%.1-3
La familia de genes RAS, especialmente KRAS, está fuertemente implicada en el cáncer colorrectal, con mutaciones presentes en el 17-25% de todos los cánceres4.
En particular, entre el 30 y el 40% de los cánceres de colon tienen una mutación KRAS, asociada con una peor supervivencia y mayor agresividad tumoral.5
La caracterización molecular de los pacientes con cáncer colorrectal es crucial para el manejo clínico, ya que ayuda a seleccionar tratamientos más efectivos. El gen KRAS es un biomarcador importante para predecir la respuesta a terapias anti-EGFR. Los pacientes sin mutaciones en KRAS responden mejor a anticuerpos monoclonales anti-EGFR, mientras que aquellos con mutaciones son resistentes.6
Esta investigación busca determinar el estado mutacional del gen RAS en pacientes con cáncer colorrectal metastásico en el Instituto de Oncología Dr. Heriberto Pieter, estableciendo su relación como factor pronóstico y respuesta a terapias dirigidas al receptor del factor de crecimiento epidérmico. Esto permitirá una selección más precisa de tratamientos oncológicos y potencialmente mejorará la supervivencia de los pacientes.
Material y método
El estudio realizado fue de tipo descriptivo, de corte transversal y retrospectivo en el Instituto de Oncología Doctor Heriberto Pieter. Se llevó a cabo en un área específica del hospital dedicada a la atención oncológica, debido al gran número de pacientes con cáncer que asisten a este centro. El universo de estudio estuvo representado por 210 pacientes que se sometieron a pruebas moleculares durante un periodo de dos años. De ellos, 103 pacientes fueron seleccionados para determinar el estado mutacional del gen RAS, y finalmente se incluyeron 67 pacientes que cumplían con los criterios de inclusión y exclusión establecidos:
Criterios de inclusión:
- Pacientes mayores de 18 años.
- Diagnóstico histopatológico confirmado de cáncer colorrectal.
- Enfermedad o recurrente metastásicas.
- Haber recibido tratamiento para enfermedad metastásica.
Criterios de exclusión:
- Pacientes menores de 18 años.
- Pacientes sin expediente clínico.
- Enfermedad temprana o localmente avanzada.
Se diseñó un instrumento de recolección de datos con 12 preguntas, y se obtuvo permiso para acceder al registro de biología molecular del Departamento de Patología. Los datos recopilados fueron tabulados, computarizados e ilustrados en cuadros y gráficos para su mejor interpretación y análisis. El análisis se realizó utilizando frecuencias simples. El estudio se llevó a cabo con estricto apego a las normativas éticas internacionales, incluyendo la Declaración de Helsinki y las pautas del Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS). Se obtuvo la aprobación del Comité de Ética de la Universidad UNPHU y de la Unidad de Enseñanza del Instituto de Oncología Dr. Heriberto Pieter. Se protegió la confidencialidad de los datos recopilados y se manejaron con suma cautela, garantizando la privacidad y la seguridad de la información de los pacientes.
Resultados
Gráfico 1. Distribución por sexo
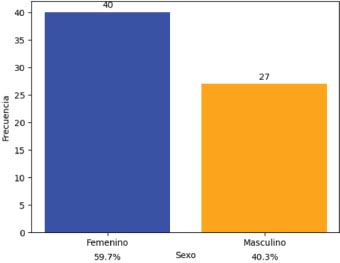
El 59.7 por ciento de los pacientes incluidos en el estudio pertenecen al sexo femenino, frente a 40.3 por ciento que pertenecen al sexo masculino.
Gráfico 2. Distribución por edad
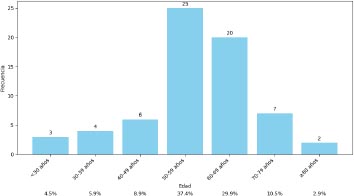
El rango de edad más afectado se encontró entre los 50 a 59 años en un 37.4 por ciento, seguido de los comprendidos entre 60 a 69 años en un 29.9 por ciento. El rango de edad menos afectado comprendió los pacientes mayores de 80 años en apenas un 2.9 por ciento y llama la atención el 19 por ciento de pacientes menores de 50 años.
Gráfico 3. Localización del tumor primario
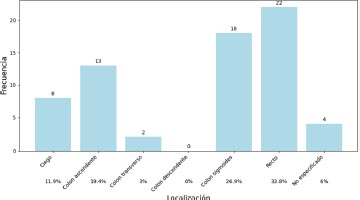
La localización más frecuente del tumor primario correspondió al recto en un 32.8 por ciento, seguido del colon sigmoides en un 26.9 por ciento. La localización menos frecuente fue el colon descendente donde no se registró tumor.
Tabla 1. Distribución según la lateralidad del tumor primario
Lateralidad |
Frecuencia |
Porcentaje |
Colon derecho |
25 |
37.3 |
Colon izquierdo |
42 |
62.7 |
Total |
67 |
100 |
En cuanto a lateralidad del tumor primario, el 62.7 por ciento eran tumores de colon izquierdo, frente al 37.3 por ciento que correspondían a colon derecho.
Gráfico 4. Distribución según estado mutacional
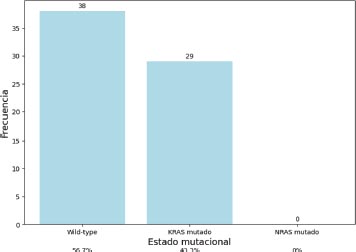
El 56.7 por ciento de los pacientes albergaban tumores de tipo Wild-type y el 43.3 por ciento albergaban tumores KRAS mutado. No hubo mutación en el NRAS
Gráfico 5. Distribución del estado mutacional según lateralidad
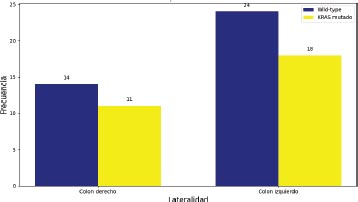
Los tumores wild-type se presentaron el 56 por ciento en colon derecho, frente al 57 por ciento en colon izquierdo, mientras que, los tumores KRAS mutados se presentaron el 44 por ciento en colon derecho, frente al 43 por ciento en colon izquierdo.
Gráfico 6. Distribución según el codón afectado
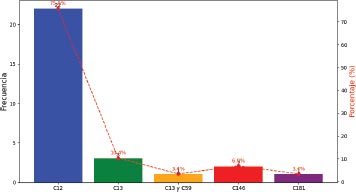
El codón afectado con mayor frecuencia correspondió al codón 12 en un 75.9 por ciento, seguido del codón 13, y los menos afectados fueron los codones 59 y 181 que se presentaron en un 3.4 por ciento cada uno.
Gráfico 7. Distribución según el tipo histológico
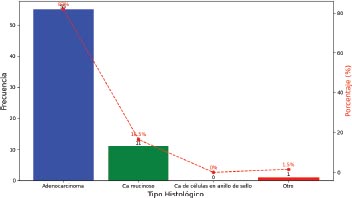
El tipo histológico adenocarcinoma fue el más predominante en el 82 por ciento de los casos, seguido del adenocarcinoma mucinoso en el 16.5 por ciento.
Gráfico 8. Distribución según el estadio clínico inicial
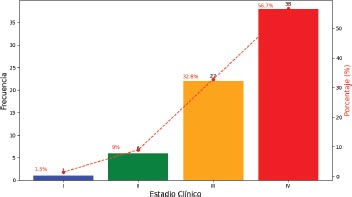
El estadio clínico inicial más frecuente fue el estadio IV en un 56.7 por ciento y el menos frecuente fue el estadio I en el 1.5 por ciento.
Gráfico 9. Distribución de los pacientes que tuvieron recurrencia de cáncer según el estado mutacional
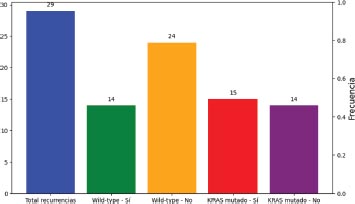
El 43.3 por ciento de los pacientes del estudio habían presentado enfermedad recurrente. Según el estado mutacional, los tumores que más frecuentemente recurrieron fueron los tumores KRAS mutado en el 51.7 por ciento, frente al 36.8 por ciento de los tumores wild-type.
Gráfico 10. Distribución del número de metástasis según el estado mutacional
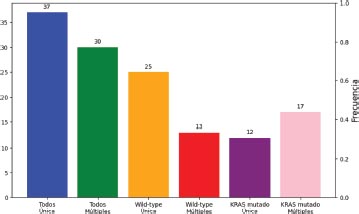
El 55.2 por ciento de los pacientes tenían enfermedad metastásica única, frente al 44.8 por ciento que tenían metástasis múltiples. Las metástasis múltiples fueron más frecuentes en los tumores KRAS mutados en el 58.6 por ciento de los casos, frente a 34.2 por ciento en los tumores wild-type.
Gráfico 11. Distribución de la localización de las metástasis
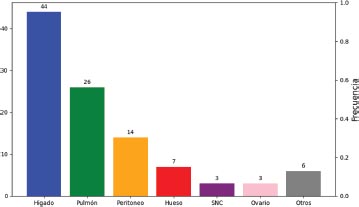
El lugar más frecuente de metástasis fue el hígado en el 66 por ciento de los casos, seguido del pulmón en el 39 por ciento. Los menos frecuentes fueron ovario y SNC que se presentaron en un 4 por ciento de los casos cada uno.
Gráfico 12. Supervivencia libre de progresión (SLP) a un año global
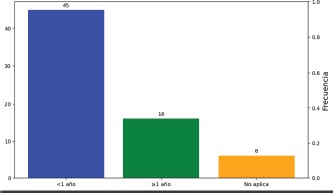
Gráfico 13. Supervivencia libre de progresión (SLP) a un año según el estado mutacional
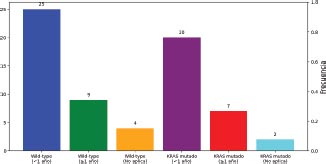
En cuanto a la SLP según el estado mutacional, el 65.8 por ciento de los pacientes con tumores wild-type habían progresado en menos de 1 año, frente al 69 por ciento de los tumores KRAS mutado (ver gráfico 16). La mediana fue de 7 meses para los pacientes wild-type y de 8 meses para los KRAS mutado
Gráfico 14. Supervivencia global (SG) a dos años
El 46.3% de los pacientes habían fallecido antes de 2 años y sólo el 35.8% se mantenían vivos, con una mediana de 20 meses.
Discusión
En los 67 pacientes que cumplieron los criterios de inclusión y exclusión, la localización más frecuente del tumor primario correspondió al recto en un 32.8 por ciento, seguido del colon sigmoides en un 26.9 por ciento. Según el lado afectado, si era derecho o izquierdo, el 62.7 por ciento eran tumores de colon izquierdo frente al 37.3 por ciento que correspondían al colon derecho. Esto concuerda con el estudio publicado por Ucar G, Ergun Y, Aktürk-Esen S, Acikgoz Y, Dirikoc M, Esen Y, et al en el 2020, en el cual el 37 por ciento de los tumores estaban localizados en el recto, el 35 por ciento en el colon izquierdo y el 28 por ciento restante en el colon derecho. También concuerda con Romero A, Orlandi W y González JC (2016), en su estudio "Cáncer colorrectal: características de la expresión del oncogen K-RAS" donde hubo mayor afectación en el colon izquierdo (68.6 %).3-7
En cuanto al estado mutacional, el 56.7 por ciento de los pacientes albergaban tumores de tipo Wild-type, frente al 43.3 por ciento que albergaban tumores KRAS mutado. Los tumores KRAS mutados se presentaron el 44 por ciento en el colon derecho, frente al 43 por ciento en el colon izquierdo. El codón afectado con mayor frecuencia correspondió al codón 12 en un 75.9 por ciento, seguido del codón 13. Esto se correlaciona con el análisis presentado por Liang L, Tian J, Yu Y, Wang Z, Peng K, Liu R, et al (2018),8-10 donde la tasa de mutación de KRAS fue del 42.8 por ciento, pero difiere con un estudio realizado en el Hospital Universitario de Caracas por Romero A, Orlandi W y González JC (2016), donde sólo el 20 por ciento presentó mutación de KRAS. También en este estudio el 85.71 por ciento reportó mutación en el codón 12 y 14.28 por ciento en el codón 13, de las cuales el 57.14 por ciento se localizaron en el colon izquierdo y el 28.5 por ciento en el colon derecho, lo cual concuerda con esta investigación.11-13
En cuanto al tipo histológico y el grado de diferenciación, en el estudio realizado por Romero A, Orlandi W y González JC (2016), el 100 por ciento de la muestra por histología correspondió a adenocarcinoma, predominando el tipo moderadamente diferenciado (40 %). Esto se correlaciona con lo presentado en esta investigación donde el adenocarcinoma fue el tipo histológico más predominante en el 98.5 por ciento de los casos, más difiere en cuanto al grado de diferenciación, donde los tumores moderadamente diferenciados representan el 92.5 por ciento de los casos. El estadio clínico inicial más frecuente fue el estadio IV en el 56.7 por ciento de los casos. Esto concuerda con el estudio publicado en Perú por Franklin Aldecoa en el 2020, "Supervivencia global del cáncer colorrectal metastásico en Lima Metropolitana y la relación con el estado mutacional del gen KRAS", donde el 60 por ciento de los pacientes presentaron metástasis al momento del diagnóstico.
El 55.2 por ciento de los pacientes presentaron enfermedad metastásica única, frente al 44.8 por ciento que tenían metástasis múltiples. Las metástasis múltiples fueron más frecuentes en los tumores KRAS mutados en el 58.6 por ciento de los casos, siendo el lugar más frecuente el hígado en el 66 por ciento, seguido del pulmón en el 39 por ciento. Esto contrasta con lo presentado por Ucar G, Ergun Y, Aktürk-Esen S, Acikgoz Y, Dirikoc M, Esen Y, et al, en su estudio en el 2020 sobre el valor pronóstico y predictivo del número de mutaciones de KRAS en el cáncer colorrectal metastásico, donde las metástasis múltiples se evidenciaron en sólo el 33 por ciento de los pacientes mutados, más concuerda en que los lugares de metástasis más frecuentes son el hígado (68 %) y pulmón (26 %).13,12
Ucar G, Ergun Y, Aktürk-Esen S, Acikgoz Y, Dirikoc M, Esen Y, et al (2020), en su estudio publicaron que el régimen de quimioterapia de primera línea se basó en oxaliplatino en el 65 por ciento e irinotecán en el 35 por ciento, y que sólo el 50 por ciento de los pacientes recibió bevacizumab en primera línea. Esto difiere a lo observado en esta investigación donde el 86.6 por ciento de los pacientes recibieron quimioterapia basada en oxaliplatino en primera línea y el 80.6 por ciento recibió bevacizumab.14
En cuanto a la supervivencia libre de progresión, el 67 por ciento de los pacientes habían progresado antes del año de haber iniciado tratamiento y sólo el 24 por ciento se mantenían libres de progresión al año, con una mediana de 7 meses. Esto contrasta con los resultados presentados por Tejpar S, Stintzing S, Ciardiello F, Tabernero J, Van Cutsem E, Beier F, et al, en el ensayo FIRE-3 en el 2017, donde la mediana de supervivencia libre de progresión fue de 10 meses. El valor predictivo del gen RAS frente a las terapias dirigidas al receptor del factor de crecimiento epidérmico (EGFR) no pudo ser evaluado, ya que sólo 3 pacientes recibieron cetuximab y, por lo tanto, no hay datos suficientes para sustentar una discusión.15
Conclusiones
- El 59.7 por ciento de los pacientes incluidos en el estudio pertenecen al sexo femenino.
- El rango de edad más afectado se encontró entre los 50 y 59 años, representando un 37.4 por ciento.
- Los tumores en el colon izquierdo se presentaron en el 62.7 por ciento de los pacientes, siendo el recto la localización anatómica más frecuente.
- Las mutaciones de KRAS se presentaron en el 43.3 por ciento de los tumores, afectando con mayor frecuencia al codón 12. No hubo diferencias en la frecuencia de mutaciones según la lateralidad del tumor.
- El adenocarcinoma fue el tipo histológico más predominante en el 82 por ciento de los casos.
- El grado histológico más frecuente fue el moderadamente diferenciado en el 92.5 por ciento.
- El estadio IV fue el estadio clínico inicial que se presentó con mayor frecuencia, en un 56.7 por ciento de los casos.
- El 43.3 por ciento de los pacientes habían presentado enfermedad recurrente, siendo más común en tumores KRAS mutados.
- El 55.2 por ciento de los pacientes tenían enfermedad metastásica única.
- Las metástasis múltiples se observaron en el 58.6 por ciento de los tumores KRAS mutados, siendo el hígado y el pulmón las localizaciones más frecuentes.
- El 86.6 por ciento de los pacientes recibieron quimioterapia en primera línea basada en oxaliplatino.
- El anticuerpo monoclonal más utilizado fue el bevacizumab, en el 80.6 por ciento de los casos.
- La supervivencia libre de progresión a un año fue del 24 por ciento, con una mediana de 7 meses para los tumores wild-type y de 8 meses para los KRAS mutados.
- La supervivencia global a 2 años fue del 35.8%, con una mediana de 20 meses.
- La alta prevalencia de tumores en el colon izquierdo y la frecuencia significativa de mutaciones en el gen KRAS sugieren la importancia de una detección temprana y un tratamiento dirigido específicamente en pacientes con cáncer colorrectal metastásico. Estos hallazgos destacan la necesidad de desarrollar estrategias de detección precoz y de identificación de biomarcadores para una mejor selección de tratamientos personalizados, lo que podría mejorar la tasa de supervivencia y calidad de vida de los pacientes.
Recomendaciones
- Realizar determinación del gen RAS o prueba de RAS extendido a todos los pacientes con cáncer colorrectal metastásico, ya que se ha demostrado su utilidad como factor pronóstico y predictivo de respuesta.
- Evitar realizar la determinación del gen RAS en el contexto de enfermedad local o localmente avanzada y limitarla para casos seleccionados, ya que se ha visto una variabilidad de hasta un 20% más de mutaciones al momento de la recurrencia.
- Esperar el reporte de la prueba de RAS extendido antes de hacer la elección del anticuerpo monoclonal y así determinar qué pacientes pudiesen beneficiarse de otras terapias.
- Implementar un mayor uso de terapias dirigidas al receptor del factor de crecimiento epidérmico, especialmente en pacientes con tumores de colon izquierdo no mutados ya que, aunque no se ha evidenciado diferencias en cuanto a supervivencia libre de progresión, sí se ha demostrado un beneficio en supervivencia global cuando se elige en primera línea la combinación con un anti- EGFR.
- Además de la prueba de RAS extendido, existen otros biomarcadores predictivos de suma utilidad que deben realizarse antes de hacer la decisión terapéutica como son el estado microsatelital, MMR, estado de BRAF y HER2, por lo que mejorar el acceso a estas pruebas es de vital importancia.
- Promover la integración de equipos multidisciplinarios en el manejo de pacientes con cáncer colorrectal metastásico, que incluyan oncólogos médicos, cirujanos, radioterapeutas, patólogos, genetistas y otros especialistas pertinentes. Esta colaboración interdisciplinaria puede facilitar la evaluación integral del paciente, la discusión de casos complejos y la toma de decisiones terapéuticas individualizadas, lo que podría mejorar los resultados clínicos y la calidad de vida de los pacientes.
Referencias
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021; 71: 209-249.
2. Liang L, Tian J, Yu Y, Wang Z, Peng K, Liu R, et al. An Analysis of Relationship Between RAS Mutations and Prognosis of Primary Tumour Resection for Metastatic Colorectal Cancer Patients. Cell Physiol Biochem. 2018; 50:768-782.
3. Ucar G, Ergun Y, Aktürk-Esen S, Acikgoz Y, Dirikoc M, Esen Y, Bal Ö, Uncu D. Prognostic and predictive value of KRAS mutation number in metastatic colorectal cancer. Medicine. 2020; 99(39): e22407.
4. Arrington A, Heinrich E, Lee W, Duldulao M, Patel S, Sanchez J, et al. Prognostic and predictive roles of KRAS mutation in colorectal cancer. Int J Mol Sci. 2012; 13: 12153-12168.
5. Bylsma LC, Gillezeau C, Garawin TA, Kelsh MA, Fryzek JP, Sangaré L, Lowe KA. Prevalence of RAS and BRAF mutations in metastatic colorectal cancer patients by tumor sidedness: A systematic review and meta-analysis. Cancer Med. 2020; 9(3): 1044-1057.
6. Afanador C, Palacio K, Isaza L, Ahumada E, Ocampo C, Muñetón C. Caracterización molecular de pacientes con cáncer colorrectal. Biomédica. 2022; 42: 154-171.
7. Aldecoa F. Supervivencia global del cáncer colorrectal metastásico en Lima Metropolitana: relación con el estado mutacional del gen KRAS. Acta Médica Peruana. 2020; 37(2): 122-129.
8. Moon BS, Jeong WJ, Park J, Kim TI, Min S, Choi KY. Role of oncogenic K-Ras in cancer stem cell activation by aberrant Wnt/β-catenin signaling. J Natl Cancer Inst. 2014; 106(2): djt373.
9. Siegel R, Fedewa S, Anderson W. Colorectal cancer incidence patterns in the United States, 1974-2013. Journal of the National Cancer Institute. 2017; 109.
10. Awad H, Abu-Shanab A, Hammad N, Atallah A, Abdulattif M. Demographic features of patients with colorectal carcinoma based on 14 years of experience at Jordan University Hospital. Ann Saudi Med. 2018; 38(6): 427-432.
11. Romero A, Orlandi W, González JC. Cáncer Colorectal: características de la expresión del oncogen K-ras. Gen. 2016; 70(2): 048-053.
12. Rowland A, Dias MM, Wiese MD, Kichenadasse G, McKinnon RA, Karapetis CS, et al. Meta-analysis comparing the efficacy of anti-EGFR monoclonal antibody therapy between KRAS G13D and other KRAS mutant metastatic colorectal cancer tumours. Eur J Cancer. 2016; 55: 122-30. Epub 2016 Jan 23.
13. Marzouk O, Schofield J. Review of Histopathological and Molecular Prognostic Features in Colorectal Cancer. Cancers. 2011; 3(2): 2767–2810.
14. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer Journal for Clinicians. 2016; 66: 7.
15. Tejpar S, Stintzing S, Ciardiello F, Tabernero J, Van Cutsem E, Beier F, et al. Prognostic and Predictive Relevance of Primary Tumor Location in Patients with RAS Wild-Type Metastatic Colorectal Cancer: Retrospective Analyses of the CRYSTAL and FIRE-3 Trials. JAMA Oncol. 2017; 3(2): 194-201.
