Ciencia y Salud, Vol. VI, No. 2, mayo-agosto, 2022 • ISSN (impreso): 2613-8816 • ISSN (en línea): 2613-8824 • Sitio web: https://revistas.intec.edu.do/
Cambios en el metabolismo óseo y mineral en pacientes con Enfermedad Renal Crónica sometidos a trasplante renal en el Hospital General Plaza de la Salud durante el período comprendido entre enero 2010–agosto 2018
Changes in bone and mineral metabolism in patients with chronic kidney disease undergoing kidney transplantation at Plaza de la Salud General Hospital during the period between January 2010–August 2018
Cómo citar: Moreno A, Yangüela A. Cambios en el metabolismo óseo y mineral en pacientes con Enfermedad Renal Crónica sometidos a trasplante renal en el Hospital General Plaza de la Salud durante el período comprendido entre enero 2010–agosto 2018. cysa [Internet]. [citado 17 de mayo de 2022];6(2):49-60. Disponible en: https://revistas.intec.edu.do/index.php/cisa/article/view/2501
Introducción
Las alteraciones minerales y óseas del trasplante renal son principalmente manifestadas por anomalías del metabolismo del calcio, fósforo, hormona paratiroidea y vitamina D; alteraciones del remodelado óseo, mineralización, volumen, estructura o resistencia y calcificaciones vasculares y de tejidos blandos1-4. Las alteraciones del metabolismo óseo-mineral son una causa importante de morbilidad en los pacientes con trasplante renal, por lo que el manejo de las complicaciones del paciente trasplantado, a largo plazo, deben de ser seguidas5-7. Su expresión puede ser muy variable y abarca desde alteraciones de los parámetros analíticos en el post trasplante inmediato hasta cambios en la densidad y arquitectura ósea a medio y largo plazo8, 9.
En este estudio se evaluaron los cambios de calcio, fósforo, hormona paratiroidea, nitrógeno ureico (BUN) y creatinina antes y tres meses después del procedimiento y las prevalencias de las complicaciones post trasplante (fracturas, rechazo, etc.). Se identificaron los factores influyentes, los cambios en los parámetros minerales en los pacientes que utilizaron Terapia Protectora Mineral (TPM) pre y post trasplante y Terapia Inmunosupresora (TI) después del trasplante, la función del injerto renal y los cambios según el Tiempo en Hemodiálisis pre trasplante hasta tres meses después del mismo.
Materiales, herramientas y métodos
1. Métodos y técnicas de investigación
El estudio fue realizado entre enero del 2010 – agosto del 2018 en el departamento de Trasplante de Tejidos y Órganos del Hospital General Plaza de la Salud. El método a utilizar en el estudio fue el análisis documental de los expedientes clínicos de los pacientes que sufren de enfermedad renal crónica, sometidos a Trasplante Renal en el Hospital General Plaza de la Salud; la técnica fue la observación indirecta, ya que el estudio se conforma de impresiones derivadas de fuentes secundarias mediante la recolección de datos. El método es analítico, pues se basa en la observación de las variables para comprender mejor el comportamiento del metabolismo óseo y mineral luego de un paciente someterse a trasplante renal, lo cual ayuda a hacer analogías y a establecer nuevas teorías en cuanto al manejo del paciente y cómo debe de ser tratado correctamente antes y después del trasplante.
2. Instrumentos de recolección de datos
Se utilizaron extractos de base de datos obtenidos de los expedientes clínicos electrónicos disponibles en el Hospital General Plaza de la Salud. Los datos seleccionados de cada paciente conforman las variables del estudio, por lo cual se organizaron en una ficha siguiendo los siguientes criterios: edad, género, tiempo en hemodiálisis, etiología de enfermedad renal crónica, terapia inmunosupresora, terapia protectora mineral, valores de calcio, fósforo, PTH, BUN y creatinina. La ficha cuenta con todos los criterios de inclusión/exclusión para facilitar la dinámica de exclusión de los pacientes. El estudio incluyó pacientes mayores de 18 años con Enfermedad Renal Crónica sometido a Trasplante Renal en el Hospital General Plaza de la Salud (HGPS). Las variables que sirven como criterio de exclusión por su relación con la Enfermedad Renal Crónica y pacientes sometidos a Trasplante Renal son: pacientes con enfermedades de la glándula paratiroides conocida (tumor primario de la glándula paratiroides), pacientes menores de 18 años de edad, paratiroidectomía previa, múltiples trasplantes renales, trasplanectomía, enfermedad hepática Otras variables que sirven como criterio de exclusión por dificultar la recolección de datos medibles de la investigación son: récord clínico incompleto (de los datos obtenidos de los récords clínicos electrónicos) y paciente con seguimiento post trasplante renal en otro centro de salud.
3. Procedimiento para el procesamiento y análisis de datos
Luego de recolectar las mediciones de las variables del estudio, se realizó el análisis estadístico de las mismas a través del Software Epi Info versión 7.15. Con los datos obtenidos se elaboró la tabla de las características basales de los pacientes. Finalmente, para el análisis de bivariables entre las variables independientes y dependientes se utilizó la prueba t de Student Pareada.
Resultados
Los cambios agudos del metabolismo óseo y mineral en los pacientes del estudio se evaluaron mediante variables como niveles séricos de Ca, P y PTH al momento del trasplante renal y tres meses post trasplante; asimismo, cómo estos valores fueron afectados según el género del paciente, tiempo en terapia dialítica pretrasplante renal, uso de terapia inmunosupresora, uso de terapia protectora mineral pre y post trasplante renal, tipo de donante, etiología de enfermedad renal crónica, comorbilidades y complicaciones. También se evaluó la función renal al momento del trasplante renal y tres meses post trasplante en los pacientes del estudio, mediante variables como los niveles séricos de BUN y creatinina.
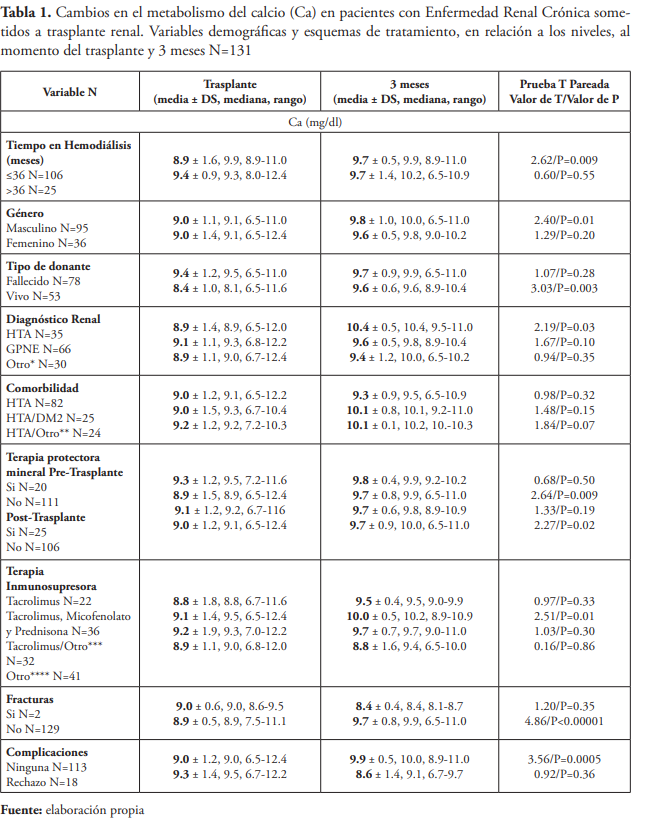
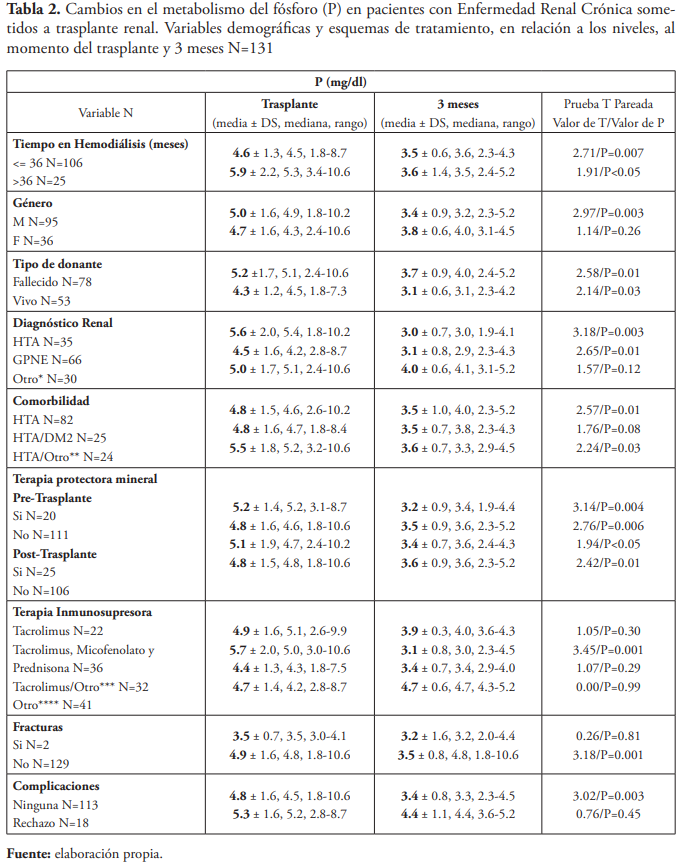
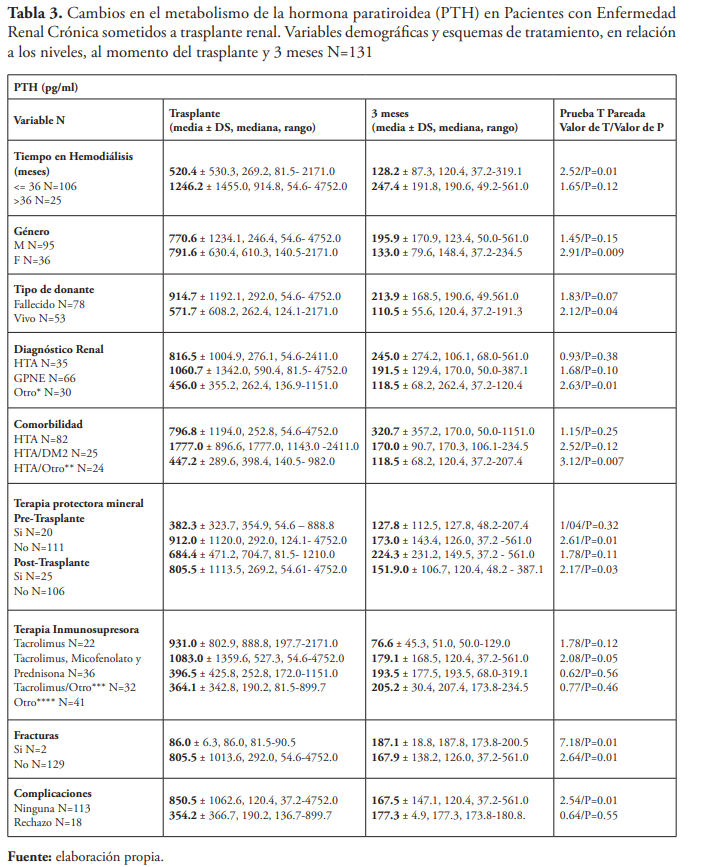
Se concluyó que los cambios generales en los niveles séricos de Ca, P, PTH, BUN y creatinina desde el momento del trasplante renal a los tres meses post trasplante renal fueron todos significativos. Se observó un aumento en los niveles de Ca (9.0 ± 1.2 vs. 9.7 ± 0.8 mg/dL; P=0.007) y una disminución en los niveles de P (4.9 ± 1.6 vs. 3.5 ± 0.8 mg/dL; P=0.002), en los niveles de PTH (779.6 ± 1004.0 vs. 167.9 ± 138.2 pg/mL; P=0.01), en los niveles de creatinina (7.3 ± 3.5 vs. 1.6 ± 0.9 mg/dL; P<0.00001) y en los niveles BUN (de 36.8 ± 14.1 a 21.3 ± 12.4 mg/dL; P<0.00001).
En los pacientes masculinos hubo un aumento significativo en los niveles de Ca (9.0 ± 1.1 vs. 9.8 ± 1.0 mg/dL; P=0.01) y una disminución significativa en los niveles de P (5.0 ± 1.6 vs. 3.4 ± 0.9 mg/dL; P=0.003). En los pacientes femeninos hubo una disminución significativa en los niveles de PTH (791.6 ± 630.4 vs. 133.0 ± 79.6 pg/mL; P=0.009), mientras que no hubo cambios significativos en los niveles de Ca y P en pacientes femeninos.
Los pacientes que estuvieron ≤ 36 meses en hemodiálisis presentaron un aumento significativo en los niveles de Ca (8.9 ± 1.6 vs. 9.7 ± 0.5 mg/dL; P=0.009, una disminución significativa en los niveles de P (4.6 ± 1.3 vs. 3.5 ± 0.6 mg/dL; P=0.007), y en los niveles de PTH (520.4 ± 530.3 vs. 128.2 ± 87.3 pg/mL; P=0.01). Se observó una disminución significativa en los niveles de P en los pacientes sometidos a hemodiálisis > 36 meses (5.9 ± 2.2 vs. 3.6 ± 1.4 mg/dL; P<0.05). Mientras que los cambios en los niveles de Ca y PTH no fueron significativos en los pacientes sometidos a hemodiálisis > 36 meses.
Los pacientes que recibieron injerto renal de donantes vivos presentaron un aumento significativo en los niveles de Ca (8.4 ± 1.0 vs. 9.6 ± 0.6 mg/dL; P= 0.003), una disminución significativa en los niveles de P (4.3 ± 1.2 vs. 3.1 ± 0.6 mg/dL; P=0.03) y en los niveles de PTH (571.7 ± 608.2 vs. 110.5 ± 55.6 pg/mL; P=0.04). También se identificó una disminución significativa en los niveles de P en los pacientes que recibieron injerto renal de un donante fallecido (5.2 ± 1.7 vs. 3.7 ± 0.9 mg/dL; P=0.01), mientras que los cambios en los niveles de Ca y PTH no fueron significativos.
En los pacientes que tuvieron HTA como comorbilidad hubo una disminución significativa en los niveles de P (4.8 ± 1.5 vs. 3.5 ± 1.0 mg/dL; P=0.01) y en los pacientes que tuvieron HTA y otras comorbilidades hubo una disminución significativa en los niveles de PTH (447.2 ± 289.6 vs. 118.5 ± 68.2 pg/mL; P=0.007).
En los pacientes que no utilizaron terapia protectora mineral pretrasplante renal hubo un aumento significativo en los niveles de Ca (8.9 ± 1.5 vs. 9.7 ± 0.8 mg/dL; P=0.009), una disminución significativa en los niveles de P (4.8 ± 1.6 vs. 3.5 ± 0.9 mg/dL; P=0.006) y en los niveles de PTH (912.0 ± 1120.0 vs. 173.0 ± 143.4 pg/mL; P=0.01). También se identificó una disminución significativa en los niveles de P en aquellos que sí utilizaron terapia pretrasplante renal (5.2 ± 1.4 vs 3.2 ± 0.9 mg/dL; P=0.004). Mientras que no hubo cambios significativos en los niveles de Ca y PTH en los pacientes que utilizaron terapia protectora mineral pretrasplante renal.
Los pacientes que no utilizaron terapia protectora mineral post trasplante renal presentaron un aumento significativo en los niveles de Ca (9.0 ± 1.2 vs. 9.7 ± 0.9 mg/dL; P=0.02), una disminución significativa en los niveles de P (4.8 ± 1.5 vs. 3.6 ± 0.9 mg/dL; P=0.01) y en los niveles de PTH (805.5 ± 1113.5 vs. 151.9 ± 106.7 mg/dL; P=0.03). Se observó una disminución significativa en los niveles de P en aquellos que utilizaron terapia post trasplante renal (5.1 ± 1.9 vs. 3.4 ± 0.7 mg/dL; P<0.05). Mientras que no hubo cambios significativos en los niveles de Ca y PTH en aquellos que sí utilizaron terapia post trasplante renal.
Los pacientes que utilizaron tacrolimus, micofenolato y prednisona presentaron un aumento significativo en los niveles de Ca (9.1 ± 1.4 vs. 10.0 ± 0.5 mg/dL; P=0.01), una disminución significativa en los niveles de P (5.7 ± 2.0 vs. 3.1 ± 0.8 mg/dL; P=0.001) y los niveles de PTH (1083.0 ± 1359.6 vs. 179.1 ± 168.5 pg/mL; P=0.05). Mientras que no hubo cambios significativos en los niveles de Ca, P y PTH en los pacientes sometidos a otras combinaciones de terapia inmunosupresora post trasplante renal. En un estudio llevado a cabo en Eslovenia, 21 (4 %) de los pacientes evaluados utilizaron tacrolimus como única terapia inmunosupresora, pero no identificaron cambios significativos en el metabolismo óseo y mineral según el tipo de terapia inmunosupresora que utilizaron los pacientes10.
Los pacientes sin fracturas presentaron un aumento significativo en los niveles de Ca (8.9 ± 0.5 vs. 9.7 ± 0.8 mg/dL; P<0.00001), una disminución significativa en los niveles de P (4.9 ± 1.6 vs. 3.5 ± 0.8 mg/dL; P=0.001) y en los niveles de PTH (805.5 ± 1013.6 vs. 167.9 ± 138.2 pg/mL; P=0.01), también aquellos con fracturas presentaron un aumento significativo en los niveles de PTH (86.0 ± 6.3 vs. 187.1 ± 18.8 pg/mL; P=0.01). No hubo cambios significativos en los niveles de Ca y P en los pacientes con fracturas.
Los pacientes sin complicaciones presentaron un aumento significativo en los niveles de Ca (9.0 ± 1.2 vs. 9.9 ± 0.5 mg/dL; P=0.0005), una disminución significativa en los niveles de P (4.8 ± 1.6 vs. 3.4 ± 0.8 mg/dL; P=0.003) y los niveles de PTH (850.5 ± 1062.6 vs. 167.5 ± 147.1 pg/mL; P=0.01). Aquellos con rechazo al injerto renal como complicación no presentaron cambios significativos en los niveles de Ca, P o PTH después del trasplante renal.
Discusión
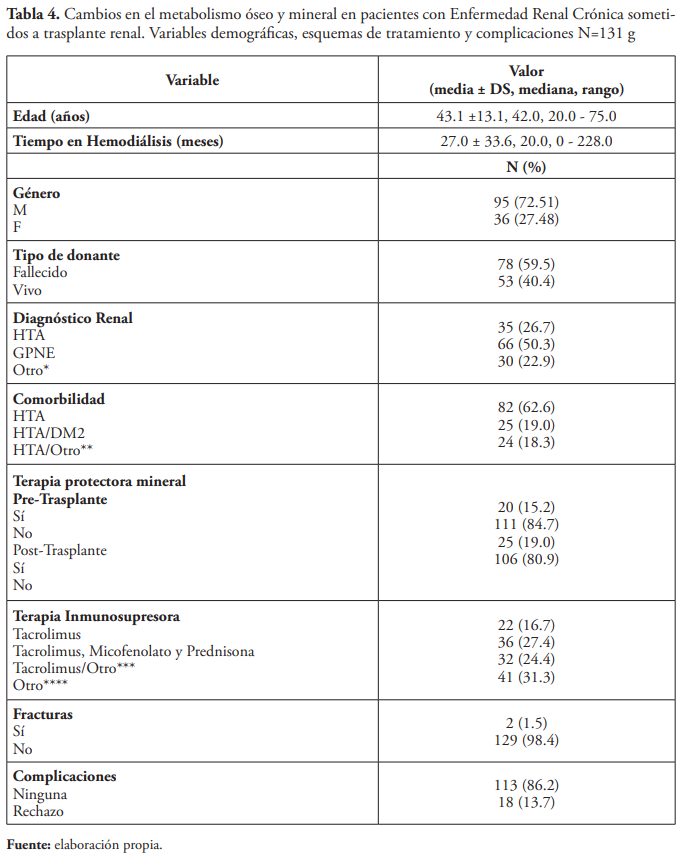
Se concluye que los pacientes femeninos no tuvieron un metabolismo óseo y mineral apropiado. En un estudio realizado en Italia se estableció que el género femenino pudiera ser un factor de riesgo importante para el desarrollo de enfermedad ósea.11 Esto podría estar vinculado a la edad de los pacientes femeninos, ya que si la mayoría se encuentran en la menopausia, una posible explicación sería que estos pacientes tengan una tendencia mayor a enfermedad ósea por la pérdida del estrógeno, no obstante, el estado de menopausia no fue investigado en este estudio.
La media de los pacientes según la edad y el tiempo en hemodiálisis es la siguiente: 43.1 ±13.1 años y 27.0 ± 33.6 meses, respectivamente, en contraste con un estudio observacional llevado a cabo en Bélgica en el cual establecieron 54.5 ± 13.5 años y 33.6 ± 23.1 meses como media de dichas variables, respectivamente12.
Se concluyó que los cambios generales en los niveles séricos de Ca, P, PTH, BUN y Creatinina desde el momento del TR a los 3 meses post TR fueron todos significativos. Se observó un aumento en los niveles de Ca (9.0 ± 1.2 vs. 9.7 ± 0.8 mg/dL; P=0.007) y una disminución en los niveles de P (4.9 ± 1.6 vs. 3.5 ± 0.8 mg/dL; P=0.002), en los niveles de PTH (779.6 ± 1004.0 vs. 167.9 ± 138.2 pg/mL; P=0.01), en los niveles de creatinina (7.3 ± 3.5 vs. 1.6 ± 0.9 mg/dL; P<0.00001) y en los niveles BUN (de 36.8 ± 14.1 a 21.3 ± 12.4 mg/dL; P<0.00001). En un estudio retrospectivo realizado en el Reino Unido se investigaron los cambios en los niveles de Ca y PTH en pacientes sometidos a trasplante renal, desde el momento del trasplante a tres meses post trasplante y se estableció que el nivel medio de PTH disminuyó significativamente en los primeros tres meses posteriores al trasplante, con resultados similares a nuestro estudio.13-15
Los pacientes sometidos al estudio demostraron cambios significativos en todos los valores tres meses posterior al trasplante renal. Estos cambios reflejan una mejoría de la función renal posterior al trasplante.
Los pacientes con menos de 36 meses en hemodiálisis tienden a tener un mejor control del metabolismo óseo y mineral que aquellos pacientes con más de 36 meses en hemodiálisis pre trasplante renal. En el estudio realizado en Brasil, se reconoce que el tiempo en hemodiálisis es un factor determinante e importante para el hiperparatiroidismo persistente, ya que aquellos pacientes sometidos a hemodiálisis por más tiempo están asociados a desarrollar hiperparatiroidismo secundario severo; esto podría explicar un metabolismo óseo y mineral más apropiado en los pacientes de este estudio sometidos a hemodiálisis por menos de 36 meses16.
Aquellos pacientes que recibieron el injerto renal de un donante vivo tienden a tener mejor control en su metabolismo óseo y mineral que aquellos que recibieron el injerto renal de un donante fallecido. En la actualidad no existen estudios que muestren evidencia de cómo varían los cambios en el metabolismo óseo y mineral en pacientes según el tipo de donante. Una posible explicación al hallazgo quizá sea que el injerto renal de donante vivo pudiera ser más funcional por presentar menos isquemia que el injerto renal de donante fallecido.
Los pacientes con HTA tienden a tener un mejor control de su metabolismo óseo y mineral después del trasplante renal en comparación con los pacientes con otras comorbilidades.
Los pacientes que no utilizaron terapia protectora mineral pre o post trasplante renal presentaron más cambios significativos en el metabolismo óseo y mineral que aquellos que si utilizaron terapia. Los pacientes que no utilizaron terapia protectora mineral pre o post trasplante renal mantuvieron un mejor metabolismo óseo y mineral. Aunque se observen cambios importantes, este hallazgo no fue estadísticamente significativo debido al tamaño de la muestra.
Los pacientes que utilizaron la combinación de tacrolimus, micofenolato y prednisona tienden a mejorar su metabolismo óseo y mineral después del trasplante renal en comparación con los que utilizaron otra terapia. Según el estudio en Italia ya mencionado, la ciclosporina y el tacrolimus estimulan la actividad de los osteoclastos y su diferenciación, por ende, se incrementan el recambio y la resorción ósea, provocando pérdida de masa ósea, especialmente para hueso trabecular y más aun en aquellos con hiperparatiroidismo. Un estudio realizado en EE. UU. estableció una diferencia entre la combinación de tacrolimus con prednisona y tacrolimus, micofenolato y prednisona. En ese estudio se identificó una tasa de rechazo elevada en los pacientes que utilizaron tacrolimus y prednisona en comparación con aquellos que utilizaron tacrolimus, micofenolato y prednisona (44 % vs. 27 %; P=0.014). Finalmente, demostraron que agregarle micofenolato a la combinación de tacrolimus y prednisona como terapia inmunosupresora reduce el rechazo agudo y mejora la supervivencia en general del injerto renal y del paciente.17
Por último, se establece la persistencia de niveles elevados de PTH en aquellos pacientes que tuvieron fracturas. El hiperparatiroidismo ha demostrado ser un factor de riesgo asociado a fracturas, ya que puede precipitar la pérdida de masa ósea debido a una resorción persistente de la misma, lo que puede explicar los hallazgos significativos en los pacientes que tuvieron fracturas post trasplante renal en este estudio. También se puede observar cómo se refleja una función de injerto renal no apropiada en aquellos pacientes que presentaron rechazo como complicación, ya que no hubo cambios significativos en dichos pacientes.
Conclusión
Al determinar las diferentes alteraciones metabólicas secundarias, su frecuencia y su impacto en el injerto de los pacientes con trasplante renal, habría un beneficio marcado para los receptores del trasplante, ya que, a partir de lo presentado, se podrían determinar medidas preventivas, tratamientos alternativos, promoción de la salud ósea y un punto de partida para investigaciones más amplias en el tema en cuestión.
Agradecimientos
Los autores agracen a la Dra. Angiolina Camilo por su asistencia metodológica y sus comentarios críticos en la realización de este estudio, y al Dr. Fernando Pellerano, por su soporte en el análisis de los datos. Especial agradecimiento al departamento de Investigación del Hospital General Plaza de la Salud, por contar con su aprobación para la realización de este proyecto.
Referencias
- Schreiber PW, Bischoff-Ferrari HA, Boggian K, Bonani M, van Delden C, Enriquez N, et al. Bone metabolism dynamics in the early post-transplant period following kidney and liver transplantation. PLoS One [Internet]. 2018;13(1):e0191167. Disponible en: http://dx.doi.org/10.1371/jour nal.pone.0191167
- Mezzano A S, Aros E C. Enfermedad renal crónica: clasificación, mecanismos de progresión y estrategias de renoprotección. Rev Med Chil [Internet]. 2005;133(3). Disponible en: http://dx.doi.org/10.4067/s0034-98872005000300011
- Pérez MJ, Crespo M, Cofan F, Alonso-Melgar Á, Díaz JM, Errasti P, et al. Enfermedad mineral ósea del trasplante renal: clínica y diagnóstico. Nefrología [Internet]. 2013;4(1):27–42. Disponible en https://www.revistanefrologia.com/es-relaccionados-enfermedad-mineral-osea-del-trasplante-renal-clinica-diagnostico-articulo-X2013757513001485
- López Oliva MO, Del Castillo Caba D, Sánchez Plumed J. Changes in bone and mineral metabolism in kidney transplant patients with chronic kidney disease. Nefrologia [Internet]. 2009;29 Suppl 1:31–7. Disponible en: https://pubmed.ncbi.nlm.nih.gov/19675659/
- Rodríguez-Benot A, Gómez-Marqués G, Alonso-Hernández Á, Bernal G, Bravo JA, Cañas L, et al. Etiopatogenia de las alteraciones del metabolismo óseo y mineral del trasplante renal. Nefrol (Engl Ed) [Internet]. 2013;4(1):19–26. Disponible en: https://www.revistanefrologia.com/en-etiopatogenia-alteraciones-del-metabolismo-oseo-articulo-X2013757513001493
- Al-Moasseb Z, Aitken E. Natural history of serum calcium and parathyroid hormone following renal transplantation. Transplant Proc [Internet]. 2016;48(10):3285–91. Disponible en: http://dx.doi.org/10.1016/j.transproceed.2016.09.050
- Complicaciones del Metabolismo Mineral y Óseo de Trasplante Renal [Internet]. Nefrologiaaldia.org. [citado el 18 de febrero de 2022]. Disponible en: https://www.nefrologiaaldia.org/es-articulo-complicaciones-del-metabolismo-mineral-oseo-296
- Flores JC, Alvo M, Borja H, Morales J, Vega J, Zúñiga C, et al. Enfermedad renal crónica: Clasificación, identificación, manejo y complicaciones. Rev Med Chil [Internet]. 2009;137(1). Disponible en: http://dx.doi.org/10.4067/s0034-98872009000100026
- Jojoa JA, Bravo C, Vallejo C. Clasificación práctica de la enfermedad renal crónica 2016: una propuesta. Rev repert med cir [Internet]. 2016;25(3):192–6. Disponible en: http://dx.doi.org/10.1016/j.reper.2016.10.003
- Jerman A, Lindič J, Škoberne A, Borštnar Š, Martinuč Bergoč M, Godnov U, et al. Prevalence and risk factors for nonvertebral bone fractures in kidney transplant recipients - a single-center retrospective analysis. Clin Nephrol [Internet]. 2017;88(13):101–8. Disponible en: http://dx.doi.org/10.5414/CNP88FX23
- Gregorini M, Martinelli V, Ticozzelli E, Canevari M, Fasoli G, Pattonieri EF, et al. Living kidney donation is recipient age sensitive and has a high rate of donor organ disqualifications. Transplant Proc [Internet]. 2018;51(1):120–3. Disponible en: http://dx.doi.org/10.1016/j.transproceed.2018.03.136
- Evenepoel P, Van Den Bergh B, Naesens M, De Jonge H, Bammens B, Claes K, et al. Calcium metabolism in the early posttransplantation period. Clin J Am Soc Nephrol [Internet]. 2009;4(3):665–72. Disponible en: http://dx.doi.org/10.2215/CJN.03920808
- Martín P, Errasti P. Trasplante renal. An Sist Sanit Navar [Internet]. 2006;29:79–91. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1137-66272006000400008&lng=es.
- Macdonald G. Harrison’s internal medicine, 17th edition. - By A. S. Fauci, D. L. Kasper, D. L. Longo, E. Braunwald, S. L. Hauser, J. L. Jameson And J. Loscalzo. Intern Med J [Internet]. 2008;38(12):932. Disponible en: http://dx.doi.org/10.1111/j.1445-5994.2008.01837.x
- Taweesedt PT, Disthabanchong S. Mineral and bone disorder after kidney transplantation. World J Transplant [Internet]. 2015;5(4): 231–42. Disponible en: http://dx.doi.org/10.5500/wjt.v5.i4.231
- Gomes LK, Custódio MR, Contieri FL de C, Riella MC, Nascimento MM do. Persistent disorders of mineral metabolism after one year of kidney transplantation. J Bras Nefrol [Internet]. 2016;38(3). Disponible en: http://dx.doi.org/10.5935/0101-2800.20160044
- Dalal P, Shah G, Chhabra D, Gallon L. Role of tacrolimus combination therapy with mycophenolate mofetil in the prevention of organ rejection in kidney transplant patients. Int J Nephrol Renovasc Dis [Internet]. 2010;3: 107–15. Disponible en: http://dx.doi.org/10.2147/ijnrd.s7044

