Ciencia y Salud, Vol. V, No. 2, mayo-agosto, 2021 • ISSN (impreso): 2613-8816 • ISSN (en línea): 2613-8824 • Sitio web: https://revistas.intec.edu.do/
APLICACIÓN DE LAS PROPIEDADES NUTRACÉUTICAS Y ESTABILIZANTES DEL MESOCARPIO Y EXOCARPIO DEL MARACUYÁ EN LA OBTENCIÓN DE UNA BEBIDA NATURAL DE CHINOLA-PIÑA
Application of the nutraceutical and stabilizing properties of the passion fruit mesocarp and exocarp in obtaining a natural passion fruit-pineapple drink
Cómo citar: Paniagua DA, Vicioso KM, Valdez NG. Aplicación de las propiedades nutracéuticas y estabilizantes del mesocarpio y exocarpio del maracuyá en la obtención de una bebida natural de chinola-piña. cysa [Internet]. 8 de junio de 2021 [citado 16 de junio de 2021];5(2):7-18. Disponible en: https://revistas.intec.edu.do/index.php/cisa/article/view/2207
Introducción
El maracuyá (Passiflora edulis var. flavicarpa), también conocida como chinola o la fruta de la pasión, es una fruta tropical que pertenece a la familia de Passifloraceae, oriunda de Brasil. Es una enredadora cuyos tallos se trepan en espaldera o enramada, si son conducidos hasta ellas, las hojas son de bordes aserrados alternas con tres lóbulos, de color verde oscuro en el lado superior, las flores están compuestas de sépalos y pétalos amarillentos, y las porciones de la corona delgadas y onduladas, con la mitad inferior morado y la superior blanco-cremosa.
Al contrario de lo que se cree, los beneficios de esta fruta tropical no están escondidos solamente en su pulpa; su cáscara, semillas e incluso hojas son muy beneficiosas para la salud en general1. La cáscara evita los picos de insulina, peligrosos para los diabéticos2. Contiene nutrientes como proteínas, grasas, carbohidratos, agua, fibra3, calcio, fósforo, hierro, tiamina, riboflavina, niacina, ácido ascórbico, retinol, sodio, potasio y varias sustancias con propiedades antioxidantes3,4,5,6. Es laxante, ayuda al buen funcionamiento del intestino7,8 y disminuye los niveles de colesterol9.
La piña, ananá o naná (Ananas comosus), es una fruta tropical. Aunque la piña es originaria de Brasil y Paraguay, hoy en día su consumo está muy extendido por todo el mundo gracias a su delicioso sabor y a las propiedades nutricionales que contiene. Tiene forma ovalada, una corona y también una piel muy rugosa de color verdosa que se va volviendo amarilla y marrón a medida que la piña va madurando, y desprende un agradable olor dulzón cuando ya está listo para comer. Por dentro tiene una carne amarilla muy dulce y jugosa. Posee retinol, vitaminas del grupo B y ácido ascórbico, haciendo de la piña una excelente fuente de antioxidantes que combaten los radicales libres y retrasan el envejecimiento. Hasta un 85 % de la piña es agua, esto quiere decir que te saciará, te mantendrá bien hidratado y aporta muy pocas calorías (alrededor de unas 55 por cada 100 gramos)10.
El propósito del presente estudio es la elaboración de un jugo natural de maracuyá-piña adicionándole las propiedades nutracéuticas y estabilizantes contenidas en el mesocarpio y exocarpio del maracuyá11,15.
En el proceso productivo, los cambios de temperatura, los ingredientes utilizados, la presencia de partículas y hasta el transporte y almacenamiento, pueden ser factores que favorezcan la inestabilidad de los sistemas de bebidas, ocasionando la desestabilización de estas, con ello, la formación de precipitados gelatinosos, sedimentación y separación de fases, pérdida de viscosidad e inclusive, turbidez indeseada.
Algunos ingredientes proporcionan una mejor estabilización, promoviendo una apariencia limpia y uniforme, evitando la separación de fases. Entre los estabilizantes que pueden ser utilizados para bebidas están las pectinas. Estas son productos químicos que se obtienen de materias primas vegetales, principalmente frutas, y se usan en varias industrias, en especial la de alimentos, para darle propiedades de gel a los productos; también son utilizadas como estabilizantes.11-15
Materiales y métodos
Se realizaron diferentes pruebas de desagregación, la primera y segunda prueba se desarrollaron con agua y mesocarpio del maracuyá, buscando determinar hasta qué cantidad de mesocarpio del maracuyá se puede integrar en agua en términos porcentuales; la segunda prueba fue para establecer los parámetros del proceso. Se procedió a calentar en un beaker 2,000 mL de agua entre 50-55 °C. Se pesaron diferentes porcentajes del mesocarpio del maracuyá y se desagregó en 500 mL de agua. Se ajustó el pH aproximadamente entre 4.5-4.8 con un álcali o un ácido diluido según fuese necesario. Luego se le adicionó el catalizador y se colocó en un plato rotatorio calorífico a la misma temperatura inicial.
Las siguientes cuatro pruebas de desagregación se realizaron utilizando jugo de piña y mesocarpio del maracuyá, con el objetivo de determinar cuál de las concentraciones del mesocarpio del maracuyá era la adecuada, aplicando el jugo de piña como base, se hicieron los ajustes de lugar, obteniendo un producto final con contenido de fibras de tamaño más o menos uniforme, lo más pequeño posible y mejorando las características organolépticas. Se procedió a llevar aproximadamente a 40 °C una porción de jugo de piña y a agregar el catalizador. Se desagregaron tres porcentajes diferentes del mesocarpio del maracuyá en el jugo de piña, adicionando el catalizador y verificando el resultado de los parámetros. Se procedió a colocar en un beaker, jugo de piña y se llevó a 35 °C y luego se agregó el catalizador. Se pesó entre 15-20 % del mesocarpio del maracuyá y se desagregó en diferentes porciones, tomando en cuenta el tiempo de desagregación de cada parte y midiendo los parámetros de control antes de cada desagregación, filtrando y realizando pruebas con diferentes saborizantes naturales.
Las pruebas de desagregación siguientes, fueron con el mesocarpio y placenta del maracuyá, en jugo de piña, con alimentación continua. Se procedió a calentar a 35 °C una cantidad determinada de jugo de piña y a adicionar el catalizador. Se desagregó entre un 5-10 % de la placenta de la chinola y se filtró. Se midió la cantidad obtenida, se desagregó entre un 20-25 % del mesocarpio de la chinola en porciones de igual tamaño, tomando en cuenta el tiempo de degradación de cada porción, midiendo los parámetros de controles luego de cada alimentación y al final filtrar. Se realizaron las diluciones necesarias para obtener el °Brix deseado y ajustando acidez al producto obtenido con diferentes acidulantes naturales.
Para mejorar las características organolépticas al producto obtenido en las pruebas anteriores de desagregación, se procedió a realizar una mezcla de jugo de piña y jugo de maracuyá, se calentó a 35 °C una cantidad determinada de jugo de piña y se adicionó el catalizador. Se agregó entre un 5-10 % de placenta de maracuyá, se filtró y midió la cantidad obtenida. Al producto obtenido, se le adicionó entre un 5-10 % de mesocarpio del maracuyá y se desagregó en porciones iguales, tomando en cuenta el tiempo de desagregación, filtrando y midiendo los parámetros de control. Realizando los ajustes necesarios para obtener los grados brix deseados.
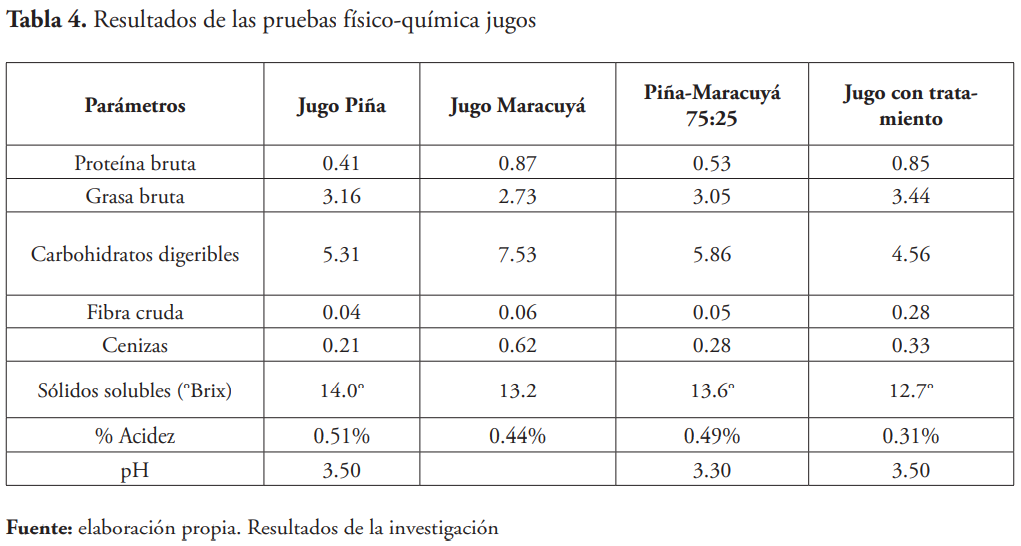
En la caracterización del producto se determinó proteína cruda [AOAC 2001.11], grasa cruda [AOAC 920.39], fibra cruda [AOAC 962.09], ceniza [AOAC 942.05], acidez [AOAC 942.15], sólidos solubles [AOAC 983.17] y el pH [AOAC 971,27].16
Para la determinación de la actividad enzimática se utiliza el método del papel de filtro21.
Para determinar la cinética de la celulasa, se preparó una muestra al 30 % del mesocarpio del maracuyá en una mezcla de jugo chinola piña. Se ajustó el pH a 4.8 con un álcali. Se llevó la muestra a una temperatura entre 42-50 °C en baño de agua, con el fin de trabajar con el catalizador en condiciones óptimas. Se agregó a la muestra el catalizador y se mantuvo en agitación constante, se muestreó por duplicado cada 10 minutos y se centrifugó. Del centrifugado se tomaron alícuotas de 0.5mL y se continuó el procedimiento como en actividad enzimática17.
Para determinar la estabilidad del producto, se sometió la muestra, recién preparada, a diferentes temperaturas y al mismo tiempo se realizó una mezcla de pulpa de piña y maracuyá simple, para usarla como comparativo. Se realizó la prueba por duplicado y se utilizaron botellas de aproximadamente 12 onzas, de cuello corto, transparentes e incoloras. Se observaron las muestras y a su vez se midió la sedimentación en centímetros. Se midió la sedimentación a la 5ta hora de la elaboración de las muestras y luego a las 24 y 48 horas, respectivamente.
Las temperaturas de las áreas a las que las muestras fueron sometidas son:
Área 1: ±5 °C Área 2: ±17 °C Área 3: ±25 °C Área 4: ±30 °C
Resultados
Determinación actividad enzimática de la Celulasa
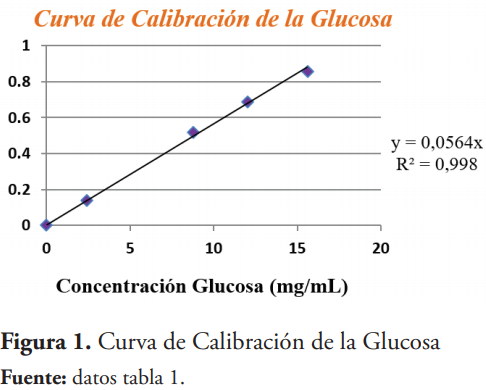
Se midieron las absorbancias del estándar de glucosa y los resultados fueron los siguientes:
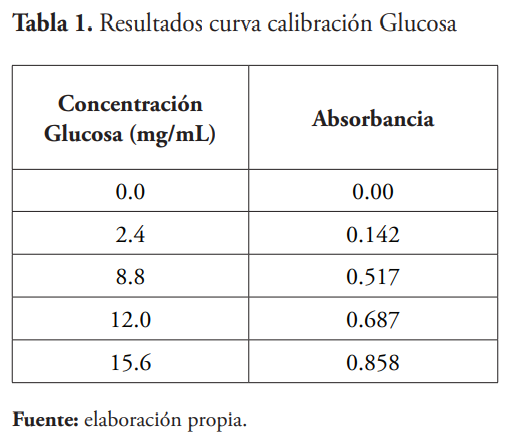
Cálculo de la actividad enzimática
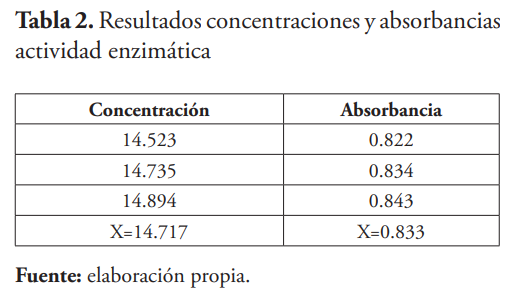
Au =
M glucosa: 180 mg/mmol
Tiempo: 60 minutos
Au =
Au = 0.03mmol * min-1 * mL-1
Cinética en el jugo con tratamiento
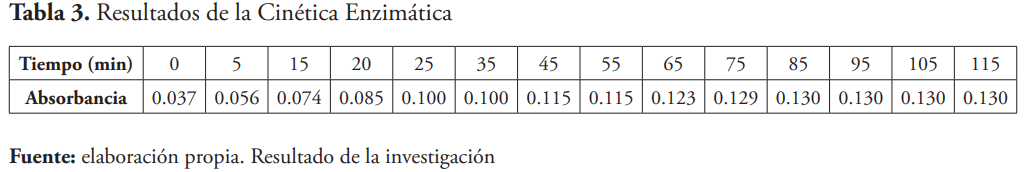
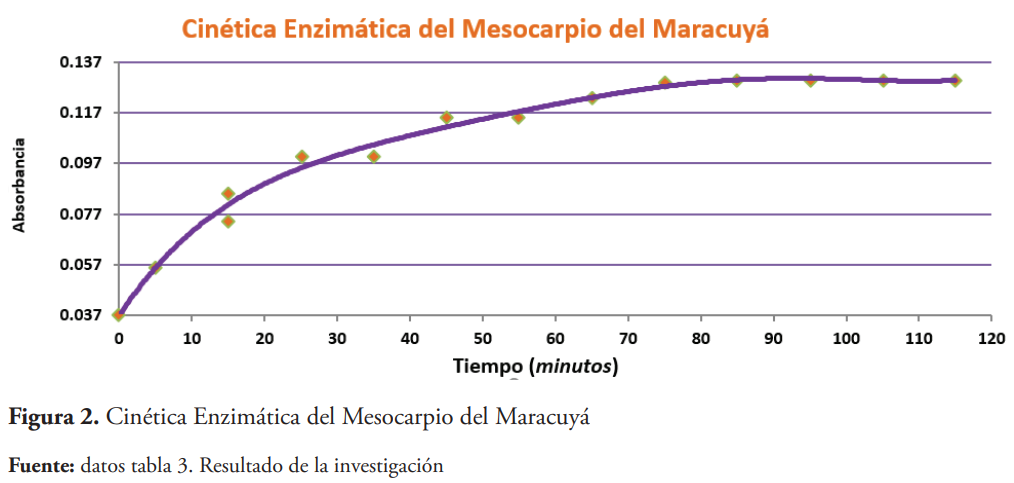
Para presentar los resultados obtenidos en la cinética, se construyó un gráfico Absorbancia en función del tiempo.
Datos de los parámetros fisicoquímicos y contenido de macronutrientes de jugo piña, jugo maracuyá, jugo piña-maracuyá y jugo con tratamiento
Determinación de la estabilidad de la muestra con tratamiento, en términos comparativos con una muestra de mezcla de jugo simple (sin tratamiento)




Discusión
Para obtener este producto y viabilizar la transferencia de los resultados a la industria se establecieron los parámetros de la actividad y cinética enzimática, ambos son muy importantes debido a que permiten determinar la relación tiempo de reacción-cantidad del catalizador a utilizar vs. costo del proceso. Otros datos importantes que involucran este proceso son la cantidad de biocatalizador a utilizar y parámetros óptimos de la reacción. Bajo ciertas condiciones como pH, concentración de sustrato y temperatura, el proceso de desagregación del mesocarpio y exocarpio de la chinola es de 75 minutos, tal como se observa en el plato del gráfico de la figura 2.
Para trabajar con el catalizador en su óptimo nivel, se deben tomar en cuenta la temperatura y el pH a la que este estará sometido. Estos parámetros en la muestra juegan un papel muy importante, debido a que, si se trabaja fuera de los rangos óptimos del catalizador, este se puede inactivar. Con esta prueba se logró determinar que el catalizador actúa sobre la celulosa contenida en el mesocarpio del maracuyá, desagregando los azúcares que contiene. En el proceso también se obtuvo un producto en donde los nutrientes y moléculas bioactivas atrapadas en el mesocarpio y exocarpio de la fruta ahora están disponibles para su inmediata absorción en el organismo humano.
Los resultados de los análisis, a lo que fueron sometido los productos obtenidos, evidencian que el tratamiento catalítico natural con biomoléculas a la mezcla de jugo de maracuyá y piña, en combinación con los subproductos de estas frutas, que por lo general en la industria se consideran desechos, son significativamente positivos. Al comparar el aumento porcentual de los siguientes nutrientes en las muestras con tratamiento y sin tratamiento, los resultados numéricos son los siguientes: proteína 60 %, grasa 13 %, fibra cruda 522 %, cenizas 18 %; sin embargo, los carbohidratos digeribles disminuyeron en un 22,2 %.
El aumento en más de un 500 % en fibras se debe a que aquellas macromoléculas que conforman la pared celular y que son insolubles y además no digeribles, son parcialmente digeridas por el catalizador biológico, convirtiéndolas en fibras de mucho menor tamaño, que siguen siendo no digeribles por el cuerpo humano, pero tienen una acción que mejora el funcionamiento del sistema digestivo, favoreciendo el aumento del peristaltismo, evitando acumulación de alimentos difíciles de digerir en los intersticios en la pared de los intestinos, previniendo enfermedades infecciosas y algunos tipos de cáncer.
Dentro de estas fibras, están cuantificadas también las pectinas, que se ha encontrado que ejercen una acción favorable en el control de las lipoproteínas de baja densidad (LDL), lo que permite controlar el entaponamiento de las arterias y una baja irrigación a órganos vitales, disminuyendo el riesgo de ciertas enfermedades como la hipertensión arterial y aumentando la calidad de vida del ser humano. Además, favorece su uso en pacientes diabéticos en vista de que son carbohidratos que dan saciedad y no se absorben. A nivel industrial las pectinas tienen varias aplicaciones, en el caso que nos compete le aporta estabilidad en fibra y pulpa a la bebida, además, de buena textura y brillo al producto.
Otro resultado que llama la atención favorablemente es la disminución de los carbohidratos digeribles, los cuales disminuyeron en un 22 % después del tratamiento, esto hace al producto más amigable desde el punto de vista nutricional y de la salud, tomando en cuenta que los carbohidratos de este tipo son relativamente económicos, de fácil acceso, y la oferta mercadológica es más agresiva. Sin embargo, este resultado puede generar la oferta de un jugo nutricionalmente más equilibrado, de bajo nivel de carbohidratos digeribles.
El 13 % de aumento de la grasa bruta que se puede observar, por lo general se pierde en lo que la industria estima como desecho después del procesamiento de las frutas. Esto así, porque esas grasas se encuentran dentro de las células vegetales y atrapadas en los intersticios de la macromolécula que forman la pared celular. Al aplicarle las biomoléculas con la finalidad de quitarle segmentos de fibras a la pared celular, la misma se debilita estallando, producto de la presión osmótica y liberando todo su contenido interno. Se estima que este incremento de las grasas en el producto, está relacionado con el aumento de ácidos grasos insaturados y otras sustancias liposolubles como los betacarotenos (precursor de la vitamina A), el cual tiene varias propiedades nutracéuticas como es su poder antioxidante, además puede evitar la ceguera nocturna, produce renovación de los epitelios y le da un buen respaldo al sistema inmunológico.
En la tabla 6 están plasmados los resultados de la sedimentación de las muestras tratadas con biomoléculas. En el mismo se observa que en las cuatro áreas en que las muestras fueron expuestas durante 5 horas, tal como se aprecia en las figuras 3, 4, 5 y 6; las muestras tratadas presentan mayor estabilidad, es decir, menor sedimentación que las muestras que no fueron tratadas, demostrando que en un área por debajo de 18 °C, las muestras se mantienen estables y aún en temperaturas no aptas para la conservación de este tipo de productos (25 y 30 °C, respectivamente), las muestras con tratamiento presentan mayor estabilidad que las muestras sin tratamiento.
En la tabla 7 se presentan los resultados de la sedimentación, transcurrido un tiempo de 24 horas de la preparación de las muestras y exposición a las diferentes temperaturas. Como se puede observar, en las figuras 7 y 8, la muestra con tratamiento continúa manteniendo su estabilidad, al contrario de la muestra que no fue tratada con catalizador, que su sedimentación va en aumento. En los resultados de la sedimentación de las áreas 3 (25 °C) y 4 (30 °C) respectivamente, tal como se aprecia en las figuras 9 y 10, se puede observar que tanto las muestras tratadas como las muestras sin tratamiento, presentan separación en uno de su respectivo duplicado, evidenciando esto que la exposición durante 24 horas a estas temperaturas, provocan pérdida de la estabilidad de la mezcla.
En la tabla 8 se muestran los resultados de la sedimentación, transcurrido un tiempo de 48 horas de la preparación de las muestras y exposición a las diferentes temperaturas. Como se puede observar, en la figura 11, la muestra con tratamiento continúa manteniendo su estabilidad, al contrario de la muestra que no fue tratada con catalizador, que su sedimentación siguió aumentando. En los resultados de la sedimentación de las áreas 2 (17 °C), 3 (25 °C) y 4 (30 °C), tal como se aprecia en las figuras 12, 13 y 14, se puede observar que tanto las muestras tratadas como las muestras sin tratamiento, presentan separación en uno de su respectivo duplicado, unos en la parte superior y otros en el fondo del envase, evidenciando esto que la exposición durante 48 horas a estas temperaturas, provocan pérdida de la estabilidad de la mezcla.
Conclusión
Bajo las condiciones en que se realizaron los experimentos, la reacción de la cinética enzimática tiene una duración de 1 hora 55 minutos.
- El proceso de desagregación de la pulpa tuvo como resultado un jugo estable en su turbidez con un color y olor bastante acentuado, relacionado con las frutas que se han utilizado para preparar el mismo.
- El producto tratado con el biocatalizador tiene mayores propiedades nutracéuticas que el jugo sin tratamiento.
- El jugo tratado con el biocatalizador es más estable que el jugo sin tratamiento.
Referencias
- Vega Acosta AC. Plan de negocio de una bebida refrescante saludable, a base de maracuyá y stevia, en la ciudad de Guayaquil. Repositorio Universidad de Guayaquil. 2016.
- de Queiroz MdSR, Janebro DI, da Cunha MAL, Medeiros JS, Sabaa-Srur AU, Diniz MFFM, et al. Effect of the yellow passion fruit peel flour (Passiflora edulis f. flavicarpa deg.) in insulin sensitivity in type 2 diabetes mellitus patients. Nutrition Journal. 2012 Octubre; 11(89).
- López Vargas JH, Fernández Lépez J, Pérez Álvarez JA, Viuda Martos M. Chemical, physico-chemical, technological, antibacterial and antioxidant properties of dietary fiber powder obtained from yellow passion fruit (Passiflora edulis var. flavicarpa) co-products. Food Research International. 2013;51(2).
- Díaz LS, Padilla C, Carolina S. Identificación del Principal Pigmento Presente en la Cáscara del Maracuyá Púrpura (Passiflora edulis). Scielo Chile. 2006;17(06).
- Sánchez WF, Murillo E, Méndez JJ. Potencial antioxidante de residuos agroindustriales de tres frutas de alto consumo en el Tolima. Scientia et technica. 2010;3(46).
- Zeraik ML, Yariwake JH, Wauters JN, Tits M, Angenot L. Analysis of passion fruit rinds (Passiflora edulis): isoorientin quantification by HPTLC and evaluation of antioxidant (radical scavenging) capacity. Química Nova. 2012;35(3).
- Ancona DB, Flores VP, Guerrero LAC. Fibra dietética y sus beneficios en la alimentación. Revista de la Universidad Autónoma de Yucatán. 2003 Cuarto trimestre;(227).
- Matos Chamorro A, Chambilla Mamani E. Importancia de la Fibra Dietética, sus Propiedades Funcionales en la Alimentación Humana y en la Industria Alimentaria. Revista de Investigación en Ciencia y Tecnología de Alimentos. 2010;1(1).
- Ramos Alessandra Teixeira CMAL,SSAUO,PVCF,CAA,DMdFMea. Use of Passiflora edulis f. flavicarpa on cholesterol reduction. Revista Brasileira de Farmacognosia. Revista Brasileira de Farmacognosia. 2007 diciembre;17(4).
- Wheateer C. Zumos para una vida sana Barcelona: MC Produció Editorial 2004.
- Durán V, Honores M, P. C. Obtención de pectina en polvo a partir de la cáscara de maracuyá (passiflora edulis). DSpace en Spol 2012.
- Páez G, Marín M, Mármol Z, Ferrer J, D`Addosio R. Obtención y caracterización de pectina a partir de la cáscara de parchita (Passiflora edulis f. flavicarpa Degener). Revista de la Facultad de Agronomía de la Universidad del Zulia. 2005;22(3).
- Rivadeneira M, Cáceres P. Extracción de pectina líquida a partir de cáscaras de maracuyá (passiflora edulis) y su aplicación en el desarrollo de un producto de humedad intermedia. DSpace en ESPOL; 2010 abril.
- Vargas J, López H. Caracterización de coproductos de la industria del maracuyá (passiflora var. Flavicarpa) y su aplicación a productos cárnicos. Dialnet 2013.
- do Espírito Santo AP, Perego P, Converti A, Oliveira MN. Influence of milk type and addition of passion fruit peel powder on fermentation kinetics, texture profile and bacterial viability in probiotic yoghurts. LWT-Food Science and Technology. 2012 Julio;47(2).
- A.O.A.C. Official Methods of Analysis of AOAC International. AOAC International. Gaithersburg, M.D. 16th ed. Gaithersburg, M.D.: AOAC International 1996.
- Worthington Biochemical Corporation. Celullase. In von, editor. Enzyme and related biochemicals Hand Book. New Jersey, U.S.A.: Worthington Biochemical Corp. 1993. p. 81-85.
