Ciencia y Salud, Vol. iii, No. 3, septiembre-diciembre, 2019 • ISSN (impreso): 2613-8816 • ISSN (en línea): 2613-8824 • Sitio web: https://revistas.intec.edu.do/
HALLAZGOS RECIENTES DE HELICOBACTER PYLORI RESISTENTE A ANTIBIÓTICOS EN LA REPÚBLICA DOMINICANA
Helicobacter pylori, recent findings on antibiotic resistance in the Dominican Republic
Cómo citar: Camarena J, Khoury L. Hallazgos recientes de helicobacter pylori resistente a antibióticos en la República Dominicana. cysa [Internet]. 25 de noviembre de 2019 [citado 25 de noviembre de 2019];3(3):25-3. Disponible en: https://revistas.intec.edu.do/index.php/cisa/article/view/1543
Resumen
Introducción: Helicobacter pylori ha sido designado como responsable de múltiples trastornos del tracto gastrointestinal, por lo que el diagnóstico y erradicación de la mucosa gástrica constituye una prioridad en el cuidado del paciente ulceroso. La presencia de resistencia a los antibióticos utilizados en su erradicación representa un problema importante.
Método: propusimos hacer una investigación, de carácter prospectivo y experimental, para determinar la sensibilidad in vitro de la Helicobacter pylori (H. pylori) a una selección de antibióticos utilizados en los esquemas de erradicación de bacterias.
Resultados: ciprofloxacino, levofloxacino, fosfomicina, fueron los antibióticos más altamente sensibles in vitro, estadísticamente significativos para el H pylori. La amoxicilina y la claritromicina fueron los menos sensibles.
Conclusión: estos resultados muestran cambios significativos en el espectro de sensibilidad in vitro en relación con publicaciones anteriores en nuestro país. Los cambios en la sensibilidad a los antibióticos deben guiar el diseño de nuevas estrategias terapéuticas más eficaces y rentables.
Palabras clave:
Abstract
Introduction: Helicobacter pylori is responsible for multiple gastrointestinal disorders, its diagnosis and eradication of the gastric mucosa are a priority in the care of the ulcerative patient. Antibiotic resistance used in its eradication is now a major problem.
Methods: We set out to conduct prospective research to determine the in vitro sensitivity of Helicobacter pylori (H. pylori) to a selection of antibiotics used in bacteria eradication schemes.
Results: Ciprofloxacin, levofloxacin, phosphomycin were the antibiotics with the highest statistically significant in vitro sensitivity to H pylori. Clarithromycin and amoxicillin-ac. clavulanic, resulted in minor statistically significant sensitivity.
Conclusion: These results show changes in the spectrum of in-vitro sensitivity in relation to previous publications in our country. Changes in antibiotic sensitivity should guide the design of new, more effective and cost-benefit therapeutic strategies.
Keywords:
Introducción
El Helicobacter pylori es un bacilo Gram negativo, de forma de espiral, microaerofílico que se localiza en la mucosa gástrica. Desde su descubrimiento en 1982 por Warren y Marshall, ha sido señalado como el factor etiopatogénico más importante en múltiples trastornos digestivos, desde la patología inflamatoria hasta a la neoplásica1.
La infección por el H. pylori afecta con una prevalencia variable a gran parte de la población mundial, asociada a la pobreza, al hacinamiento y al poco acceso a los servicios de salud2. En nuestro país, la prevalencia del H. pylori ha sido estimada entre 60-80 % según el método y las poblaciones estudiadas3,4,5.
Su diagnóstico y tratamiento aumenta la tasa de curación y disminuye las complicaciones, incluyendo el sangrado y la recurrencia de la enfermedad ulcerosa2, por lo que la eliminación de la infección por H. pylori está considerada como el enfoque más económico para el manejo a largo plazo de la enfermedad ulcerosa péptica, y se recomienda la erradicación del microorganismo como actitud clave en el manejo de la enfermedad2,6.
El tratamiento de la infección tiene en la actualidad esquemas considerados de primera línea; el más utilizado a nivel general es la triple terapia que incluye un inhibidor de la bomba de protones (IBP), la amoxicilina, el metronidazol o claritromicina, en esquemas de 7 a 14 días. Otros esquemas utilizados son la terapia secuencial, la concomitante y la cuádruple terapia. También esquemas de segunda y de tercera línea con otros antibióticos como levofloxacina, furazolidona y el ácido clavulánico. Sin embargo, en muchas zonas del mundo, factores como la resistencia bacteriana, el costo de los medicamentos y la baja adherencia al tratamiento son consideradas como las principales causas del fracaso de las terapias antimicrobianas, mostrando tasas de curación inferiores al 80 %, consideradas como inaceptables.7,8,9,10.
La efectividad de los tratamientos empíricos para erradicar el H. pylori basados en el uso de dos antibióticos y un inhibidor de la bomba de protones (IBP) ha disminuido en las últimas décadas,2,8 constituyéndose un problema emergente; lo que implica que la selección de antibióticos adecuados para asegurar la erradicación de la bacteria es importante y requiere conocer la susceptibilidad a los mismos.
Recientemente han sido publicados documentos de consenso regionales sobre el manejo de la infección por H. pylori, que destacan que el aumento de las resistencias a los antibióticos utilizados es uno de los factores que explican la disminución en las tasas de erradicación. Un factor determinante de esta resistencia es el uso previo de antibióticos del grupo de los macrólidos y los nitroimidazoles11 los cuales, junto a la amoxicilina, han sido utilizados por mucho tiempo en las terapias clásicas contra el H. pylori. Esto explica la elevada tasa de resistencias a esta bacteria en países que utilizaron con profusión estos fármacos en la población adulta y en la pediátrica, induciendo la resistencia cruzada, lo que impacta en la eficacia de la triple terapia12 y disminuye su éxito hasta aproximadamente un 50 %11.
Estos consensos también señalan la importancia de disponer de estudios de sensibilidad de la bacteria en el ámbito local o regional para poder seleccionar el esquema antibiótico más adecuado,2,13 ya que existe una alta variabilidad geográfica en las tasas de resistencia a los antibióticos y diferencias entre individuos en función de su exposición previa y su acceso a los mismos7,10.
Por lo tanto, el conocimiento de los patrones locales de sensibilidad puede ser una herramienta valiosa para la selección de antibióticos en esquemas más apropiados para nuestra población, como lo propone la Declaración 19 de la Conferencia de Maastricht, donde expresa que la combinación de antibióticos debe elegirse de acuerdo con los patrones locales de resistencia a antibióticos del H. pylori2. Estos tratamientos más efectivos, apoyados en investigaciones realizadas en nuestra población de pacientes, no solo permitirán una mayor eficacia, la economía de recursos y la reducción de la recidiva de la enfermedad, sino que se traducirán en una mejor atención de salud para nuestros enfermos.
Sin embargo, la revisión de la bibliografía publicada recientemente muestra pocos estudios locales que permitan determinar el estado actual del comportamiento de la resistencia a los antibióticos. Algunas investigaciones fueron basadas en estudios de mutaciones genéticas de la bacteria que confieren resistencia a algunos antibióticos, otras en cultivo in vitro3,14. Por esta razón se propuso realizar una investigación que determinara la resistencia in vitro del H. pylori a los antibióticos utilizados actualmente en la población de pacientes dominicanos portadores de una enfermedad ulcero-péptica asociada con esta bacteria.
Método
Población de estudio
Se diseñó un estudio prospectivo, de cohorte analítico, realizado en la unidad de endoscopía de un centro de salud de la ciudad de Santo Domingo y un laboratorio clínico especializado en el estudio del H. pylori, durante el periodo comprendido entre octubre 2016 y mayo 2017. Se estudiaron todos los pacientes de nacionalidad dominicana, mayores de 18 años, remitidos para la realización de una endoscopia digestiva alta por síntomas de dispepsia, un síndrome ulceroso o síntomas de reflujo gastroesofágico, durante el período de estudio. A estos pacientes se les realizó una video endoscopía digestiva alta y se tomaron muestras de tejido de la mucosa gástrica.
Criterios de inclusión
- Edad comprendida entre 18 y 65 años, ambos sexos.
- Ausencia de tratamiento con antibióticos e inhibidores de la bomba de protones contra el H pylori, al menos 1 mes antes del estudio.
- Hallazgos endoscópicos de lesiones inflamatorias/ulcerosas gastro-duodenales.
- Prueba de la ureasa rápida positiva para el H. pylori.
- Resultados de cultivo positivo y antibiograma de las muestras obtenidas.
Criterios de exclusión
- No firmar el consentimiento informado.
- Pacientes embarazadas.
- Presencia de lesión tumoral o hemorrágica durante la endoscopía.
- No cumplimiento del protocolo para el transporte de la muestra de la mucosa gástrica al laboratorio.
La endoscopía digestiva gastro duodenal fue realizada por el mismo gastroenterólogo-endoscopista, utilizando un video endoscopio (i-3000, Pentax Medical). Previo a cada procedimiento, los endoscopios fueron desinfectados en frío en una solución de glutaraldehído al 3 % durante 15 minutos, según el protocolo del fabricante. Las pinzas de biopsia (Cook Medical), fueron destinadas exclusivamente para el uso en la investigación y antes de cada utilización fueron esterilizadas en una solución de glutaraldehído al 3 % por 24 horas.
Durante el procedimiento endoscópico la mucosa del esófago, estómago y duodeno fue examinada minuciosamente. A los pacientes con hallazgos endoscópicos de enfermedad péptica gastro-duodenal les fueron retirados 6 fragmentos de mucosa gástrica del antro y de la región pilórica. Una prueba de ureasa fue realizada a dos de estas muestras, los pacientes positivos fueron seleccionados y se enviaron dos muestras en un tubo estéril de crioconservación en hielo, sin solución salina, al laboratorio de bacteriología para su inmediato cultivo. Las muestras fueron identificadas con las iniciales del paciente y un número de referencia.
Las biopsias restantes fueron enviadas al departamento de anatomía patológica para su estudio histopatológico correspondiente.
Bacteria y condiciones de cultivo
Las muestras de la mucosa gástrica fueron sembradas en un medio de aislamiento selectivo, en placas de Agar-pylori (BioMerieux, Francia) incubándose en jarras de anaerobiosis para bacterias microaerófilas, empleando el sistema de microaerobiosis (GENbox microaer, BioMerieux, Francia), a 35 grados centígrados de 3 a 7 días consecutivos, según el método descrito por el fabricante.
Los cultivos positivos fueron expuestos a pruebas de sensibilidad mediante discos. (Sensi-disc, Becton, Dickinson, France), para los siguientes antibióticos: amoxicilina Ac.clavulánico, ciprofloxacino, levofloxacino, fosfomicina y claritromicina. La resistencia/sensibilidad fue determinada por la medición del diámetro del halo de inhibición del antibiótico, en milímetros.
Se definieron los criterios de resistencia y sensibilidad a partir de la clasificación del National Committee for Clinical Laboratory Estándar15,16. Dado el hecho de no existir puntos de corte estandarizados para la medición de diámetro del halo de inhibición del disco para cada antibiótico en la placa de cultivo16, fue necesario tomar como referencias los establecidos en la revisión de la literatura y los propuestos por el mismo fabricante para la interpretación de los resultados del cultivo-antibiograma sobre la placa del cultivo17,18. Por lo que se estableció para cada antibiótico estudiado los siguientes parámetros de corte:
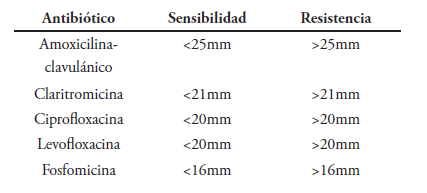
Se excluyeron las muestras donde no se cumplió el protocolo de traslado, recibidas en malas condiciones o que no tuvieron crecimiento bacteriano en la placa del cultivo, durante los tres primeros días.
Las variables como la edad, el sexo y los resultados del cultivo de las muestras (el diámetro del halo de inhibición en milímetros), fueron tabulados y transferidos en una hoja electrónica Excel para ser sometidos al análisis estadístico descriptivo, comparaciones múltiples no paramétricas con análisis de varianza de una clasificación por rangos de Kruskal-Wallis19. Se utilizó el programa Epi-info 7.2.1. Se estableció el valor de p asociado al resultado estadísticamente significativo como igual o menor a 0,001.
Aspectos éticos
Previo al estudio, todos los pacientes firmaron el consentimiento informado, indicando los procedimientos que iban a ser realizados con las muestras, los posibles riesgos y beneficios de su participación en la investigación. Se mantuvo el principio de confidencialidad del nombre del paciente y las informaciones recolectadas fueron manejadas por el investigador principal. El protocolo de la investigación fue aprobado por el Comité de Bioética del INTEC.
Resultados
De los 110 pacientes con lesiones ulcero pépticas a los cuales se les realizó la video endoscopía, 98 presentaron la prueba de ureasa positiva, por lo que se enviaron al laboratorio para su cultivo, de estas fueron incluidas 71 muestras (72 %) que cumplieron con el protocolo de transporte y presentaron crecimiento bacteriano óptimo para su evaluación con cultivo-antibiograma en el laboratorio.
La población estudiada fue constituida por adultos jóvenes, predominantemente femenina, (Tabla 1). Las indicaciones principales para la realización de la video endoscopía fueron la dispepsia, epigastralgias y la pirosis. Los hallazgos endoscópicos más frecuentes: la gastropatía erosiva y enfermedad ulcero péptica gastro duodenal. No hubo ningún diagnóstico endoscópico ni histológico de cáncer gástrico, linfoma MALT ni sangrado digestivo durante el procedimiento endoscópico.
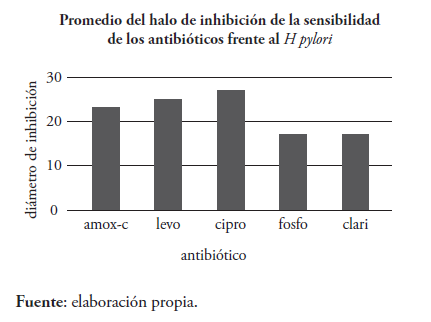
El resultado de la medición del halo de inhibición de los diferentes antibióticos estudiados puso en evidencia que los antibióticos con un diámetro del halo de inhibición en la placa de cultivo igual o mayor a 24 mm fueron ciprofloxacina, levofloxacina y fosfomicina. Esta alta sensibildad resultó con una diferencia estadística significativa (P≤0.001) en relación con los otros antibióticos analizados. No se encontró diferencias estadísticas importantes entre los antibióticos con alta sensibilidad (P≤0.10). La sensibilidad de los diferentes grupos de antibióticos tuvo una distribución sin diferencias estadísticas en cuanto a sexo y edad.
Gráfico 1. Antibióticos con mayor sensibilidad in vitro frente al H. pylori en la población estudiada. Eje vertical diámetro de inhibición en la placa de cultivo en milímetros
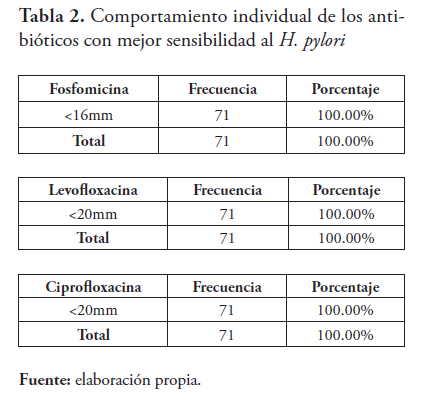
El análisis estadístico individual de resultados en el cultivo y antibiograma in vitro de cada antibiótico puso en evidencia diferencias significativas entre el grupo de los más efectivos (ciprofloxacina, levofloxacina y la fosfomicina) y los de menor sensibilidad (amoxicilina-Ac clavulánico y claritromicina). Todos los promedios del diámetro de inhibición de las cepas de H. pylori en el cultivo fueron superiores al corte propuesto por la literatura y el fabricante. Ninguna cepa resultó resistente, (Tabla 2) .
Los antibióticos donde se observó la menor sensibilidad fueron la amoxicilina-clavulánico y la claritromicina. La amoxicilina-clavulánico fue sensible en 73.3 % de las cepas (52/71) y la claritromicina en 85.9 %, respectivamente (61/71).
La amoxicilina-Ac.clavulánico tuvo 63 % de cepas sensibles (<25mm), con un diámetro promedio del halo de inhibición de 24 mm. Fueron observadas 27 % de cepas resistentes En nuestro estudio observamos una sensibilidad del H. pylori a la claritromicina de un 85 %, con 14 % de cepas resistentes. El promedio del halo de inhibición fue de 17 mm (sensibilidad <21mm).
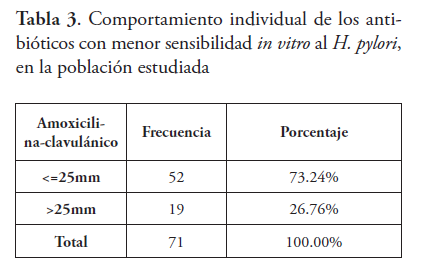
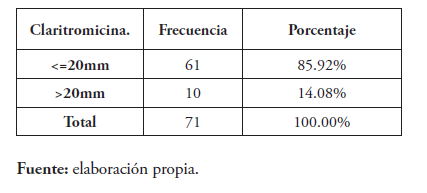
El análisis estadístico de resultados en el cultivo y antibiograma individual de cada antibiótico puso en evidencias diferencias significativas entre estos antibióticos y los de mayor sensibilidad (P≤0.001).

Discusión
Nuestro estudio fue realizado con pacientes dominicanos, adultos jóvenes, predominantemente femeninos, con síntomas asociados sugestivos de enfermedad péptica y hallazgos endoscópicos de enfermedad úlcero péptica. Los pacientes con la prueba de ureasa rápida positiva y resultados valorables en el cultivo, presentaron una prevalencia de 89 % del H. pylori. Esta prevalencia coincide con publicaciones de estudios en poblaciones con iguales características a la nuestra.
El cultivo y antibiograma de las biopsias puso en evidencia diferencias en el comportamiento de la sensibilidad y resistencia in vitro de las cepas del H. pylori frente a los antibióticos investigados.
Todas las cepas fueron sensibles a la levofloxacina, ciprofloxacina y fosfomicina. Sin observarse ninguna resistencia a pesar de ser antibióticos de uso frecuente en patologías infecciosas comunes.
La fosfomicina tuvo un comportamiento similar a la levofloxacina y la ciprofloxacina, siendo sensible en todas las cepas. Aunque la fosfomicina es el menos utilizado en las terapias para erradicar el H. pylori, es un antibiótico, de amplio espectro, con buena actividad, bien tolerado y baja incidencia de reacciones adversas, por lo que podría ser utilizada en la terapia contra el H. pylori en regímenes de segunda línea o de rescate.
Este estudio ha puesto en evidencia una sensibilidad reducida en el caso de la amoxicilina respecto a otros estudios publicados en nuestro país, observando solo 73 % de cepas sensibles. Esto nos permite pensar que en un futuro podría dejar de ser un antibiótico confiable para su uso en la terapia de erradicación del H. pylori.
Actualmente, la terapia de erradicación del H. pylori utilizada en nuestro país, asocia la amoxicilina y la levofloxacina junto con un inhibidor de la bomba de protones. Esta combinación todavía ofrece buena sensibilidad y baja resistencia de la bacteria en la práctica clínica, por lo que debería brindar una alta tasa de erradicación.
La resistencia del H. pylori a la claritromicina es considerada en todas las publicaciones como la causa más importante del fracaso de la terapia7,8. En nuestro estudio, la claritromicina mostró una resistencia de un 14 % en los cultivos, estadísticamente significativa en comparación con los demás antibióticos evaluados y con publicaciones anteriores3, donde era de apenas un 7 %. Las guías recomiendan que este antibiótico sea utilizado solo en las zonas donde el H. pylori presente una resistencia a la claritromicina inferior al 15 %, o en pacientes sin historia de exposición previa a los macrólidos19, por lo que todavía podría ser recomendado su uso en ciertas condiciones en los esquemas de erradicación del H. pylori en nuestro país.
Conclusión
La presente investigación prospectiva, realizada en 71 muestras de biopsias gástricas de pacientes dominicanos diagnosticados de enfermedad ulcero-péptica asociada al H. pylori, evaluó la sensibilidad in-vitro de antibióticos utilizados en la terapia de erradicación. Los resultados mostraron cambios que deben tomarse en cuenta en el momento de combinar antibióticos. En nuestra serie existe un aumento de la resistencia a los antibióticos amoxicilica-Ac. clavulánico y claritromicina según los resultados observados del presente estudio y en comparación con publicaciones anteriores3.
Un esquema de erradicación contra el H. pylori en la República Dominicana, debería incluir los antibióticos con sensibilidad demostrada en estudios in vitro, realizados localmente.
Los resultados del presente estudio podrían apoyar todavía el uso de la amoxicilina-clavulánico como antibiótico base en un régimen de triple terapia de primera línea, siempre que incluya la levofloxacina o ciprofloxacina. Un antibiótico que emerge como alternativa por su gran sensibilidad es la fosfomicina, por lo que podría ser incluido en los protocolos de tratamiento de primera y segunda línea o de rescate.
Deben ser realizados nuevos estudios aleatorios, para confirmar estos datos, así como de eficacia post tratamiento y de vigilancia permanente de la recidiva post tratamiento, para detectar cambios en el espectro de la sensibilidad, sobre todo los utilizados actualmente en la triple terapia que se comercializa en nuestro país, como la levofloxacina.
Declaración de intereses
Los investigadores declaran no tener conflictos de intereses.
Agradecimientos:
Lic. Fidelito Díaz
Lic. Rossy Calderón
Dr. Sterling Feliz
Esta investigación fue realizada con apoyo económico de la Vicerrectoría de Investigaciones y Vinculación del INTEC.
Referencias
- Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984; 1(8390):1311-5.
- Malfertheiner P, Megraud F, O’Morain CA, Atherton J, Axon ATR, Bazzoli F et al. The European Helicobacter Study Group (EHSG). Management of Helicobacter pylori infection-the Maastricht IV/Florence Consensus Report. Gut. 2012; 61: 646-2.
- Camarena J. Khoury L. Determinación de la sensibilidad a los antibióticos del H. pylori, en una población de portadores de lesión péptica. Ciencia y Sociedad. 2004; xxix(3): 460-72.
- Risk-Matuk I. (2017) Helicobacter pylori: Experiencia de 10 años en una consulta privada, 2006- 2015 (tesis de postgrado). Facultad de Ciencias de la Salud, Escuela de Medicina. Universidad Autónoma de Santo Domingo. Santo Domingo, República Dominicana.
- Gutiérrez B V. Infección por Helicobacter pylori en Santo Domingo, República Dominicana. Rev Cubana Invest Bioméd [online]. 2006;25(4).
- Adamek RJ, Suerbaum S et al. Primary and Acquired Helicobacter pylori Resistance to Clarithromycin, Metronidazol, and Amoxicillin - Influence on Treatment Outcome. The American Journal of Gastroenterology. 1998; 93(3): 386-9.
- Roesler BM, Botelho Costa SC, Robilotta, Zeitune JM. Eradication and Treatment of Helicobacter pylori Infection: Importance and Possible Relationship in Preventing the Development of Gastric Cancer. ISRN Gastroenterology 2012; 2012: 935410. doi: https://doi.org/10.5402/2012/935410
- Graham DY, Fischbach L. Helicobacter pylori treatment in the era of increasing antibiotic resistance. Gut. 2010;59(8):1143-53. doi: https://doi.org/10.1136/gut.2009.192757. Epub 2010 Jun 4
- Chuah S-K, Tsay F-W, Hsu PI, Wu DC. A new look at anti Helicobacter pylori therapy. World J gastroenterol. 2011;17: 3971-5.
- Megraud F. Antibiotic resistance in Helicobacter pylori infection. British Medical Bulletin. 1998; 54: 207-16.
- Kuo CH, Kuo FC, Hu HM, Liu CJ, Wang S, Chen YH et al. The optimal First –Line Therapy of Helicobacter pylori Infection in Year 2012. Gastroenterology Research and Practice. doi: https://doi.org/10.1155/2012/168361
- Vakil N, Megraud F. Eradication therapy for Helicobacter pylori. Gastroenterology. 2007;133: 985-1001.
- Pajares García J M, Pajares-Villarroya R, Gisbert J P. Helicobacter pylori: resistencia a los antibióticos. Rev. esp. enferm. dig. [Internet]. 2007; 99( 2 ): 63-70.
- Miftahussurur M, Cruz M, Subsomwong P, Jiménez Abreu JA, Hosking C, Nagashima H, Akada J, Yamaoka Y. Clarithromycin-Based Triple Therapy is Still Useful as an Initial Treatment for Helicobacter pylori Infection in the Dominican Republic. Am J Trop Med Hyg. 2017;96(5):1050-9. Available from: doi: https://doi.org/10.4269/ajtmh.16-0729. Epub 2017 Feb 13.
- Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. Am J Gastroenterol. 2017;112: 212–38.
- Clyde Thornsberry; NCCLS Standards for Antimicrobial Susceptibility Tests, Laboratory Medicine. 1983;14(9): 549–53. Available from: https://doi.org/10.1093/labmed/14.9.549
- Dore MP, Graham DY, Sepulveda AR, Realdi G, Osato, MS. Sensibilidad de Helicobacter pylori resistente a la amoxicilina a otras penicilinas. Agentes antimicrobianos y quimioterapia. 1999;43(7): 1803-4.
- Ogata S et al. Antimicrobial susceptibility testing for Helicobacter pylori isolates from Brazilian children and adolescents: Comparing agar dilution, E-test, and disk diffusion. Braz J Microbiol. 2015;45: 1439-48.
- Pereyra L, Gorordo R et al. Sensibilidad a los antibióticos de aislamientos de Helicobacter pylori aislados de lesiones gástricas. Rev Argent Microbiol. 2017;49(2): 153-7.
- Siegel S, Castellan N J. Estadística no paramétrica, aplicada a las ciencias de la conducta. (4a. ed.). México: Editorial Trillas; 1995.
- Chen D, Cunningham SA, Cole NC, Kohner PC, Mandrekar JN, Patel R.
- Phenotypic and molecular antimicrobial susceptibility of Helicobacter pylori. Antimicrob Agents Chemother 2017; 61: e02530-6.017. Available from: https://doi.org/10.1128/AAC.02530-16
- Chaves S, Gadanhono M, Teneiro R, Cabrita J, Assessment of Metronidazole Susceptibility in Helicobacter pylori: Statistical Validation and error rate analysis of breakpoints determined by the disk diffusion test. Journal of Clinical Microbiology. 1999;37(5): 1628–31.

