Introducción
La anemia falciforme se define como una enfermedad autosómica recesiva en la que existe un intercambio del aminoácido ácido glutámico por valina, en la cadena de ß -globina de la molécula de hemoglobina. Como resultado, esta hemoglobina anormal (HbS) se polimeriza, haciendo que el eritrocito asuma una forma de hoz y se convierta en una célula un tanto rígida y frágil. Estas células distorsionadas obstruyen los vasos sanguíneos y pueden alterar la función de las células endoteliales, lo que lleva a la hipoxia tisular y complicaciones clínicas2
La mayoría de los afectados manejan niveles de hemoglobina de alrededor de 8 g/dl, hematocrito 15-30% y reticulocitosis significativa1. El conteo de blancos puede variar considerable e impredeciblemente durante y entre las crisis de dolor, episodios infecciosos y otras enfermedades24. El signo clínico fundamental de la anemia falciforme es el dolor asociado a los episodios vaso-oclusivos que, con mayor frecuencia, afecta al tórax, el abdomen o las extremidades. Estos episodios dolorosos constituyen más del 90% de los ingresos hospitalarios agudos y morbilidad significativa en la comunidad. Otras complicaciones incluyen: síndrome torácico agudo, accidentes cerebrovasculares, retinopatía, el retraso en el inicio de la pubertad, priapismo y úlceras en las piernas1,2,23-25.
Las terapias disponibles son de apoyo y hacen poco para cambiar la fisiopatología subyacente de la enfermedad. Estas medidas incluyen el uso de la profilaxis con penicilina en niños, para prevenir la enfermedad neumocócica; inmunizaciones de rutina, la hidratación y terapia narcótica para el manejo de las crisis dolorosas. Por otro lado, las transfusiones sanguíneas se utilizan para aumentar la capacidad de transporte de oxígeno de la sangre y disminuir la concentración de las células con hemoglobina anormal, preservando así la función del órgano y prolongar la vida. A pesar de la utilidad de la transfusión crónica, sus efectos a largo plazo incluyen la sobrecarga de hierro, lo que puede dañar el hígado4.
La hidroxiurea (HU) es un citostático utilizado en pacientes con falcemia. En la actualidad, es la única terapia que se ha demostrado como modificadora de la misma. Funciona aumentando los niveles de hemoglobina fetal (HbF) en el paciente, previniendo de esta forma la polimerización de la HbS dentro del glóbulo rojo y la vaso-oclusión de los vasos sanguíneos4. Diversos estudios que evalúan el uso de hidroxiurea en pacientes falcémicos, han demostrado una definitiva disminución de los episodios de dolor por crisis vaso-oclusivas, síndrome torácico agudo, neumonía y crisis de secuestro, así como también la disminución del requerimiento de las terapias transfusionales, el número de hospitalizaciones en estos pacientes, y finalmente, sirve como terapia preventiva a los accidentes cerebrovasculares.
Además, el uso de hidroxiurea demostró un aumento significativo en el volumen corpuscular medio (VCM), la hemoglobina corpuscular media (HCM) y su concentración, aunque éstos fueron más notables luego de 3 meses de tratamiento. No se observaron diferencias en los parámetros de RDW, conteo de reticulocitos, HbS y HbA2. Se reporta una disminución progresiva en la leucocitosis y trombocitosis secundaria a menor hemólisis, disminución en los niveles elevados de bilirrubina y LDH6,8-15,17-19,21,23,26.
Los efectos adversos reportados, se limitan a neutropenia de moderada a severa, náuseas, vómitos, mucositis, diarrea, alopecia, erupción cutánea, detención curva pondo-estatural7,19,20,22,23. La toxicidad a largo plazo asociada con el uso de hidroxiurea en los niños no ha sido establecida, y existen dudas teóricas acerca del riesgo potencial de leucemias y complicaciones desconocidas25. Sin embargo, los autores consideran que este medicamento es seguro y eficaz para considerar su uso en pacientes pediátricos con anemia falciforme.
Metodología
Se realizó un estudio retrospectivo observacional y descriptivo. La información se recolectó mediante la revisión de las historias clínicas de los pacientes, disponibles en el hospital, y posterior registro de los datos encontrados en una ficha de tipo formulario, que reúne las variables sociodemográficas y pertinentes para el estudio. La población estuvo compuesta por aquellos pacientes con anemia falciforme, actualmente bajo terapia farmacológica con hidroxiurea (210 pacientes), que asistieron al Hospital Infantil Dr. Robert Reid Cabral durante el período septiembre 2009-2015. La muestra (92 pacientes) se obtuvo a partir de un muestreo no probabilístico por conveniencia; se incluyeron pacientes entre 3 a 17 años, con diagnóstico de anemia de células falciformes al momento de iniciado el tratamiento con hidroxiurea, expedientes que contaran con al menos una electroforesis de hemoglobina, seguimiento mínimo de dos consultas luego del inicio de la hidroxiurea y evidencia de manifestaciones causadas por la enfermedad de células falciformes.
Resultados
A continuación, se muestra una serie de gráficas que demuestran los datos recolectados en esta investigación:
Discusión y conclusiones
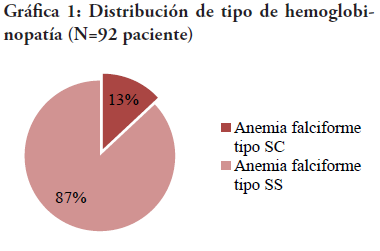
En la muestra estudiada, se encontró que el género dominante fue el femenino, representando el 55% de la muestra, mientras que el masculino es el 45% restante. Se concluyó que el 87% de los pacientes tuvieron el diagnóstico de falcemia homocigótica tipo SS, y el 13% tipo SC (ver Gráfica 2). De la misma manera, la edad al momento del inicio de la terapia se distribuyó en: 3-6 años (30.4%), 7-9 años (27.17%), 10-13 años (30.43%) y 14-17 años (11.96%).
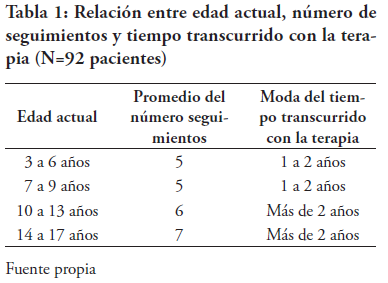
La dosis indicada de hidroxiurea fue de 15-20 mg/ kg/día (96.74%). La distribución de tiempo transcurrido con la terapia fue de < 1 año (17.39%), 1-2 años (26.09%) y >2 años (56.52%) (ver Tabla 1). Con esto, concluimos que la mayoría de pacientes estudiados fueron femeninas, comprendidas entre las edades de 10 a 17 años (38%). Se observó que los pacientes con edades comprendidas entre 3 y 9 años tuvieron en promedio 5 visitas a la consulta, luego de instaurada la terapia, con 1-2 años de seguimiento. Estos valores pueden sugerir que, a menor edad, existe mayor compromiso con la salud del paciente y su tratamiento; esto se puede explicar por el protocolo utilizado en el HIRRC, el cual habla que los niños menores de 10 años deben tener más visitas de consulta, dada su susceptibilidad a infecciones.
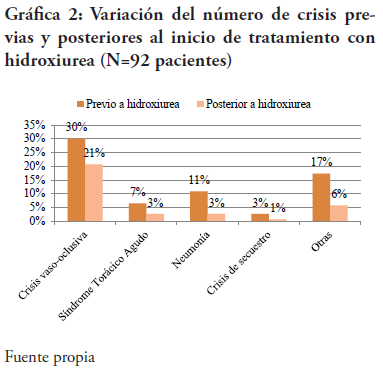
Clínicamente se demostró la eficacia del uso de la hidroxiurea en la disminución de episodios vaso-oclusivos, síndrome torácico agudo, neumonías, crisis de secuestro, entre otras. Se encontró que el tipo de crisis más común registrada fue la crisis vaso–oclusiva, representando un 51% de todas las estudiadas, y una reducción del 30% posterior a la terapia en estas. Para el síndrome torácico agudo se obtuvo una disminución del 57%; los episodios de neumonía acumularon una reducción del 73%; las crisis de secuestro manifestaron una reducción de 67% de las crisis; otros tipos de crisis (priapismo, crisis hiper-hemolíticas, síndrome febril, colelitiasis, accidente cerebro vascular, necrosis avascular del fémur, crisis trombóticas, entre otras) mostraron una reducción del 65% de las mismas. En su totalidad, las crisis se redujeron en un 51% posterior a la hidroxiurea (t = -5.87 y p < 0.00001) (ver Gráfica 2). Otros autores en la bibliografía encontraron una reducción significativa en el número de crisis que se presentaron instaurada la terapia5,6,8,9,11-14,17-19,26
Se observó una reducción de 57% en el número de ingresos hospitalarios (t= -4.510498 y p = 0.000019), además de una reducción del 84% de las transfusiones sanguíneas (t=-4.37 y p= 0.000033). Por su parte, Jain et al19 encontró en su ensayo clínico una reducción en el número de transfusiones sanguíneas del 79.3% posterior a la hidroxiurea. Gonzáles et al.18 reportó una reducción del 61.29% en el número de ingresos hospitalarios, y 91.3% menos en el número de transfusiones.
Al identificar la relación existente entre la duración del tratamiento y dosis administrada, con los posibles efectos reflejados en los valores de laboratorio, se evidenció predominantemente un aumento en los valores de hemoglobina (x2 = 0.7693 y p = 0.942522). Para el hematócrito, no se observó una variación significativa entre los pacientes de la muestra (x2 = 0.6674 y p = 0.95529). Para valores en los leucocitos, se observó en más del 60%, una disminución en los valores (x2 = 4.5231 y p = 0.339815). En las plaquetas, no se observó un patrón de variación que haya permitido establecer una relación (x2 = 1.5427 y p = 0.819048). Se notó que para el VCM, la mayoría de los pacientes experimentó aumento del mismo, sin embargo, no hubo diferencia estadística significativa (x2 = 3.443 y p = 0.486593).
Coincidiendo con lo expresado por Koren et al.6, la hidroxiurea aumenta significativamente los valores de hemoglobina y VCM. Estos hallazgos están reafirmados por Jayabose et al.17 quienes encontraron en el 40% de los pacientes examinados un aumento de la hemoglobina por encima de la línea base. Jain et al.19 también evidenció un aumento de la hemoglobina y VCM, así como una disminución en el número de leucocitos y plaquetas. Los mismos autores concluyeron que la hidroxiurea disminuye por tanto la severidad de la anemia en algunos pacientes, y su toxicidad hematológica es mínima.
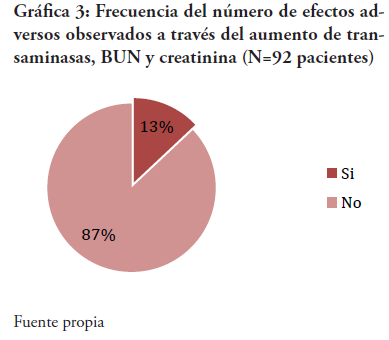
Para los valores de las transaminasas no se encontró variación significativa, así como el análisis estadístico no arrojó significancia estadística: TGO (x2 = 3.8584 y p = 0.425515) y TGP (x2 = 1.1364 y p = 0.888459). Lo mismo sucede con el perfil renal: BUN (x2 = 3.7199 y p = 0.445232) y creatinina (x2 = 0.6433 y p = 0.958138). En general, al evaluar los cambios observados en las transaminasas y los valores del BUN y la creatinina, se puede concluir que en el 87% de los pacientes no presentaron efectos adversos asociados a la farmacoterapia. Siendo estos efectos reflejados en los parámetros de laboratorio antes mencionados. En el 13% de los participantes existió una elevación por encima del rango esperado (ver Gráfica 3); no obstante, este aumento no corresponde a los niveles de toxicidad descritos por la Guía de práctica clínica sobre enfermedad de células falciformes pediátricas publicada por Bleyer7, la cual habla de toxicidad cuando los valores del perfil renal aumentan más allá del 50% del rango esperado y las transaminasas se elevan 5 veces por encima del valor basal. González L2,18 tampoco reportó hallazgos de hepatotoxicidad.
Los párrafos anteriores infieren que, a mayor tiempo con la terapia, en relación a los valores iniciales, la cantidad de hemoglobina y de volumen corpuscular medio aumentan. Por el contrario, los leucocitos disminuyen en más del 50% de los casos, sin importar el tiempo de transcurrida la terapia. Las plaquetas luego del primer año de tratamiento disminuyen en el 50-60% de los pacientes. En cuanto a las enzimas hepáticas, concluimos que sus valores se mantuvieron estables a través del tiempo, aumentando cuando el paciente tenía más de dos años con la terapia instaurada. Por otro lado, en el perfil renal no se identificó un patrón de cambio atribuible a la terapia.
La experiencia clínica recogida en esta investigación demuestra que la hidroxiurea como fármaco es bien tolerada, segura y eficaz para la mayoría de los pacientes, ya que su uso ha demostrado significativa reducción en el número de crisis vaso–oclusivas, síndrome torácico agudo, neumonías, crisis de secuestro y demás. Otros efectos beneficiosos observados fueron el aumento de la hemoglobina, aumento del volumen corpuscular medio y disminución en el número de transfusiones y hospitalizaciones. Los efectos adversos reportados fueron mínimos, no llegando nunca a niveles tóxicos.
Recomendaciones
• Expandir este estudio a una mayor población de pacientes falcémicos con el objetivo de generar estadísticas que puedan utilizarse como parámetro por los proveedores de salud, y determinen factores que intervienen en la adherencia al tratamiento con hidroxiurea.
• Elaborar guías de uso de la hidroxiurea en pacientes falcémicos, dirigidas al personal médico, tanto pediátrico como de atención primaria y otras especialidades, de manera que sea conocido el protocolo necesario para instaurar la terapia a edades más tempranas y el seguimiento pueda ser proporcionado de forma eficaz.
• Desarrollar programas que provean la hidroxiurea a un costo accesible para la población, permitiendo así el uso generalizado de ésta y, en consecuencia, la disminución del índice de ingresos hospitalarios, cuyos recursos pueden ser destinados al impulso de otros programas de salud a nivel nacional.
• Se sugiere al Ministerio de Salud de la República Dominicana, cambiar la hidroxiurea de categoría No Esencial (N) a Esencial (E) en su Cuadro Básico de Medicamentos Esenciales, tomando en cuenta la necesidad, eficacia y seguridad del fármaco. Referencias
1. Organización Mundial de la Salud. Anemia Falciforme [Internet]. Estados Unidos: Organización Mundial de la Salud; 2006 [Citado 2015 Sept 19]. Disponible en: http://apps.who.int/gb/archive/pdf_files/WHA59/A59_9-sp.pdf
2. Segal JB, Strouse JJ, Beach MC, Haywood C, Witkop K, Park H, et al. Hydroxyurea for the Treatment of Sickle Cell Disease. Agency for Healthcare Research and Quality. Feb 2008;165:1-76.
3. Anemia de Células Falciformes [Internet]. Colombia: Universidad del Norte; [fecha desconocida] [Citado 2015 Sept 19]. Disponible en: http://ylang-ylang.uninorte.edu.co:8080/perseo/images/guias/pediatria/ANEMIA_DE_CELULAS_FALCIFORMES.pdf
4. National Heart, Lung and Blood Institute. Evidence-Based Management of Sickle Cell Disease: Expert Panel Report [Internet]. United States: National Heart, Lung and Blood Institute; 2014 [Citado 2015 Sept 19]. Disponible de: https://www.nhlbi.nih.gov/health-pro/guidelines/sickle-cell-disease-guidelines.
5. Maitland-Roue R, Valverde-Muñoz K. Análisis de pacientes drepanocíticos tratados con hidroxiurea en el Hospital Nacional de Niños Acta Médica Costarricense. Acta Médica Costarricense [internet] 2014 [citado 2015 Sept 19];56(2):49-53. Disponible en: http://www.redalyc.org/pdf/434/43431275003.pdf
6. Koren A, Segal-Kupershmit D, Zalman L, Levin C, Abu Hana M, Palmor H, et al. Effect of hydroxyurea in sickle cell anemia: a clinical trial in children and teenagers with severe sickle cell anemia and sickle cell beta-thalassemia [Internet]. Inglaterra: Pediatr Hematol Oncol. 1999; [Citado el 2015 Nov 24];16(3):221-32. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/10326220
7. Bleyer WA, Danielson MG. Oral cancer chemotherapy in paediatric patients: Obstacles and potential for development and utilization [Internet]. Nueva Zelanda: Drugs.1999 [Citado el 2015 Nov 24];58(3):133-140. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/10711852
8. Bernaudin F, Verlhac S, Coic L, Lesprit E, Brugieres P, Reinert P. Long-term follow-up of pediatric sickle cell disease patients with abnormal high velocities on transcranial Doppler [Internet]. Alemania: Pediatr Radiol. 2005 [Citado el 2015 Nov 24];35(3):242-8. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/15703901
9. Bemis EL. Sickle cell safari [Internet]. Estados Unidos: Blood. 1973 [Citado el 2015 Nov 24];42(1):147–9. Disponible en: http://www.bloodjournal.org/content/bloodjournal/42/1/147.full.pdf?sso-checked=true
10. Barakat LP, Lutz M, Smith-Whitley K, OheneFrempong K. Is treatment adherence associated with better quality of life in children with sickle cell disease? [Internet]. Holanda: Qual Life Res. 2005 [Citado el 2015 Nov 24];14(2):407-14. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/15892429
11. Benkerrou M, Delarche C, Brahimi L, Fay M, Vilmer E, Elion J, et al. Hydroxyurea corrects the dysregulated L-selectin expression and increased H(2)O(2) production of polymorphonuclear neutrophils from patients with sickle cell anemia [Internet]. Estados Unidos: Blood. 2002. [Citado el 2015 Nov 24];99(7):2297303. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/11895759
12. Blau CA. Therapy for globin-chain disorders [Internet]. Estados Unidos: N Engl J Med. 1993; 329(5):364. [Citado el 2015 Nov 24]. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/8321277
13. Barosi G, Besses C, Birgegard G, de Briere J, Cervantes F, Finazzi G, et al. A unified definition of clinical resistance/intolerance to hydroxyurea in essential thrombocythemia: results of a consensus process by an international working group [Internet]. Inglaterra: Leukemia. 2007 [Citado el 2015 Nov 24];21(5):1136. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/17251900
14. Bowers M. Hydroxyurea [Internet]. Estados Unidos: BETA. 1997. [Citado el 2015 Nov 24];9-11. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/11364534
15. Bolanos-Meade J, Lopez-Arvizu C, Cobos E. Acute myeloid leukaemia arising from a patient with untreated essential thrombocythaemia [Internet]. Inglaterra: Eur J Haematol. 2002 [Citado el 2015 Nov 24]68(6):397-9. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/12225400
16. Charache S, Terrin ML, Moore RD. et al. Effect of hydroxyurea on the frequency of painful crises in sickle cell anemia. Investigators of the Multicenter Study of Hydroxyurea in Sickle Cell Anemia [Internet]. Estados Unidos: N Engl J Med.1995 [Citado el 2015 Nov 24];332(20):1317-22. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/771563
17. Jayabose S, Tugal O, Sandoval C. et al. Clinical and hematologic effects of hydroxyurea in children with sickle cell anemia [Internet]. Estados Unidos: J Pediatr. 1996. [Citado 2015 Nov 24];129(4):559–65. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/8859263
18. González L, Sánchez M, Insausti C. Tratamiento con hidroxiurea en niños con drepanocitosis. Resultados preliminaries [Internet]. México: Revista de Hematología. 2012 [Citado el 2015 Sept 19];13:165-171.
19. Jain DL, Apte M, Colah R, Sarathi V, Desai S, et al. Efficacy of Fixed Low Dose Hydroxyurea in Indian Children with Sickle Cell Anemia: A Single Centre Experience [Internet]. India: Indian Pediatr. 2013 Oct [Citado el 2015 Nov 24];50(10):929-33. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/23798623
20. Wang W, Ware R, Miller S, Iyer R, Casella J, Minniti C, et al. A multicenter randomized controlled trial of hydroxyurea (hydroxycarbamide) in very young children with sickle cell anaemia [Internet]. Estados Unidos: Lancet; 2014 [Citado el 2015 Sept 19]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3133619/
21. Segal JB, Strouse JJ, Beach MC, et al. Hydroxyurea for the Treatment of Sickle Cell Disease [Internet]. Estados Unidos: Agency for Healthcare Research and Quality; 2008. [Citado 2015 Nov 24]. Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK38490/
22. Sociedad Española de Hematología y oncología Pediátrica. Guía de práctica clínica sobre enfermedad de células falciformes pediátrica [Internet]. España: Sociedad Española de Hematología y oncología Pediátrica; 2010 [citado el 2015 Sept 19]. Disponible en: http://www.madrid.org/cs/Satellite?blobcol=urldata&blobheader=application%2Fpdf&b lobheadername1=Content-disposition&blob headername2=cadena&blobheadervalue1=fil ename%3DG+FALCIF+SEHOP+2010+pdf.pdf&blobheadervalue2=language% 3Des% 26site%3DPortalSalud&blobkey=id& blobtable=MungoBlobs&blobwhere= 1272009829651&ssbinary=true
23. Barraza J, Guzmán A, Vargas R. Eficacia de la hidroxiurea en la disminución de crisis dolorosas en pacientes con anemia de células falciformes. Barranquilla 2011-2013 [Internet]. Barranquilla, CO: Universidad Libre Colombia; 2014 [Citado el 2015 Sept 20]. Disponible en: http://www.unilibrebaq.edu.co/unilibrebaq/revistas2/index.php/biociencias/article/view/548/474
24. Longo DL, Kasper DL, Jameson JL, et al. Harrison’s principles of internal medicine. Vol 1. 18th ed. New York: McGraw Hill; 2012.
25. Kliegman RM, Behrman RE, Jenson HB, Stanton BF. Nelson tratado de Pediatría. 18ª ed. Barcelona: Elsevier; 2008.
26. Wong T, Brandow A, Lim W, Lottenberg R. Update on the use of hydroxyurea therapy in sickle cell disease [Internet]. Estados Unidos: American Society of Hematology; 2014 [Citado el 2015 Sept 17]. Disponible en: http://www.bloodjournal.org/content/bloodjournal/124/26/3850.full.pdf?sso-checked=true
