Introducción
Se puede definir la faringoamigdalitits estreptocócica como una enfermedad que se caracteriza por la inflamación de la pared faríngea y de los tejidos linfáticos circundantes, manifestada por signos y síntomas asociados a una infección limitada del tracto respiratorio superior, originada por el estreptococo β-hemolítico del grupo A.
La faringitis estreptocócica tiene una incidencia elevada. En Estados Unidos, los niños a los 13 años de edad ya han tenido al menos tres cuadros de faringitis estreptocócica1. Asimismo, en México se ha visto un aumento en el número de casos en años consecutivos (1998, 2001 y 2003).
La faringitis estreptocócica produce una serie de complicaciones, tanto supurativas como no supurativas, que pueden tener un desenlace catastrófico; en regiones de bajos recursos estas complicaciones producen una alta morbimortalidad, con una prevalencia que varía desde 1 a 5 por cada 1000 niños, causando más de 400,000 muertes al año. En estas regiones el cultivo microbiológico no es accesible y, por tanto, la mayoría de los casos se tratan empíricamente.
Como la mayoría de los casos son tratados sin la certeza de que el patógeno causante ha sido una bacteria, las infecciones del tracto respiratorio superior han sido una de las causas del desarrollo de la resistencia antimicrobiana en patógenos comunes.
Según la Organización Mundial de la Salud (OMS), el insuficiente compromiso nacional con una respuesta integral y coordinada al problema, el uso inadecuado e irracional de los medicamentos y la escasez de medios de diagnóstico han contribuido considerablemente con el aumento de la resistencia a los antimicrobianos.
Material y métodos
Esta investigación fue de carácter prospectivo, descriptivo, analítico y de corte transversal. Se tomó como universo a todos los pacientes que asistieron a la UNAP de Villa Sombrero durante el período mayo-julio de 2014 (704 pacientes); la muestra la representan todos los pacientes diagnosticados con faringoamigdalitis aguda en la UNAP de Villa Sombrero, Baní, República Dominicana, durante el mismo período, que cumplieran con los criterios de inclusión y exclusión (67 pacientes).
Los criterios de inclusión fueron: 1) pacientes de cualquier edad con criterios clínicos de faringoamigdalitis aguda que asistieron a la UNAP de Villa
Sombrero en el período mayo - julio de 2014. 2) disposición para la realización de la prueba diagnóstica.
Los criterios de exclusión fueron: 1) pacientes de cualquier edad con faringoamigdalitis aguda que hayan tomado antibioterapia antes de su diagnóstico.
2) pacientes de cualquier edad que no presenten sintomatología de faringoamigdalitis.
Los datos fueron obtenidos mediante la aplicación de un protocolo de recolección de datos elaborado por los autores y a través de la realización de la prueba OSOM Strep A Ultra Test a los 67 pacientes pertenecientes a la población estudiada, para la determinación del antígeno del estreptococo β-hemolítico del grupo A. Dicha ficha contiene un signograma donde estuvieron contemplados los diferentes signos y síntomas por los cuales el paciente acude a consulta; asimismo, se plasmó la puntuación del paciente de acuerdo a los criterios de Centor modificados para FA bacteriana, los cuales consisten en: fiebre > 38 grados Celsius (1 punto), hipertrofia o exudado amigdalar (1 punto), adenopatía laterocervical anterior dolorosa (1 punto), ausencia de tos (1 punto); según la edad, corresponde 1 punto si el paciente tiene entre los 3-14 años y corresponde 0 puntos si el paciente tiene más de 15 años; se señaló la recurrencia y los tratamientos farmacológicos y folclóricos utilizados por el paciente previo a la consulta; se estableció el tratamiento indicado en la UNAP y los estudios realizados. Finalmente, se detalla el resultado del OSOM Strep A Ultra Test como positivo, negativo e inconcluyente.
El OSOM Strep A Ultra Test es una prueba aprobada por la Food and Drug Administration (FDA), con una sensibilidad de 96,0%. Se calculó que los intervalos de confianza del 95% fueron de 96,699,0% para la especificidad, y de 94,4-97,6% para la sensibilidad. La concordancia global entre los cultivos y OSOM Strep A Ultra Test es de 97,3%.5 Esta prueba se utilizó previo consentimiento informado, dando a entender que los resultados serán analizados y discutidos, autorizando que sean utilizados para su publicación. No se expone bajo ningún motivo la identidad del paciente, respetando la confidencialidad, privacidad y exclusividad del mismo.
Todos los datos fueron procesados y analizados en el programa IBM SPSS Statistics versión 20 y Microsoft Excel 2013.
Resultados
Gráfico 1: Incidencia de faringoamigdalitis aguda en pacientes que acudieron a la UNAP de la comunidad de Villa Sombrero en el período mayo – julio de 2014 (n=704).
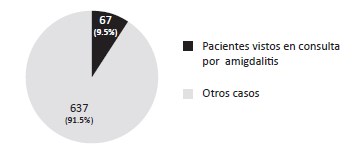
De un total de 704 pacientes registrados que acudieron a la Unidad de Atención Primaria (UNAP), el 9.5% (67) se debió a casos de faringoamigdalitis aguda.
Gráfico 2: Presencia del antígeno del estreptococo β-hemolítico del grupo A en pacientes diagnosticados con faringoamigdalitis aguda en la UNAP, comunidad Villa Sombrero, mayo-julio de 2014 (n=67).

Del total de pacientes registrados con faringoamigdalitis aguda (67), 18 de ellos (26.87%) resultaron positivos para la prueba estreptocócica; mientras que 49 (73.13%) resultaron negativos.
La población femenina fue la de mayor número de casos con la patología, con un total de 35 pacientes y, por lo tanto, la población con más pruebas positivas (11 casos). El rango de edad más afectado fue el de 3-10 años, con un total de 23 casos, equivalente al 65.7%: 15 negativos (65.2%) y 8 (34.8%) positivos; seguido por el rango de edad comprendido entre 11-18 años, con 5 casos (14.3 %): 4 negativos (80%) y 1 caso positivo (20%).
Por otra parte, acudieron 32 casos de faringoamigdalitis en el género masculino, con un total de 7 casos positivos. Al igual que en la población femenina, el rango de edad más afectado fue comprendido entre 3-10 años (24 casos, 75%), con mayor número de pruebas positivas (5 casos, 20%). El segundo rango etario más frecuente para la población masculina también fue el comprendido entre los 11-18 años, con un total de 6 casos (18.8%): con pruebas negativas (66.7%) y 2 pruebas positivas (33.3%).
Gráfico 3: Relación entre las variables edad y sexo vs la presencia del antígeno del estreptococo β-hemolítico del grupo A en Villa Sombrero, mayo – julio de 2014 (n=67).
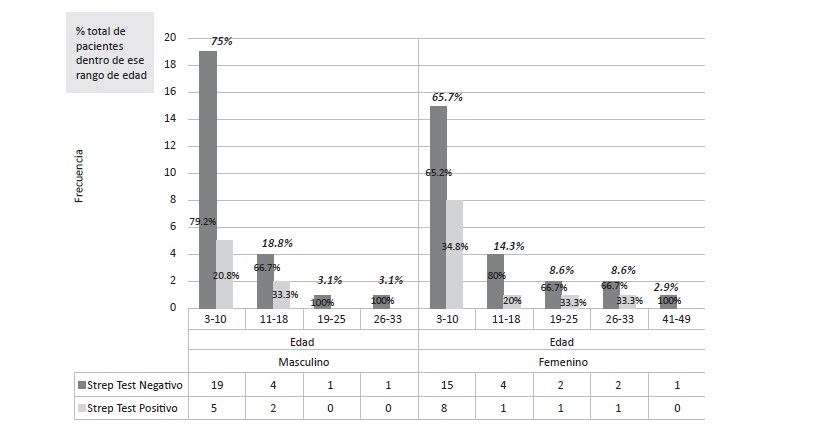
Gráfico 4: Correlación significativa entre sintomatología de faringoamigdalitis aguda y presencia del antígeno del estreptococo β-hemolítico del grupo A, Villa Sombrero, mayo – julio de 2014 (n=67).
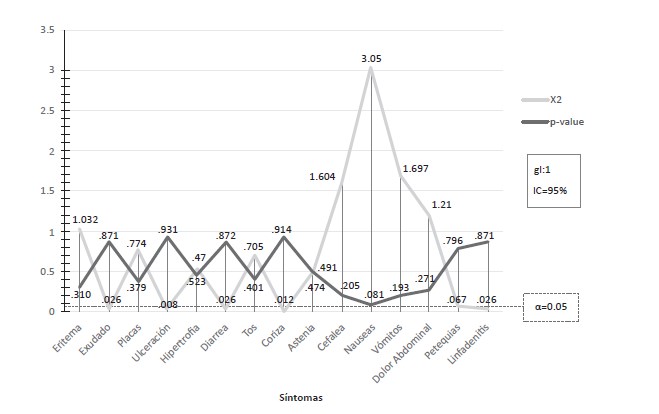
Se realizó el test de correlación Chi cuadrado para variables cualitativas, usando un intervalo de confianza del 95%. En todos los casos, el grado de libertad (gl) fue de uno (1). Se graficaron tanto los valores del test de Chi cuadrado como el p-value o nivel de significancia para cada caso y, como puede observase, en ninguno de los casos el p-value estuvo por debajo del nivel de riesgo aceptado α=0.05 (línea roja punteada), lo que nos indica que todas las variables son independientes y, por lo tanto, no existe ninguna relación significativa entre el hecho de poseer o no un síntoma específico y resultar positivo o negativo en la prueba estreptocócica.
Gráfico 5: Correlación significativa entre puntuación obtenida por medio de los criterios Centor modificados y presencia del antígeno del estreptococo del grupo A, Villa Sombrero, mayo – julio de 2014 (n=67).

Se realizó la prueba no paramétrica de correlaciones U de Mann-Withney entre las variables “Puntuación de Centor” y “Presencia del antígeno”; el test reveló un valor U=392.5, lo cual arroja un p-value =0.444, lo que no es significativo para afirmar que en nuestra población existe una relación fuerte entre el hecho de tener una puntuación determinada en los criterios de Centor modificados y la presencia del antígeno.
Gráfico 6: Antibióticos utilizados en los pacientes diagnosticados con faringoamigdalitis aguda, en la comunidad de Villa Sombrero, mayojulio de 2014 (n=67).
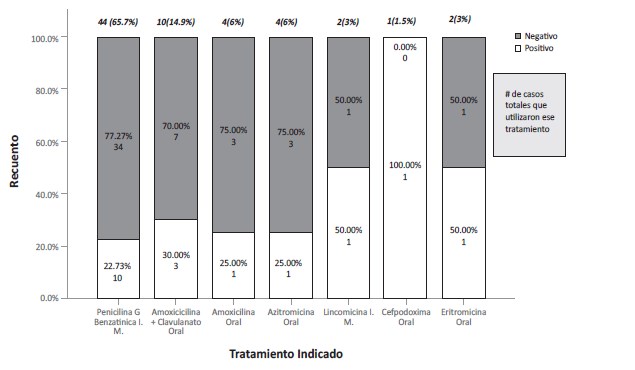
El estudio arrojó que el antibiótico más utilizado durante el período de estudio fue la penicilina benzatínica, vía intramuscular (i.m.), en dosis calculadas para la edad correspondiente a cada paciente, con un total de 44 casos, lo que equivale al 65.7% del total de casos con faringoamigdalitis, de los cuales 34 resultaron negativos (77.27%) y 10 fueron positivos (22.73%).
El segundo antibiótico más frecuente fue la amoxicilina más clavulanato, vía oral, con un total de 10 pacientes (14.9%) y, dentro de estos, 7 fueron negativos (70%) y 3 fueron positivos (30%). Luego, la amoxicilina oral y la azitromicina oral siguen en el orden de frecuencia con 4 pacientes para cada una (6%) y ambas con 3 pacientes negativos (75%) y 1 positivo (25%) para cada antibiótico. Por último, tenemos la cefpodoxima oral, usada en 1 sola ocasión y dando resultado negativo en la prueba, mientras que la eritromicina se utilizó en 2 ocasiones con un paciente positivo (50%) y uno negativo (50%).
Discusión
Tomando como base los resultados arrojados por esta investigación, la incidencia de faringoamigdalitis en el período de estudio fue de un 9.5%. (gráfico 1). Al comparar estos resultados con diversas investigaciones realizadas en el país, pudimos observar que la incidencia fue similar, con un 10.3% en la comunidad de Boca Canasta6; ligeramente mayor en Barahona, con un 12.5%7; y menor en la provincia de San Cristóbal, con un 8.26%8.
Esta variación puede deberse a que las investigaciones fueron realizadas en diferentes períodos de estudio y, de acuerdo a la bibliografía consultada, esta patología tiene prevalencia estacional, aumentando su incidencia en invierno y primavera9, mientras que nuestra investigación fue realizada en verano.
Las literaturas internacionales asocian alrededor del 15-30% de las faringoamigdalitis al EBHGA10, 11. En analogía con lo anteriormente expuesto, en nuestra población de estudio el 26.87% de los pacientes resultaron positivos para la prueba estreptocócica (gráfico 2). Estas cifras se asemejan a un estudio realizado en Sao Paulo, con un 26% de casos positivos, utilizando la detección del antígeno mediante el mismo método, y un 30% de los casos utilizando cultivo bacteriológico.12 La población femenina obtuvo un mayor número de casos con la patología (35) y, por lo tanto, fue la población con más pruebas positivas (11 casos). Pero, la diferencia no fue significativa con respecto al género masculino (32 casos; 7 positivos) (gráfico 3).
En varios estudios realizados en el país hubo predominio de los casos de FA en el género femenino, con un 58.7% en el Municipio de Matanzas13 y un 66.2% en la comunidad de Boca Canasta. Sin embargo, en diversas bibliografías consultadas se ha constatado que la faringoamigdalitis no tiene predilección por sexo, lo cual concuerda con nuestro estudio.
Además, en la población de estudio el grupo etario con mayor positividad fue comprendido entre 3-11 años (gráfico 3); esto se correlaciona con investigaciones realizadas en el país y con un gran número de literaturas internacionales que afirman que esta población es la de mayor riesgo, debido a que estos niños mantienen un contacto estrecho en los salones de clases, lo que resulta ser un gran potenciador de la propagación del EBHGA.
Las faringoamidalitis agudas bacterianas causadas por EBHGA, las causadas por virus y otros microorganismos tienen sintomatologías típicas que las caracterizan, por lo que surgió la siguiente pregunta: ¿es significativo hacer el diagnóstico y la toma de decisión terapéutica en nuestra población basándose solo en la sintomatología presentada? Nuestra investigación arrojó que el hecho de presentar o no un síntoma en cuestión no guarda una relación suficientemente significativa con tener una prueba estreptocócica positiva o negativa (gráfico 4); por lo que se deduce que el tener una sintomatología típica o atípica de faringoamigdalitis por EBHGA no es suficiente para decidir el uso de antibioterapia, o bien, descartarla.
Lo anteriormente expuesto concuerda con un estudio realizado en Chile, en el cual se demostró una ausencia de correlación entre las variables clínicas (síntomas y signos) y el resultado del cultivo faríngeo, tendencia que se mantuvo al aplicar los criterios de Centor17. Del mismo modo, se analizó un estudio realizado en España, donde se catalogó a los pacientes de acuerdo a su sintomatología de FA en “sospecha alta” y “sospecha intermedia”; luego, se procedió a la utilización de la prueba rápida para la detección del EBHGA y se concluyó que la prescripción inadecuada de antibióticos fue alta.
Además, se demostró que la clínica no es suficiente a la hora de orientar el diagnóstico y pautar una terapia antimicrobiana18. Esto confirma lo descrito en la literatura consultada, que expone que tanto la anamnesis como la exploración física tienen una baja sensibilidad y especificidad para diferenciar entre infección bacteriana y vírica, así como para el diagnóstico de infección por EBHGA
Asimismo, en nuestro estudio, el hecho de poseer una puntuación determinada de los criterios de Centor modificados no estuvo significativamente relacionado con la presencia o no del antígeno (gráfico 5). Sería prudente la realización de un estudio con una mayor cobertura que certifique estos datos.
Debido a que a todos los pacientes se les prescribió antibióticos, es correcto decir que en el 70% de estos casos, aproximadamente, el empleo de los antibióticos fue innecesario, ya que ese porcentaje de pacientes no mostraba positividad para el antígeno (gráfico 6), por lo que podría considerarse que dichos casos presentaban una etiología viral.
A modo de cierre, concluimos que la faringoamigdalitis aguda en la comunidad de Villa Sombrero es una patología frecuente, con una alta incidencia, lo cual, debido a su naturaleza y potenciales complicaciones, debe ser tomado en cuenta por las autoridades pertinentes; debe realizarse un buen diagnóstico diferencial y así ofrecer un manejo adecuado, disminuyendo así los altos costos invertidos en medicamentos y el aumento de la resistencia bacteriana.
Bibliografía
1. Ávila F. Infecciones respiratorias en pediatría. 1a Ed. México: McGraw- Hill; 2009.
2. Rimoin A, Fischer C, Hamza H. The utility of rapid antigen detection testing for the diagnosis of streptococcal pharyngitis in low-resource settings. International Journal of Infectious Diseases. 2010;14(12):1048-1053.
3. Shulman S, Bisno A, Clegg H. Clinical Practice Guideline for the Diagnosis and Management of Group A Streptococcal Pharyngitis. Infectious Diseases Society of America;2012 [citado 4 junio 2014]. Disponible en: http://cid.oxfordjournals.org/content/early/2012/09/06/cid.cis629.full
4. Organización Mundial de la Salud. Resistencia a los antimicrobianos (RAM); 2012 [citado 9 julio 2014]. Disponible en: http://www.whoint/mediacentre/factsheets/fs194/es.
5. Fernández O, Cabrera H, Callejas J, Hernández M. Implantación de un test de detección rápida de estreptococo betahemolítico del grupo A en la consulta de Atención Primaria. Revista de Pediatría en Atención Primaria. 2007;9(2):565-575.
6. Díaz M, Fernández C, Peña J, Pérez Y, Féliz A. Incidencia de faringoamigdalitis y otitis media de pacientes que asistieron al centro de salud de Boca Canasta. Revista Médica Dominicana. 2005;66:69-72.
7. Paradis H, Peña AE, Florián SA. Incidencia de amigdalitis en clínicas rurales de Barahona. Revista Médica Dominicana. 2000;61:47-48.
8. Pol E, González K, Vargas Y, Méndez F. Frecuencia de amigdalitis aguda en una población rural. Revista Médica Dominicana. 2002;63:34-36.
9. Gentile A, Sverdloff H. (2012). Consenso sobre Infecciones en Pediatría Ambulatoria, 9 de Julio de 2014, Sociedad Argentina de Pediatría. Disponible en: http://www.sap.org.ar/staticfiles/educacion/consensos/pedamb/index.htm
10. Bercedo Sanz A, Cortés Rico O, García Vera C, Montón Álvarez JL. Normas de calidad para el diagnóstico y tratamiento de la faringoamigdalitis aguda en Pediatría de atención primaria; 2011 [citado 18 jun 2014], Asociación Española de Pediatría de Atención Primaria. Disponible en: www.aepap.org/gvr/ protocolos.htm
11. Pan-American association of otorhinolaryngology and head and neck surgery. Pan- American clinical practice guideline for medical management of acute tonsillitis and adenoids hypertrophy; 2012 [citado 28 mayo 2014], Pan-American association of otorhinolaryngology and head and neck surgery. Disponible en: http://www.researchposters.com/Posters/AAOHNSF/AAO2012/SP450.pdf
12. Santos P, Villa L. Use of the rapid antigen technique in the diagnosis of Streptococcus pyogenes pharyngotonsillitis. Anales de Pediatría. 2003;77:193-199.
13. Cuevas F, Lima R, Melo C. Aplicación de los Criterios de Centor Modificados para el diagnóstico y manejo clínico de la amigdalitis aguda en los pacientes que asisten a la UNAP del municipio Matanzas, provincia Peravia, Baní, Rep. Dom., en el período Nov. 2013- Ene 2014. Santo Domingo, República Dominicana. Instituto Tecnológico de Santo Domingo; 2014.
14. Heymann D. El control de las enfermedades transmisibles. 17.a Ed. Washington: OMS; 2011. 976 p. 15. Sociedad española de Quimioterapia. Documento de consenso sobre tratamiento antimicrobiano de la faringoamigdalitis. Revista Española Quimioterapia. 2003;16(1):74-88.
16. Mandell G, Bennett D, Dolin R. Enfermedades infecciosas: principios y prácticas. 8.ª ed. España: Elsevier; 2012.
17. Castillo M, Morales P, Fonseca X. Absence of correlation between clinical variables and etiology of acute pharyngotonsillitis: prospective study of cases and controls. Revista Otorrinolaringología y Cirugía de Cabeza y Cuello. 2008;68(1):7-15.
18. Cooper R. Principles of appropiate antibiotic use for acute pharyngitis in adults: background. Annals of Internal Medicine. 2001;134(6):509-517.
19. Isaac M. The validity of a sore throat score in family practice. Canadian Medical Association Journal. 2000;163(7):811-5.
20. Isaac M. Empirical validation of guidelines for the management of pharyngitis in children and adults. Journal of the American Medical Association. 2004;291(13):1587-95.
