Ciencia, Ambiente y Clima, Vol. 7, No. 1, enero-junio, 2024 ISSN (impreso): 2636-2317 • ISSN (en línea): 2636-2333 • Sitio web: https://revistas.intec.edu.do/
BIOPROSPECCIÓN DE LECTINAS EN PLANTAS DE LA FAMILIA RUBIACEAE ENDÉMICAS DE LA REPÚBLICA DOMINICANA
Bioprospecting of lectins in plants of the Rubiaceae family endemic to the Dominican Republic
MARQUI RAMOS ABREU1, LUIS ORLANDO MAROTO MARTÍN2, EDIAN F. FRANCO3, LUIS ENRIQUE DE FRANCISCO4
Recibido: 11 de junio de 2024 • Aceptado: 28 de junio de 2024
Cómo citar: Ramos Abreu, M., Maroto Martín, L. O., Franco F., E., De Francisco, L. E. (2024). Bioprospección de lectinas en plantas de la familia rubiaceae endémicas de la República Dominicana. Ciencia, Ambiente y Clima, 7(1), 99-122. https://doi.org/10.22206/cac.2024.v7i1.3177.
Resumen
Las lectinas son proteínas que se unen específicamente a carbohidratos de manera reversible y no catalítica. Debido a sus múltiples funciones biológicas dentro de los organismos, son de amplio interés en la biotecnología. Esta investigación tuvo por objetivo la detección y caracterización de lectinas en tres especies endémicas de la República Dominicana, pertenecientes a la familia Rubiaceae. De estas especies, se detectó al menos una posible lectina en las hojas de Stevensia grandiflora, fuertemente aglutinante para todos los grupos sanguíneos humanos y de forma leve para la levadura Saccharomyces cerevisiae. La lectina mostró estabilidad a 100°C, tener carácter glicoproteico, precipitar a concentraciones de 40% con sulfato de amonio y ser específica para los disacáridos sacarosa y lactosa. Además, mostró cierta especificidad frente a varios monosacáridos, característica semejante a las lectinas con dominios proteicos de leguminosas. Por otro lado, las bandas visualizadas en la electroforesis SDS-PAGE, en condiciones reductoras, demostraron la posible estructura monomérica o dimérica de la(s) lectina(s) detectada(s). Estos resultados representan nuevas lectinas para la tribu de rubiáceas Rondeletieae, con el potencial de servir como herramientas en biotecnología y medicina.
Palabras claves: lectinas, rubiaceae, bioprospección, plantas endémicas, aglutinación.
Abstract
Lectins are proteins that specifically bind to carbohydrates in a reversible and non-catalytic manner. Due to their multiple biological functions within organisms, they are of wide interest in biotechnology. The objective of this research was the detection and characterization of lectins in three endemic species of the Dominican Republic, belonging to the Rubiaceae family. Of these species, at least one possible lectin was detected in Stevensia grandiflora leaves, strongly agglutinating for all human blood groups and weakly for the yeast Saccharomyces cerevisiae. The lectin showed stability at 100°C, had a glycoprotein character, precipitated at 40% concentrations with ammonium sulfate, and was specific for the disaccharides sucrose and lactose. In addition, it showed some specificity against several monosaccharides, a characteristic like lectins with legume protein domains. On the other hand, the bands visualized in the SDS-PAGE electrophoresis, under reducing conditions, demonstrated the possible monomeric or dimeric structure of the detected lectin(s). These results represent new lectins for the Rubiaceae Rondeletieae tribe, with the potential to serve as tools in biotechnology and medicine.
Keywords: lectins, rubiaceae, bioprospecting, endemic plants, agglutination.
Introducción
Las lectinas son un grupo de proteínas que se unen específica y reversiblemente a carbohidratos (Dang y Van Damme, 2015). A menudo son multivalentes, lo cual explica su bien conocida propiedad de aglutinar células (Varrot, 2013). Se conocen lectinas en plantas, animales, hongos, bacterias y virus (Dias et al., 2015; Tsaneva y Van Damme, 2020). Sus funciones en las plantas se han asociado a la germinación, la unión de bacterias fijadoras de nitrógeno, mecanismos de defensa, el almacenamiento de sacáridos y glicoproteínas, el transporte de sustancias de reserva, la elongación de la pared celular, la regulación del crecimiento y la protección enzimática, entre otros (De Coninck y Van Damme, 2021).
En animales, las lectinas se han vinculado principalmente al tráfico celular, la regulación inmunitaria y la prevención de la autoinmunidad (Loh et al., 2017). En los hongos, funcionan también en el almacenamiento de biomoléculas e intervienen en el crecimiento, desarrollo y morfogénesis (Varrot, 2013). Por otro lado, en la mayoría de las bacterias, las lectinas forman parte de su mecanismo de supervivencia para colonizar células huésped, como por ejemplo las adhesinas bacterianas que se unen a las células del intestino (Moonens y Remaut, 2017; Oggero y Forno, 2021). Así mismo las lectinas virales permiten el reconocimiento de restos de azúcar (receptores) en las membranas de la célula huésped que le sirven al virus para ingresar a la célula (Chen y Li, 2013; Büker y Saraçoğlu, 2021).
Debido a sus diversas funciones en los organismos y a sus propiedades antidiabéticas, anti-cáncer, bactericidas, antivirales, antifúngicas e insecticidas las lectinas están siendo muy utilizadas en la biomedicina e investigación aplicada (Dang y Van Damme, 2015; Büker y Saraçoğlu, 2021; Naithani et al., 2021). Su uso antidiabético viene dado por la capacidad de suprimir el estado de hiperglucemia a partir de diversos mecanismos como la estimulación de la producción de insulina (Gray y Flatt, 1999), la reducción de la glucosa en plasma (Rocha et al., 2013) y glucosa sérica (Sawant et al., 2017). En la lucha contra el cáncer, las lectinas permiten distinguir entre células normales y malignas mediante el reconocimiento de la estructura modificada de glicanos que se expresa mayormente en células tumorales (Yau et al., 2015). Así mismo, las lectinas pueden suprimir el crecimiento tumoral mediante la inducción de la apoptosis y la autofagia (Oliveira et al., 2011).
Los efectos bactericidas de las lectinas están relacionados a la interacción con carbohidratos complejos presentes en la superficie de las bacterias como los lipopolisacáridos (LPS), peptidoglucanos, ácidos tecnoicos, residuos de ácido N-acetilmurámico (NAM), N-acetilglucosamina y tetrapéptidos ligados al NAM o LPS (Ayouba et al., 1994; Hamid et al., 2013; Lagarda-Diaz et al., 2017). Los efectos antivirales involucran la unión de las lectinas a glucanos presentes en las glicoproteínas de la envoltura de los virus, evitando la interacción de este con los receptores de las células huésped (Mishra et al., 2019).
En el caso de la actividad antifúngica, esta se debe a la unión de algunas lectinas específicas de quitinas y otros glicanos en la superficie del hongo, afectando la absorción de nutrientes, el proceso de germinación de esporas y el crecimiento (Hamid et al., 2013). Por otro lado, las lectinas presentan sus efectos insecticidas mediante la interacción con la membrana peritrófica y/o la estructura quitinosa del intestino de los insectos que inhibe la digestión y absorción de nutrientes (Walski et al., 2014).
Aunque las lectinas están presentes en todos los reinos de la naturaleza (Torres et al., 2019; Büker y Saraçoğlu, 2021; Naithani et al., 2021), la mayoría de los estudios de presencia de lectinas se han centrado en las semillas de leguminosas (Fabaceae) (Tsaneva y Van Damme, 2020). De hecho, de 500 lectinas aisladas y reportadas para el reino vegetal, 100 pertenecen a la familia Fabaceae (Mishra et al., 2019). Sin embargo, también se conocen algunas lectinas aisladas a partir de plantas rubiáceas como la jagua (Genipa americana), el café (Coffea sp.) y el noni (Morinda citrifolia) (Coelho et al., 2010; Bezerra et al., 2018; Mauliku, 2021). Dado el alto endemismo de rubiáceas en La Española (Liogier 1995; 2009), se espera que nuevas lectinas pudieran descubrirse a partir de estas.
Por eso, en esta investigación se realizó un análisis proteico para detectar y caracterizar lectinas en tres especies de la familia Rubiaceae endémicas de República Dominicana: Cubanola domingensis, Exostema acuminatum y Stevensia grandiflora. Nuestro objetivo es encontrar nuevos compuestos con potencial farmacológico a partir de la biodiversidad local, y resaltar el valor de las plantas endémicas de la República Dominicana, promoviendo su conservación. Este estudio constituye también la primera prospección de lectinas realizada en el país.
Metodología
Extracción proteica
Las especies de rubiáceas seleccionadas para este estudio fueron campanita criolla [Cubanola domingensis (Britton) Aiello], quina (Exostema acuminatum Urb) y cuabilla (Stevensia grandiflora Lioger) (Figura 1). Se utilizaron muestras de hojas y semillas, exceptuando a E. acuminatum, que sólo fueron evaluadas las hojas. El material vegetal fue donado por el Jardín Botánico Nacional Dr. Rafael M. Moscoso (JBN). Las muestras fueron conservadas a -20 °C hasta el momento de la extracción proteica.
Figura 1
Imágenes de especímenes preservados correspondientes a las tres especies de plantas seleccionadas del Herbario Nacional del Jardín Botánico Dr. Rafael M. Moscoso, Santo Domingo. De izquierda a derecha: Cubanola domingensis, Exostema acuminatum y Stevensia grandiflora

La extracción proteica se realizó con PBS 0.1 M (Aldon, Avon, NY), en proporción 1:10 con agua destilada (Asseleih et al., 1989; Hidalgo, 2017; Nova et al., 2020), dejando en agitación continua durante 24 horas luego del triturado (Hidalgo, 2017). Los extractos fueron filtrados utilizando papel filtro Fisherbrand (diámetro: 12.5 cm, porosidad: fina, flujo: lento; Fisher Scientific, Waltham, MA) (Reyes-Pool, 2008; Torres et al., 2019). Posteriormente, se centrifugaron a 10,000 rpm por 10 minutos (Reyes-Pool, 2008; Hidalgo, 2017; Sarkar et al., 2019), y se conservó el sobrenadante a -20⁰C (Adenike y Eretan, 2003; Torres et al., 2019). La estimación de la concentración proteica se realizó por el método de Bradford (1976) en un espectrofotómetro NanoDrop One (Thermo Fisher Scientific, Waltham, MA), con mediciones a 595 nm. Se usaron patrones de BSA con concentraciones de 0 a 2 mg/mL.
Hemaglutinación
Se realizaron ensayos de hemaglutinación con suspensiones de eritrocitos humanos lavados al 4% tipo A, B, AB y O positivo para la detección de lectinas (Adenike y Eretan, 2003; Dos Santos, 2003; Reyes-Pool, 2008; Coelho et al., 2010; Hidalgo, 2017; Torres et al., 2019; Naik y Kumar 2020). Las suspensiones de eritrocitos fueron donadas por el Laboratorio Clínico de Referencia (Santo Domingo). Se trabajó en microplacas de fondo en U de 96 pocillos, mediante el protocolo de Sano y Ogawa (2014), haciendo diluciones seriadas de las muestras en proporción 1:1. Se utilizó 50 μL de suspensión sanguínea, usando un diseño por réplica. Se dejó incubar a temperatura ambiente por 45 min para la visualización de los resultados.
Los resultados se expresaron como unidades hemaglutinantes (UHA) (Torres et al., 2019) y como hemaglutinación específica (SHA) (Bezerra et al., 2018; Torres et al., 2019). En conjunto con la prueba de hemaglutinación, se realizó también una prueba de termoestabilidad, bajo las mismas condiciones iniciales, pero calentando previamente las muestras a 100°C por 10 minutos en una placa calentadora (Thermo Fisher Scientific, Waltham, MA).
Aglutinación de levadura
La prueba de aglutinación de levadura se realizó para identificar lectinas con alta especificidad a complejos de manosa (Mirelman et al. 1980; Regente et al., 2014). Se cultivaron 300 mg de levaduras tradicionales (Saccharomyces cerevisiae) en agua peptonada (Hardy Diagnostics, Santa Bárbara, CA) a 37°C durante 24 horas. El cultivo fue sometido a dos centrifugaciones a 2,500 rpm por 10 minutos; en ambas ocasiones se decantó el sobrenadante y se resuspendió el pellet en 10 mL de PBS 0.1 M. Se conservó el cultivo entre 1 y 6 °C hasta el momento de uso.
El ensayo se realizó en placas de fondo en U de 12 pocillos, con diluciones seriadas 1:1 de cada muestra. Se usaron 100 μL de la suspensión de levadura en cada uno de los pocillos y se mezcló suavemente con un palillo. Los resultados fueron expresados con unidades aglutinantes y aglutinación específica.
Inhibición de la hemaglutinación
La IHA se realizó con muestras positivas a hemaglutinación para determinar los carbohidratos que inhiben la acción de las lectinas sobre los eritrocitos. Los sacáridos probados fueron L-fucosa, D-glucosa, α-D-lactosa, D-fructosa, D-manosa, metil-α-D-manopiranósido, D-galactosa, N-acetil-D-glucosamina, N-acetil-D-galactosamina, ácido N-acetilneuramínico (ácido siálico) (Chem-Impex, Wood Dale, IL) y D-sacarosa (Himedia, Chester, PA). Las concentraciones iniciales fueron de 0.4 M (Dos Santos, 2003; Bezerra et al., 2018; Nova et al., 2020).
Los ensayos se realizaron bajo las mismas condiciones de la prueba de hemaglutinación, en placas de 96 pocillos en fondo de U. Las muestras fueron incubadas previamente durante 45 minutos a temperatura ambiente, con el sacárido a evaluar. Posteriormente, se colocaron los 50 μL de cada suspensión de eritrocitos.
Fraccionamiento proteico
Los extractos crudos con resultados positivos en las pruebas de detección de lectinas se sometieron a dos concentraciones de sulfato de amonio (40% y 60%) para recuperar perfiles diferentes de proteínas, de acuerdo con su solubilidad (Sarkar et al., 2019; Naik y Kumar 2020). La cantidad de sulfato de amonio (Himedia, Chester, PA) utilizada para preparar ambas fracciones, se tomó de Scopes (1988). Los extractos concentrados con la sal fueron dejados en agitación durante 24 horas en un agitador lineal Reciprocal 30 (Labnet, Edison, NJ). Se centrifugó a 10,000 rpm durante 20 min, luego se diluyó el pellet en 1 mL de PBS 0.1 M (Dos Santos, 2003; Sarkar et al., 2019; Naik y Kumar 2020), para recolectar las proteínas precipitadas al 40% de saturación con sulfato de amonio. Para recolectar las proteínas precipitadas al 60%, se repitió el proceso de agitación y centrifugación tras añadir a los sobrenadantes del 40% la cantidad adecuada de sulfato de amonio indicada por Scopes (1988). Todas las fracciones fueron conservadas a -20 °C hasta el momento de la diálisis.
La eliminación del sulfato de amonio se realizó con membranas de diálisis Spectra/Por (Spectrum, New Brunswick, NJ) frente a agua destilada (Hidalgo, 2017). Posteriormente, se realizaron los ensayos de detección, inhibición y medición de la concentración proteica a ambas fracciones y a los sobrenadantes.
Contenido de compuestos fenólicos totales
El ensayo de cuantificación de compuestos fenólicos totales se realizó como prueba adicional para los extractos crudos y fracciones que presentaron actividad de lectinas en las pruebas de aglutinación, usando el protocolo de López-Hidalgo et al. (2021), con reactivo de Folin-Ciocalteu (Spectrum, Gardena, CA) al 10%. Las muestras y estándares se realizaron por triplicado y se midieron las absorbancias a 720 nm en un espectrofotómetro Agile Spec (ACT Gene, Piscataway, NJ). Se usaron patrones de ácido gálico (Merck, Darmstadt, Germany) de concentraciones entre 0 y 1 mM.
Contenido de carbohidratos totales
Se realizó también un ensayo de cuantificación de carbohidratos totales, por el método del fenol-ácido sulfúrico, para los extractos crudos y fracciones que presentaron actividad de lectinas, de acuerdo con el protocolo de Nielsen (2009). Luego de la incubación con los reactivos, se agitaron los tubos en un vortex (VWR, Radnor, PA) para dejar enfriar durante 20 min. En cubetas de vidrio, se midieron las absorbancias de los estándares y muestras a 490 nm en un espectrofotómetro Agile Spec (ACT Gene, Piscataway, NJ). Se usaron patrones de glucosa (Chem-Impex, Wood Dale, IL) de 0 a 100 µg/mL.
Electroforesis SDS-PAGE
Se realizó una electroforesis SDS-PAGE utilizando el método tradicional de Laemmli (1970), en presencia de β-mercaptoetanol, para determinar las posibles características estructurales de las lectinas detectadas. Se usó poliacrilamida al 12.5% en un equipo Mini-PROTEAN (Bio Rad, Hercules, CA). Los geles fueron previamente lavados con agua destilada antes de la tinción. Posteriormente, se tiñeron con una solución al 0.1% de Azul de Coomassie R250, metanol al 20% y ácido acético al 10%. Los geles se dejaron teñir por aproximadamente 20 horas en un agitador lineal Reciprocal 30 (Labnet, Edison, NJ). Para la extracción del colorante, se procedió a realizar un lavado con Tris 0.1M (pH 6.5) durante 3 min, con metanol al 25% durante un minuto y con sulfato de amonio al 20% durante 24 horas.
Resultados
Presencia de lectinas
El único extracto crudo que indicó presencia de lectinas por aglutinamiento fue el de hojas de Stevensia grandiflora (Tabla 1), teniendo iguales niveles de aglutinación en todos los grupos sanguíneos. Por otro lado, de las dos fracciones elaboradas para este extracto crudo, sólo la fracción proteica al 40% de saturación de sulfato de amonio aglutinó, observándose los valores más altos en el grupo sanguíneo O. En cuanto a la aglutinación de levadura, se observó de manera leve en el extracto crudo de S. grandiflora, aumentando un poco en la fracción al 40%.
Tabla 1
Resultado de los ensayos de aglutinación con tipos de sangre (A, B, AB, O) y con levadura Saccharomyces cerevisiae. UHA/UA: unidades hemaglutinantes/aglutinantes, SHA/SA: hemaglutinación/aglutinación específica (por sus siglas en inglés), (-): No aglutinación detectada, N/A: No aplica.
|
A |
B |
AB |
O |
Levadura |
|||||
Muestra |
UHA |
SHA |
UHA |
SHA |
UHA |
SHA |
UHA |
SHA |
UA |
SA |
Stevensia grandiflora |
|
|
|
|
|
|
|
|
|
|
Extracto crudo |
|
|
|
|
|
|
|
|
|
|
Hojas |
128.00 |
326.79 |
128.00 |
326.79 |
128.00 |
326.79 |
128.00 |
326.79 |
1.00 |
2.55 |
Semillas |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Hojas 100°C |
128.00 |
326.79 |
64.00 |
163.39 |
64.00 |
163.39 |
128.00 |
326.79 |
N/A |
N/A |
Fracción 40% |
|
|
|
|
|
|
|
|
|
|
Hojas |
32.00 |
41.92 |
64.00 |
83.85 |
32.00 |
41.92 |
128.00 |
167.70 |
4.00 |
5.24 |
Semillas |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Hojas 100°C |
32.00 |
41.92 |
32.00 |
41.92 |
32.00 |
41.92 |
16.00 |
20.96 |
N/A |
N/A |
Fracción 60% |
|
|
|
|
|
|
|
|
|
|
Hojas |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Semillas |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Sobrenadante |
|
|
|
|
|
|
|
|
|
|
Hojas |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Semillas |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Cubanola domingensis |
|
|
|
|
|
|
|
|
|
|
Extracto crudo |
|
|
|
|
|
|
|
|
|
|
Hojas |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Semillas |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Exostema acuminatum |
|
|
|
|
|
|
|
|
|
|
Extracto crudo |
|
|
|
|
|
|
|
|
|
|
Hojas |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Con respecto a la termoestabilidad (Tabla 1), se observó una leve reducción de la actividad hemaglutinante del extracto crudo de S. grandiflora para los grupos B y AB, mientras que en A y O se mantuvo igual. Igualmente, en la fracción al 40% calentada a 100°C se observó una leve reducción de la hemaglutinación en el grupo B, mientras que en A y AB se mantuvo igual. Sin embargo, en el caso del grupo O, se observó una fuerte disminución de la actividad aglutinante (más de la mitad de las UHA).
Especificidad
Sólo se observó inhibición de la hemaglutinación en la fracción al 40% de S. grandiflora, con todos los sacáridos usados, exceptuando el ácido siálico (Tabla 2). Los valores más altos de especificidad se detectaron con los tipos sanguíneos A y O, y los menores con B y AB. En el grupo O solo se observó inhibición con los disacáridos lactosa y sacarosa, pero la especificidad por estos fue alta. Estos mismos sacáridos fueron los únicos que ocasionaron la inhibición en todos los grupos sanguíneos sin excepción, siendo la sacarosa la de mejores valores de concentración mínima inhibitoria.
Tabla 2
Resultados de la prueba de especificidad con mono- y disacáridos de la fracción del 40% del extracto de Stevensia grandiflora. Unidades presentan la concentración mínima inhibitoria del sacárido en molaridad (M). NI: No inhibe
Sacárido |
Tipo sanguíneo |
|||
A |
B |
AB |
O |
|
L-fucosa |
0.025 |
0.1 |
0.05 |
NI |
D-glucosa |
0.025 |
0.2 |
0.05 |
NI |
α-D-lactosa |
0.025 |
0.05 |
0.2 |
0.0125 |
D-fructosa |
0.2 |
NI |
0.2 |
NI |
D-manosa |
0.05 |
0.1 |
0.2 |
NI |
Metil-α-D-manopiranósido |
0.05 |
0.1 |
NI |
NI |
D-galactosa |
0.05 |
NI |
NI |
NI |
N-acetil-D-glucosamina |
0.0125 |
0.05 |
NI |
NI |
N-acetil-D-galactosamina |
NI |
0.1 |
0.05 |
NI |
Ácido N-acetilneuramínico |
NI |
NI |
NI |
NI |
D-sacarosa |
0.0125 |
0.2 |
0.025 |
0.025 |
Electroforesis SDS-PAGE
En la electroforesis SDS-PAGE de los extractos de hojas de S. grandiflora (Figura 2) se observaron cuatro zonas principales con bandas. La primera de estas, que posee dos, estuvo presente en todas las muestras estudiadas (extracto crudo, fracciones y sobrenadantes).
Figura 2
Resultados obtenidos para la electroforesis SDS-PAGE en muestras de Stevensia grandiflora. A) extracto crudo, B) fracción del 40%, C) sobrenadante del 40%, D) fracción del 60%, E) sobrenadante del 60%
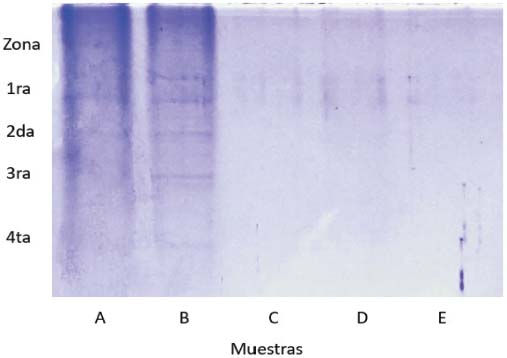
En la segunda, tercera y cuarta zona, se observaron bandas definidas para la fracción del 40% (Muestra B), pero difusas para el extracto crudo (Muestra A). Por otro lado, en la fracción del 60% y en los sobrenadantes de las respectivas fracciones, sólo se observaron bandas débiles en la primera zona, que corresponden a proteínas de alto peso molecular.
Contenido de compuestos fenólicos y carbohidratos totales
Se observó un aumento en el contenido de compuestos fenólicos totales en la fracción del 40% de hojas de S. grandiflora, con respecto al extracto crudo. Por otro lado, se detectó un mayor contenido de carbohidratos totales en el extracto crudo de esta misma planta, en comparación con la fracción del 40% (Tabla 3).
Tabla 3
Contenido de compuestos fenólicos y carbohidratos totales del extracto crudo y fracción al 40% de S. grandiflora
|
Compuestos fenólicos totales (unidades en mM) |
Carbohidratos totales (unidades en µg/mL) |
Extracto crudo |
4.65 |
9044 |
Fracción 40% |
6.97 |
5017 |
Discusión
En los resultados se obtuvo iguales niveles de aglutinación por parte del extracto de hojas de S. grandiflora para todos los grupos sanguíneos. Esto también ha sido observado por Adenike y Eretan (2003) en el extracto de hojas de Kalanchoe crenata. El hecho podría indicar la presencia de una lectina compleja dentro de la categoría de lectinas no específicas (Watkins et al., 1981). La aglutinación en diferentes grados en los grupos sanguíneos humanos fue observada por Dos Santos (2003) para la rubiácea Guettarda platypoda, así como por Naik y Kumar (2020) para el extracto de semillas de la fabácea Entada rheedi. Estas diferencias sugieren la presencia de más de una lectina (Van Damme et al., 1995).
Con respecto a las dos fracciones elaboradas para las hojas de S. grandiflora (40% y 60%), observamos aglutinación sanguínea y de levadura en la fracción del 40%. Un resultado similar fue observado en la investigación de Naik y Kumar (2020) quienes sólo determinaron aglutinación en la fracción del 40%. Esto puede estar relacionado con el peso molecular de la lectina en cuestión, ya que las proteínas de bajo peso molecular requieren una mayor concentración de sal para la precipitación que las de mayor peso molecular (Wingfield, 1998). Por ejemplo, los complejos multiproteicos grandes pueden precipitar con menos de un 20% de saturación con sulfato de amonio (Wingfield, 1998). Proteínas como la IgG del suero sanguíneo precipitan con una saturación de entre 40% y 45% con sulfato de amonio, mientras que la interleucina-1β necesita valores mucho más altos que estos para precipitar (Wingfield, 1998).
En comparación a otros estudios de rubiáceas, nuestros valores de hemaglutinación para la muestra fraccionada son mayores que los obtenidos por Dos Santos (2003) en el extracto de hojas de G. platypoda, y similares a los obtenidos en otros tejidos de esta misma planta. Cabe resaltar que G. platypoda es hasta ahora la única planta reportada en caracterización de lectinas en la subfamilia de rubiáceas Cinchonoideae, misma a la que pertenecen todas nuestras plantas muestreadas. Sin embargo, dentro de esta subfamilia, Cubanola domingensis y Exostema acuminatum, que no mostraron presencia de lectinas en los tejidos analizados, pertenecen ambas a la tribu Chiococceae, mientras que S. grandiflora y G. platypoda pertenecen a la tribu Rondeletieae y Guettardeae respectivamente.
Por otro lado, nuestros valores de hemaglutinación son mayores que los de Nova et al. (2020) para el extracto crudo de hojas de la rubiácea Mussaenda alicia (subfamilia Ixoroideae, tribu Mussaendeae). Sin embargo, fueron menores a los reportados por Bezerra et al. (2018) en la rubiácea Genipa americana (subfamilia Ixoroideae, tribu Gardenieae) tanto en el extracto crudo como en la fracción, pero estos valores fueron reportados únicamente para eritrocitos de conejo y no en humanos.
En aglutinación de levaduras, los valores obtenidos indicaron una afinidad débil de la lectina hacia los complejos de manosa y una posible mayor especificidad hacia otros sacáridos. Precisamente, en el estudio de Regente et al. (2014), se observó gran especificidad hacia las manoproteínas de la levadura S. cerevisiae, por parte de una lectina aislada de la semilla del girasol. Su efecto inhibitorio fue mayor que con los demás sacáridos evaluados.
No observamos pérdida significativa de la actividad hemaglutinante en las muestras calentadas, pero cabe destacar que la resistencia térmica es muy común en las lectinas vegetales. Esta puede deberse al alto peso molecular de las lectinas y a la presencia de enlaces disulfuro, que aumentan la estabilidad de la proteína (Bezerra et al., 2018; Torres et al., 2019). Sin embargo, sólo evaluamos las temperaturas ambiente y 100°C (por 10 min); es posible que a mayores temperaturas o tiempo de exposición pueda verse un efecto significativo. Por ejemplo, en Bezerra et al. (2018) la pérdida total de la actividad hemaglutinante del extracto de corteza se observó a partir de los 119.9°C durante 60 min.
En otros estudios, se ha observado la pérdida de la actividad total de las lectinas provenientes de extractos de hojas luego de los 90°C por 30 min (Adenike y Eretan, 2003), pero también de extractos de semillas luego de calentar durante sólo 5 min a 80°C (Nanne-Echandi, 1998). Conocer estos rangos de tiempos de exposición y temperaturas, en los que trabaja una lectina específica, es importante para establecer sus usos en biomedicina y procesos industriales (Alarcón-Aparicio, 2005; Bezerra et al., 2018).
Con respecto a la prueba de inhibición, la alta especificidad hacia el disacárido sacarosa ya se ha observado dentro de la tribu de rubiáceas Chiococceae en la tesis de Dos Santos (2003) para todos los grupos sanguíneos. La alta especificidad hacia la lactosa en lectinas de rubiáceas también fue detectada en el estudio de Bezerra et al. (2018) en sangre de conejo, así como una menor especificidad por glucosa y fucosa. Por otro lado, en las hojas de rubiáceas ya se ha reportado una lectina con especificidad múltiple hacia varios sacáridos (Nova et al., 2020), lo cual coincide con nuestra investigación con relación a la fructosa, fucosa, lactosa, glucosa, N-acetilglucosamina y N-acetilgalactosamina. En ninguno de los estudios en rubiáceas consultados se presentaron los resultados en términos de concentración mínima inhibitoria. Sin embargo, los valores presentados en la Tabla 2 son similares a los del estudio de Oliveira et al. (2017) en algas Spirogyra spp. y a los de Sarkar et al. (2007) en las semillas de calabaza Cucurbita máxima.
Estos resultados de especificidad con sacáridos pueden dar un indicio sobre los posibles dominios de lectinas presentes en los extractos proteicos de S. grandiflora. Dado los múltiples sacáridos ligando que posee el dominio de lectinas de leguminosas (manosa, glucosa, galactosa, N-acetil-glucosamina, N-acetil-galactosamina, fucosa, ácido siálico y complejos o N-glicanos altos en manosa) se plantea la posibilidad de la presencia de uno o más de este dominio en las lectinas detectadas en S. grandiflora. Precisamente, en el estudio de Coelho et al., 2010 en las rubiáceas Coffea arabica y C. racemosa, se han caracterizado cuatro lectinas con este mismo dominio. Por otro lado, la presencia de azúcares en la fracción del 40% del extracto de hojas de S. grandiflora, detectados por el método del fenol - ácido sulfúrico, sugiere la naturaleza glicoproteica de las lectinas detectadas (Coelho et al., 2010; Sarkar et al., 2019).
En la electroforesis SDS-PAGE se detectaron proteínas en común presentes tanto en el extracto crudo como en fracciones y sobrenadantes de la muestra de hojas de S. grandiflora, que indican proteínas de alto peso molecular por ser las de menor desplazamiento. Ya que solo se detectó actividad aglutinante en el extracto crudo de hojas y su respectiva fracción del 40%, se presume que las posibles lectinas corresponden a algunas de las bandas presentes en la segunda, tercera o cuarta zona (ver Figura 2).
La presencia de dos bandas en la segunda y tercera zona de la fracción al 40% (Muestra B) puede corresponder a proteínas diméricas con subunidades de peso molecular similar. Las lectinas diméricas con esta característica ya se han aislado en rubiáceas como G. americana (Bezerra et al., 2018) y G. platypoda (Dos Santos, 2003). Con respecto a la cuarta zona, solo se observó una banda débil, que puede corresponder a una proteína monomérica de peso molecular mucho más bajo, lo cual coincide con las lectinas monoméricas encontradas en la rubiácea C. racemosa (Coelho et al., 2010). Cabe destacar también que, en los extractos de semillas de C. arabica, Coelho et al. (2010) detectaron una lectina monomérica y otra dimérica, lo que deja abierta la posibilidad de la presencia de más de una lectina. Para la correcta identificación de lectinas vegetales en geles de electroforesis, estudios como los de Nanne-Echandi (1998), Adenike y Eretan (2003), Torres et al. (2019) y Naik y Kumar (2020) utilizaron el reactivo de Schiff específico para glicoproteínas, el cual se recomienda para estudios posteriores.
Otros aspectos para tomar en cuenta en este tipo de investigaciones son los factores que afectan la detección de lectinas mediante pruebas de aglutinación. En primer lugar, los polifenoles de los tejidos vegetales pueden formar complejos con las proteínas, interfiriendo con su actividad biológica, hecho que ocurre por la oxidación de estos compuestos a causa de las polifenoloxidasas (Jakobek, 2015). Nuestra medición de los compuestos fenólicos totales tanto en el extracto crudo como en la fracción del 40% exponen una posible causa de la reducción del nivel de aglutinación en la fracción, en la cual se concentraron más los fenoles. El aumento del contenido de fenoles en la fracción proteica, con respecto al extracto crudo, fue observado también en el estudio de Bezerra et al. (2018) con los extractos de corteza de la rubiácea G. americana. Estudios como los de Hidalgo (2017) y Vega y Pérez (2006) incorporaron tiourea en los extractos para evitar este suceso. Por ello, se recomienda el uso de tiourea en estudios posteriores antes de la realización de procesos de purificación de lectinas.
Otro factor que puede afectar la detección de lectinas es que no todas tienen la capacidad de aglutinar células. Existen complejos de sacáridos que no abundan en las membranas o paredes celulares, haciendo que las lectinas no sean siempre detectadas (Torres et al., 2019). Además, en diferentes tejidos de una misma planta pueden o no existir las mismas lectinas (McPherson et al., 1987), por lo que no se puede asegurar la ausencia total de lectinas en las semillas de S. grandiflora. Por eso, antes de descartar especies sin actividad de lectinas, puede que sea necesario realizar varios análisis a nivel molecular de las proteínas aisladas. Esto con el objetivo de identificar al menos un dominio de unión a carbohidratos, que no necesariamente aglutine células, pero que por exigencia no posea propiedades catalíticas (Tsaneva y Van Damme, 2020).
Conclusiones
Se detectó al menos una posible lectina en las hojas de S. grandiflora, rubiácea endémica de la República Dominicana perteneciente a la subfamilia Cinchonoideae, tribu Rondeletieae. La lectina detectada mostró una fuerte actividad hemaglutinante frente a todos los grupos sanguíneos humanos por igual, y un leve efecto aglutinante en la levadura S. cerevisiae. La lectina mostró ser resistente a las altas temperaturas (100°C) y tener una alta especificidad hacia los disacáridos sacarosa y lactosa. La lectina también presentó afinidad por todos los monosacáridos evaluados, con excepción del ácido gálico, y se presume la posible presencia de un dominio proteico de la familia de las leguminosas en su estructura. Las hojas de S. grandiflora podrían contener una lectina monomérica o dimérica (o ambas) con subunidades de pesos moleculares ligeros, pero que no necesitan concentraciones de sal mayores del 40% para ser precipitadas. Por otro lado, se estableció la posible naturaleza glicoproteica de la(s) lectina(s) detectada(s).
Agradecimientos
Agradecemos al Jardín Botánico Dr. Rafael M. Moscoso por donarnos el material vegetal de las tres especies endémicas utilizadas para este estudio. Al banco de sangre del Laboratorio Clínico de Referencia, por donarnos las suspensiones de eritrocitos. Así mismo, a los laboratorios de biotecnología-genética y biología del Área de Ciencias Básicas y Ambientales y al laboratorio de bioquímica del Área de Ciencias de la Salud del INTEC, por proveer el espacio, los equipos y algunos de los reactivos que empleamos.
Referencias
Adenike, K., y Eretan, O. B. (2003). Purification and partial characterization of a lectin from the fresh leaves of Kalanchoe crenata (Andr.) Haw. BMB Reports, 37(2), 229-233.
Alarcón-Aparicio, E. (2005). Obtención y caracterización de las propiedades biofuncionales de lectinas de mango (Mangífera índica cv, manila) [Tesis de maestría, Universidad Veracruzana]. https://cdigital.uv.mx/bitstream/handle/123456789/46775/AlarconAparicioEdna.pdf?sequence=2&isAllowed=y
Asseleih, L. C., Plumbley, R. A., y Hylands, P. J. (1989). Purification and partial characterization of a hemagglutinin from seeds of Jatropha curcas. Journal of Food Biochemistry, 13(1), 1-20. https://doi.org/10.1111/j.1745-4514.1989.tb00381.x
Ayouba, A., Causse, H., Van Damme, E. J. M., Peumans, W. J., Bourne, Y., Cambillau, C., y Rougé, P. (1994). Interactions of plant lectins with the components of the bacterial cell wall peptidoglycan. Biochemical Systematics and Ecology, 22(2), 153–159. https://doi.org/10.1016/0305-1978(94)90005-1
Bezerra, R., Targon, P., Chambergo, F., Napoleão, T., Guedes, P., y Vieira, H. et al. (2018). Purification and characterization of a lectin with refolding ability from Genipa americana bark. International Journal of Biological Macromolecules, 119, 517-523. https://doi.org/10.1016/j.ijbiomac.2018.07.178
Bradford, M. M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 72(1–2), 248–254. https://doi.org/10.1016/0003-2697(76)90527-3
Büker, E., y Saraçoğlu, I. (2021). Antiviral Potential of Medicinal Plants and Plant Lectins: Use in COVID-19 Pandemic Era. Journal of Pharmaceutical Research International, 289-299. https://doi.org/10.9734/jpri/2021/v33i28a31535
Chen, L., y Li, F. (2013). Structural analysis of the evolutionary origins of influenza virus hemagglutinin and other viral lectins. Journal of Virology, 87(7), 4118–4120. https://doi.org/10.1128/jvi.03476-12
Coelho, M., Macedo, M., Marangoni, S., Silva, D., Cesarino, I., y Mazzafera, P. (2010). Purification of Legumin-Like Proteins from Coffea arabica and Coffea racemosa Seeds and Their Insecticidal Properties toward Cowpea weevil (Callosobruchus maculatus) (Coleoptera: Bruchidae). Journal of Agricultural and Food Chemistry, 58(5), 3050-3055. https://doi.org/10.1021/jf9037216
Dang, L. y Van Damme, E. (2015). Toxic proteins in plants. Phytochemistry, 117, 51-64. https://doi.org/10.1016/j.phytochem.2015.05.020
De Coninck, T., y Van Damme, E. (2021). Review: The multiple roles of plant lectins. Plant Science, 313, 111096. https://doi.org/10.1016/j.plantsci.2021.111096
Dias, R., Machado, L., Migliolo, L., y Franco, O. (2015). Insights into Animal and Plant Lectins with Antimicrobial Activities. Molecules, 20(1), 519-541. https://doi.org/10.3390/molecules20010519
Dos Santos, V. B. (2003). Purificação parcial de uma lectina da raiz de Guettarda platypoda [Tesis de maestría, Universidad Federal de Pernambuco]. https://repositorio.ufpe.br/handle/123456789/1894
Gray, A., y Flatt, P. (1999). Insulin-secreting activity of the traditional Antidiabetic Plant Viscum album (Mistletoe). Journal of Endocrinology, 160(3), 409–414. https://doi.org/10.1677/joe.0.1600409
Hamid, R., Masood, A., Wani, I.H., y Rafiq, S. (2013). Lectins: proteins with diverse applications. Journal of Applied Pharmaceutical Science, 3(4), 93–103.
Hidalgo, D. J. (2017). Detección, purificación y caracterización parcial de lectinas presentes en algas marinas colombianas [Tesis de maestría, Universidad Nacional de Colombia]. https://repositorio.unal.edu.co/handle/unal/62217
Jakobek, L. (2015). Interactions of polyphenols with carbohydrates, lipids and proteins. Food Chemistry, 175, 556–567. https://doi.org/10.1016/j.foodchem.2014.12.013
Laemmli, U. K. (1970). Cleavage of structural proteins during the Assembly of the head of bacteriophage T4. Nature, 227(5259), 680–685. https://doi.org/10.1038/227680a0
Lagarda-Diaz, I., Guzman-Partida, A., y Vazquez-Moreno, L. (2017). Legume lectins: Proteins with diverse applications. International Journal of Molecular Sciences, 18(6), 1242. https://doi.org/10.3390/ijms18061242
Liogier, A. H. (1995). La Flora de la Española VII. Universidad Central del Este (UCE) Vol. LXXI Serie Científica 28. Santo Domingo, República Dominicana. Editora Taller C. por A. pp. 207-491.
Liogier, A. H. (2009). Flora de la Española Suplemento. Jardín Botánico Nacional Dr. Rafael MA. Moscoso. Santo Domingo, República Dominicana. pp. 138-151.
Loh, S., Park, J., Cho, E., Nah, S. y Kang, Y., (2017). Animal lectins: potential receptors for ginseng polysaccharides. Journal of Ginseng Research, 41(1), pp.1-9.
López-Hidalgo, C., Meijón, M., Lamelas, L., y Valledor, L. (2021). The rainbow protocol: A sequential method for quantifying pigments, sugars, free amino acids, phenolics, flavonoids and MDA from a small amount of sample. Plant, Cell & Environment, 44(6), 1977–1986. https://doi.org/10.1111/pce.14007
Mauliku, N. (2021). The Anti-tubercular Activity of Noni Fruitsto Inhibition Growth of Multi Drug Resistant-Tuberculosis Bacteria. Kne Life Sciences, 979-990. https://doi.org/10.18502/kls.v6i1.8774
McPherson, A., Hankins, C. N., y Shannon, L. (1987). Preliminary X-ray diffraction analysis of crystalline lectins from the seeds and leaves of Sophora japonica. Journal of Biological Chemistry, 262(4), 1791–1794. https://doi.org/10.1016/s0021-9258(19)75708-1
Mirelman, D., Altmann, G., y Eshdat, Y. (1980). Screening of bacterial isolates for mannose-specific lectin activity by agglutination of yeasts. Journal of clinical microbiology, 11(4), 328-331.
Mishra, A., Behura, A., Mawatwal, S., Kumar, A., Naik, L., Mohanty, S. S., Manna, D., Dokania, P., Mishra, A., Patra, S. K., y Dhiman, R. (2019). Structure-function and application of plant lectins in Disease Biology and immunity. Food and Chemical Toxicology, 134, 110827. https://doi.org/10.1016/j.fct.2019.110827
Moonens, K., y Remaut, H. (2017). Evolution and structural dynamics of bacterial glycan binding adhesins. Current Opinion in Structural Biology, 44, 48-58. https://doi.org/10.1016/j.sbi.2016.12.003
Naik, S., y Kumar, S. (2020). Biochemical characterization of lactose binding Entadin lectin from Entada rheedii seeds with cytotoxic activity against cancer cell lines. ACS Omega, 5(27), 16430–16439. https://doi.org/10.1021/acsomega.0c00577
Naithani, S., Komath, S., Nonomura, A., y Govindjee, G. (2021). Plant lectins and their many roles: Carbohydrate-binding and beyond. Journal of Plant Physiology, 266, 153531. https://doi.org/10.1016/j.jplph.2021.153531
Nanne-Echandi, C. I. (1998). Aislamiento, purificación y caracterización de una lectina de la semilla del poro (Erythrina costaricensis) [Tesis de maestría, Universidad de Costa Rica]. http://repo.sibdi.ucr.ac.cr:8080/jspui/bitstream/123456789/2032/1/11201.pdf
Nielsen, S. S. (2009). Phenol-sulfuric acid method for total carbohydrates. Food Analysis Laboratory Manual, 47–53. https://doi.org/10.1007/978-1-4419-1463-7_6
Nova, I., Silva, P., Almeida, W., Silva, T., Camaroti, J., y Silva, P. et al. (2020). Atividade antimicrobiana da lectina de folhas de Mussaenda alicia (Rubiaceae). Pesquisa Científica E Tecnológica Em Microbiologia 2, 9-19. https://doi.org/10.22533/at.ed.3942022012
Oggero, M., y Forno, G. (2021). Glicoproteínas terapéuticas: diseño, expresión en células de mamífero y análisis de sus glicanos. https://hdl.handle.net/11185/6277
Oliveira, A. S., Lossio, C. F., Rangel, A. J., Martins, M. G. Q., Nascimento, F. E. P., Andrade, M. L. L., Cavada, B. S., Lacerda, S. R., y Nascimento, K. S. (2017). Detection, purification and characterization of a lectin from freshwater green algae Spirogyra spp. Anais Da Academia Brasileira de Ciências, 89(3), 2113–2117. https://doi.org/10.1590/0001-3765201720160150
Oliveira, C., Nicolau, A., Teixeira, J. A., y Domingues, L. (2011). Cytotoxic effects of native and recombinant Frutalin, a plant galactose-binding lectin, on Hela cervical cancer cells. Journal of Biomedicine and Biotechnology, 2011, 1–9. https://doi.org/10.1155/2011/568932
Regente, M., Taveira, G. B., Pinedo, M., Elizalde, M. M., Ticchi, A. J., Diz, M. S., Carvalho, A. O., de la Canal, L., y Gomes, V. M. (2014). A sunflower lectin with antifungal properties and putative medical mycology applications. Current Microbiology, 69(1), 88–95. https://doi.org/10.1007/s00284-014-0558-z
Reyes-Pool, H. P., (2008). Identificación y caracterización de la actividad biológica de lectinas aisladas de dos variedades de mango (Mangífera indica L) [Tesis de maestría, Universidad Veracruzana]. https://cdigital.uv.mx/bitstream/handle/123456789/46981/ReyesPoolHectorRaul.pdf?sequence=1
Rocha, A. A., Araújo, T. F., Fonseca, C. S., Mota, D. L., Medeiros, P. L., Paiva, P. M., Coelho, L. C., Correia, M. T., y Lima, V. L. (2013). Lectin from Crataeva tapia bark improves tissue damages and plasma hyperglycemia in alloxan-induced diabetic mice. Evidence-Based Complementary and Alternative Medicine, 2013, 1–9. https://doi.org/10.1155/2013/869305
Sano, K., y Ogawa, H. (2014). Hemagglutination (inhibition) assay. Methods in Molecular Biology, 1200, 47–52. https://doi.org/10.1007/978-1-4939-1292-6_4
Sarkar, S. K., Ali, S., Qurashi, D. H., Biswas, M. A. A., y Barman, D. N. (2019). Isolation, Partial Purification and Characterization of Lectin from Mahogany (Swietenia mahogany) Seed Kernel. Journal of Noakhali Science and Technology University, 3, 1.
Sarkar, S. K., Hossain, M. T., Uddin, M. B., y Absar, N. (2007). Purification, characterization and physico-chemical properties of three galactose-specific lectins from pumpkin (Cucurbita maxima) seed kernels. Journal of the Chinese Chemical Society, 54(6), 1433–1442. https://doi.org/10.1002/jccs.200700203
Sawant, S. S., Randive, V. R., y Kulkarni, S. R. (2017). Lectins from seeds of Abrus precatorius: evaluation of antidiabetic and antihyperlipidemic potential in diabetic rats. Asian Journal of Pharmaceutical Research, 7(2), 71. https://doi.org/10.5958/2231-5691.2017.00013.2
Scopes, R. K. (1988). Protein purification principles and practice (3ra ed.). Springer.
Torres, M., Brandão-Costa, R., Santos, J., Cavalcanti, I., Silva, M., y Nascimento, T. et al. (2019). DdeL, a novel thermostable lectin from Dypsis decaryi seeds: Biological properties. Process Biochemistry, 86, 169-176. https://doi.org/10.1016/j.procbio.2019.07.021
Tsaneva, M., y Van Damme, E. (2020). 130 years of Plant Lectin Research. Glycoconjugate Journal, 37(5), 533-551. https://doi.org/10.1007/s10719-020-09942-y
Van Damme, E. J., Barre, A., Bemer, V., Rougé, P., Van Leuven, F., y Peumans, W. J. (1995). A lectin and a lectin-related protein are the two most prominent proteins in the bark of yellow wood (Cladrastis lutea). Plant Molecular Biology, 29(3), 579–598. https://doi.org/10.1007/bf00020986
Varrot, A., Basheer, S. M., y Imberty, A. (2013). Fungal lectins: Structure, function and potential applications. Current Opinion in Structural Biology, 23(5), 678–685. https://doi.org/10.1016/j.sbi.2013.07.007
Vega, N., y Pérez, G. (2006). Isolation and characterisation of a Salvia bogotensis seed lectin specific for the TN antigen. Phytochemistry, 67(4), 347–355. https://doi.org/10.1016/j.phytochem.2005.11.028
Walski, T., Van Damme, E. J. M., y Smagghe, G. (2014). Penetration through the peritrophic matrix is a key to lectin toxicity against Tribolium castaneum. Journal of Insect Physiology, 70, 94–101. https://doi.org/10.1016/j.jinsphys.2014.09.004
Watkins, W. M., Yates, A. D., y Greenwell, P. (1981). Blood group antigens and the enzymes involved in their synthesis: Past and present. Biochemical Society Transactions, 9(3), 186–191. https://doi.org/10.1042/bst0090186
Wingfield, P. (1998). Protein precipitation using ammonium sulfate. Current Protocols in Protein Science. https://doi.org/10.1002/0471140864.psa03fs13
Yau, T., Dan, X., Ng, C., y Ng, T. (2015). Lectins with potential for anti-cancer therapy. Molecules, 20(3), 3791–3810. https://doi.org/10.3390/molecules20033791
_______________________________
1 Instituto Tecnológico de Santo Domingo (INTEC), República Dominicana. Correo-e: 1092655@est.intec.edu.do ORCID: 0009-0002-6224-8282
2 Instituto Tecnológico de Santo Domingo (INTEC), República Dominicana. Correo-e: luis.maroto@intec.edu.do ORCID: 0000-0001-8854-5512
3 Instituto Tecnológico de Santo Domingo (INTEC), República Dominicana. Correo-e: edian.franco@intec.edu.do ORCID: 0000-0001-9715-9437
4 Instituto Tecnológico de Santo Domingo (INTEC), República Dominicana. Correo-e: luis.defrancisco@intec.edu.do ORCID: 0000-0001-9146-8634
