Ciencia, Ambiente y Clima, Vol. 6, No. 2, julio-diciembre, 2023 ISSN (impreso): 2636-2317 • ISSN (en línea): 2636-2333 • Sitio web: https://revistas.intec.edu.do/
INVENTARIO DE LA MACROFLORA FÚNGICA EN LA COMUNIDAD DE SONADOR, PROVINCIA MONSEÑOR NOUEL, REPÚBLICA DOMINICANA
Inventory of fungal macroflora in the community of Sonador, Monseñor Nouel, Dominican Republic
DOI: https://doi.org/10.22206/cac.2023.v6i2.2849
TAMARA MARÍA MOLERO PAREDES1 Y YECIER NOLASCO2
1 Instituto Tecnológico de Santo Domingo (INTEC). Docente/Encargada del laboratorio de Biología. República Dominicana. ORCID: 0000-0003-4757-2455
Correo-e: tamara.molero@intec.edu.do
2 Colegio Adventista Dominicano (CAD). República Dominicana. ORCID: 0009-0007-0636-2925
Recibido: 2/06/2023 • Aprobado: 22/12/2023
Cómo citar: Molero Paredes, T. M. y Nolasco, Y. (2023). Inventario de la macroflora fúngica en la comunidad de Sonador, provincia Monseñor Nouel, República Dominicana. Ciencia, Ambiente y Clima, 6(2), 103-131. https://doi.org/10.22206/cac.2023.v6i2.2849
Resumen
La diversidad de hongos que pueblan la tierra es amplia, sin embargo, aún existen hábitats no estudiados micológicamente como es el caso de la localidad de Sonador, Provincia Monseñor Nouel en República Dominicana. El objetivo de este trabajo fue realizar un inventario de la macroflora fúngica presente en esta zona. La exploración fue de 3 años y se empleó un muestreo oportunístico, seleccionando cuerpos fructíferos completos con 2 cm de longitud. Se contó el número de individuos, se determinó sus características y se tomaron muestras para ser almacenadas en formaldehido al 4%. La identificación taxonómica se realizó de acuerdo con los descriptores para los hongos de República Dominicana. Se estudiaron 1034 macrohongos, pertenecientes a 66 especies, 57 determinadas a nivel de especie y 9 a nivel de género, distribuidas en 50 géneros, 30 familias y 13 órdenes. El 9,1% pertenecen a la división Ascomycota y el 90,9% son basidiomicetes. Las familias que se presentaron con más frecuencia fueron Polyporaceae y Agaricaceae pertenecientes a los órdenes Polyporales y Agaricales respectivamente. Todas las especies son nuevos reportes para la provincia Monseñor Nouel. Amanita spp., (1), Amanita spp., (2), Geastrum spp., Marasmiellus spp., Phellodon spp., Pleurotus spp., Calocera cornea, Pleurocybella porrigens, Pleurotus pulmonarius y Trametes gibbosa son nuevos géneros y especies para el país.
Palabras clave: macrohongos, República Dominicana, inventario, Monseñor Nouel, Bonao.
Abstract
The diversity of fungi that populate the earth is wide, however, there are still habitats that have not been studied mycologically, as is the case of the locality of Sonador, Monseñor Nouel Province in the Dominican Republic. The objective of this work was to make an inventory of the fungal macroflora present in this area. The exploration period was 3 years and an opportunistic sampling was used, selecting complete fruiting bodies with 2 cm of length. The number of individuals was counted, their characteristics were determined, and samples were taken to be stored in 4% formaldehyde. Taxonomic identification was carried out according to the descriptors for fungi of the Dominican Republic. A total of 1034 macrofungi were studied, belonging to 66 species, 57 determined at the species level and 9 at the genus level, distributed in 50 genera, 30 families and 13 orders. The 9.1% belong to the Ascomycota division and 90.9% are basidiomycetes. The most frequently occurring families were Polyporaceae and Agaricaceae belonging to the orders Polyporales and Agaricales, respectively. All species are new reports for Monseñor Nouel province. Amanita spp., (1), Amanita spp., (2), Geastrum spp., Marasmiellus spp., Phellodon spp., Pleurotus spp., Calocera cornea, Pleurocybella porrigens, Pleurotus pulmonarius and Trametes gibbosa are new genera and species for the country.
Keywords: large mushrooms, Dominican Republic, inventory, Monseñor Nouel, Bonao.
Introducción
La presencia de los hongos es de vital importancia para el funcionamiento de los ecosistemas, debido a que estos organismos son capaces de transformar la materia orgánica en inorgánica, razón por la cual se consideran microconsumidores y por lo tanto aprovechan la energía de otros organismos. Las características peculiares de los hongos, su cantidad y principalmente su amplia diversidad en el planeta, ha hecho necesario ubicarlos taxonómicamente en un reino separado, el reino Fungi.
Los organismos de este reino establecen relaciones simbióticas, mutualistas y parasíticas con otras especies. Alcántara (2010) expresa que, las plantas vasculares pueden resultar beneficiadas al establecer interacciones con los hongos, cuando estos organismos les proveen agua en tiempo de sequía o le aportan nutrientes. También desempeñan un papel importante en la estructura y composición de un ecosistema, cumpliendo funciones de tipo ecológico y fisiológico; además pueden ser mediadores e integradores, ya que contribuyen al desarrollo de las poblaciones vegetales, en especial de las especies arbóreas. Aunado a esto, Cappello et al., (2006), indican que intervienen en la transferencia de nutrientes, participan de manera activa en la regulación de la tasa fotosintética, presentan una gran fuente de alimentos para algunos vertebrados e invertebrados, participan en creación y alteración de nichos (sobre todo para invertebrados), y establecen asociaciones mutualistas con plantas, termitas, hormigas y con algunas especies de algas. Los hongos pueden observarse creciendo en troncos, pequeñas ramas, hojarasca, suelo, estiércol de diversos animales y otros sustratos.
Dentro de este reino se encuentran organismos microscópicos (levaduras, mohos, entre otros) y organismos macroscópicos (hongos de sombrero, de ascas, etc.) siendo estos últimos el objeto de estudio de la presente investigación. Estrada y Ramírez (2019) expresan que los hongos macromicetos están formados por una fructificación carnosa llamada píleo (sombrero), unido por su parte central al ápice de un estipe (o tallo) bien diferenciado. Este tallo se une a un micelio compuesto por filamentos denominados hifas. En el sombrero o seta del cuerpo fructífero se localizan los esporangios que segregan esporas para la reproducción sexual y asexual de estos organismos.
En el área del Caribe (también llamada las Antillas), que incluye las islas mayores y menores ubicadas desde la porción este de la Península de Yucatán hasta el extremo oriental del mar Caribe, se han realizado diversos estudios para conocer la diversidad fúngica de esta región del mundo. Guzmán (1986) indica que, en la zona del Caribe, prosperan hongos con carácter cosmopolita o pantropicales por presentar una amplia distribución, como son las especies de los géneros Geastrum, Panaeolus, Psilocybe, Polyporus y Schizophyllum. Minter et al., (2001) realizó una lista de 11268 especies de hongos que prosperan en las zonas del caribe incluyendo macro y microhongos, principalmente de Cuba, Islas Bahamas, las Antillas Menores y otros países de la región. Parra et al., (2018) Mendel-Ortiz et al. (2022) dieron su aporte sobre la diversidad del género Agaricus en el caribe y Ortiz et al., (2007) lo hacen con el orden Boletales en Belice y República Dominicana.
En los ecosistemas de República Dominicana, existe una diversidad fúngica que crecen en forma silvestre y que contribuyen a procesamiento de la materia orgánica, favorecen la diversidad de especies vegetales estableciendo relaciones simbióticas principalmente con briofitas, pteridofitas y malezas de ambientes húmedos con las cuales forma micorrizas que fortalecen la salud del sistema florístico de estas regiones tropicales. De igual manera, existen hongos que crecen parasíticamente sobre los troncos de árboles y sobre material vegetal muerto cumpliendo su función de descomponedores.
Pese al conocimiento que existe de grupos de hongos en pueblan varias áreas del país, sin embargo, existen numerosos lugares aún inexplorados (Sierra et al. 2011). Por ello, durante las últimas décadas se ha incrementado el número de investigaciones sobre la macroflora fúngica en la Isla la Española, principalmente en la región noroeste y en menor cantidad en las regiones noreste, sur-central y sur-este, donde se ha documentado la diversidad de macrohongos existentes, información que ha sido posible gracias a los aportes de autores como Cantrell et al. (2001), Perdomo (2007), Vizzini et al. (2012), Angelini y Losi (2016, 2021, 2023), Parra et al., (2018), Angelini (2022), Aquino et al. (2021), Jaime et al. (2021), entre otros. El compendio de estos y otros estudios presenta información valiosa del reino Fungí de la isla, incluyendo especies endémicas, nativas, comestibles, venenosas, patógenos, entre otros datos de interés científico.
Para el año 2010, el Ministerio de Medio Ambiente y Recursos Naturales (2020) informó que se habían identificado 1940 especies de hongos, dato que fue tomado de los aportes de Minter y Perdomo (2006). Sin embargo, estos mismos autores reportan 2809 micro y macrohongos en listas alfabéticas y taxonómicas distribuidos en las divisiones Oomycota, Ascomycota, Basidiomycota, Blastocladiomycota, Chytridiomycota, Glomeromycota y Zygomycota. Por su lado, Angelini (2022) brinda una listado de 460 especies de macromicetos divididos en 28 ascomicetes y 432 Basidiomicetes.
A raíz de sus trabajos, Minter y Perdomo (2006) y Angelini (2022) se publicaron en páginas website, bases de datos de los especímenes micológicos descubiertos en el país basándose, algunas de ellos, en investigaciones propias y otras de datos reportados por otros autores que incluye información suplementaria de colectores, identificadores, colecciones de referencia y bibliografía. Los criterios para la identificación y clasificación taxonómica de los ejemplares se fundamentaron en sus características morfológicas externas, estructuras microscópicas y estudios filogenéticos y moleculares. Por otro lado, Perdomo (2007) presenta una lista de los hongos comestibles en la República Dominicana, lo de demuestra uno de los muchos potenciales beneficiosos que pueden tener los hongos en la vida del resto de los seres vivos.
La mayoría de los datos sobre macromicetes en el país se han obtenido en las provincias de Puerto Plata, Espaillat, Monte Plata y el Distrito Nacional, y con menor frecuencia en la Vega, Altagracia, Bahoruco, entre otras. Con excepción de la Vega, pocas son las áreas exploradas de la cordillera central, pese a que esta zona presenta condiciones favorables para el desarrollo y reproducción de estos organismos. Como parte de la cordillera central se incluye la Provincia Monseñor Nouel, demarcación territorial que se divide en tres municipios los cuales son: Bonao, Maimón y Piedra Blanca, y estos a su vez, se distribuyen en siete distritos municipales: Jayaco, Arroyo Toro-Masipedro, Sabana del Puerto, Bejucal, La Salvia, Los Quemados, Juan Adrián y Sonador. Este último corresponde al área de estudio de la presente investigación ya que en la zona no se han realizado trabajos micológicos, por lo que, la demarcación constituye un terreno virgen e inexplorado con respecto a la macroflora fúngica del país. Los pocos datos micológicos documentados científicamente para la provincia Monseñor Nouel fueron realizados por Burt (1920), Toro (1927), Kern (1928), Ellis (1968) y Ciferri (1961). Luego de estas fechas no hay registros para la zona, aunque si los hay para la cordillera central.
Sin embargo, la singularidad de sus ecosistemas insulares y la existencia de zonas en el país que aún no han sido exploradas, podrían conducir a hallazgos científicos de especies fúngicas no observadas hasta los momentos. Esta idea es afirmada por el Ministerio de Medio Ambiente y Recursos Naturales (2020) cuando afirma que “la micoflora dominicana ha sido poco estudiada”.
Por lo tanto, esta investigación se realizó con la finalidad de realizar un inventario de la macroflora fúngica de la municipalidad de Sonador, Monseñor Nouel, República Dominicana y se espera que los resultados de esta investigación permitan ampliar el conocimiento científico sobre la diversidad y distribución de los macromicetes en el país.
Metodología
1. Zonas de estudio
El estudio se realizó en la comunidad de Sonador, extensión territorial de 53,2 Km2 perteneciente al Municipio Piedra Blanca, provincia Monseñor Nouel. Esta demarcación posee una zona de vida identificada como “bosque pluvial montano bajo” caracterizado por tener una pluviometría anual promedio de 1956 mm, una temperatura media anual de 25.7 °C y una altitud alrededor de los 700 msnm. Se presentan precipitaciones durante todo el año, incluso durante el mes más secos, pero en invierno la cantidad de lluvia es mayor que en verano que corresponde a los meses de octubre a abril (Ministerio del Ambiente, 2012).
Según la nueva clasificación el Ministerio de Medio Ambiente y Recursos Naturales (2020), la zona corresponde a un ecosistema “bosque latifoliado húmedo, semihúmedo y nublado”, exactamente en la clasificación de húmedo caracterizado por ser un bosque perennifolio o siempre verde, que se encuentra regularmente en elevaciones entre 500 y 2,000 msnm, con un rango pluviométrico de 1,500 a 2,000 mm y temperaturas que varían entre 20 y 25°C.
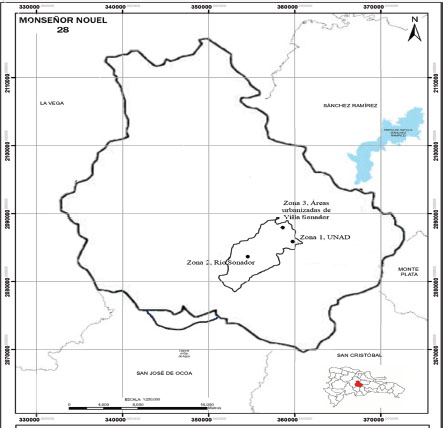
De esta comunidad se escogieron tres zonas de estudio: a saber: zona 1, correspondiente a la superficie de la Universidad Adventista Dominicana con un área de 152,903.39m² que responde a las coordenadas de 18°52'02.6"N 70°21'21.8"W; zona 2, que abarcaba las riberas (orillas) del rio Sonador con un área de 7,448.05m² y sus coordenadas son 18°49'32"N 70°23'35"W. Por último, la zona 3, que abarca el transepto que incluye las calles de zonas urbanizadas de Villa Sonador, cuya superficie fue de 38,813.23m² en las coordenadas: 18°52'26.4"N 70°21'43.9"W (Fig. 1).
Figura 1
Ubicación de las zonas de estudio en la comunidad de Sonador, Provincia Monseñor Nouel, República Dominicana
2. Colecta e identificación del material
La investigación se ejecutó entre los años 2019 al 2022 realizando dos muestreos mensuales durante los meses de verano y uno semanal en los meses de invierno. Se empleó el protocolo del muestreo oportunísimo, realizando una revisión exhaustiva de las zonas descritas y seleccionando los hongos que presentaban más de dos cm de longitud. En la colecta fue tomado el cuerpo fructífero completo del hongo, se contó el número de individuos presentes y se anotó y fotografió las características del material biológico en su entorno natural. Las muestras fueron almacenadas en frascos de vidrio con formaldehido al 4% para posterior identificación taxonómica. Para realizar este último paso, se empleó los descriptores botánicos para la identificación morfológica de los géneros y especies de las divisiones basidiomicetes y ascomicetes para República Dominicana propuestos por Angelini y Losi (2013a, 2013b, 2014, 2015, 2016, 2021, 2022, 2023). De igual manera se usó la guía práctica para la identificación de hongos propuesta por Ubillos (2020), bases de datos de Mycobank Database (https://www.mycobank.org/) y Global Biodiversity Information Facility (GBIF) (https://www.gbif.org/) y la ayuda de páginas de internet para la identificación de hongos en el país como Neotropical Fungi (https://www.neotropicalfungi.com/) y Hongos de la República Dominicana (http://www.cybertruffle.org.uk/dorefung/esp/index.htm). Los datos obtenidos fueron organizados y tabulados considerando la especie, división, orden, familia y número de individuos.
Resultados
Luego de realizar el recorrido por las zonas de estudio, la colecta y la identificación taxonómica de los especímenes, se registraron 66 especies de macrohongos, 57 determinadas a nivel de especie y 9 a nivel de género, distribuidas en 50 géneros, 30 familias y 13 órdenes. Los datos están organizados en Tabla 1.
Tabla 1
Especies y géneros de macrohongos en la comunidad de Sonador, Provincia Monseñor Nouel, República Dominicana
División |
Ordenes |
Familias |
Géneros |
Especies |
Hábitat/Tipo de alimentación |
Basidiomicota |
Agaricales |
Agaricaceae |
Agaricus |
Agaricus arvensis** |
Saprofítico |
Agaricus campestris* |
Saprofítico |
||||
Cyathus |
Cyathus poeppigii* |
Saprofítico |
|||
Leucocoprinus |
Leucocoprinus fragilissimus* |
Saprofítico |
|||
Chlorophyllum |
Chlorophyllum molybdites* (=Macrolepiota molybdites) |
Simbiótica |
|||
Morganella |
Morganella fuliginea* (=Lycoperdon fuligineum) |
Saprofítico |
|||
Omphalotaceae |
Gymnopus |
Gymnopus gibbosus* |
Saprofítico |
||
Marasmiellus |
Marasmiellus spp.*** |
Saprofítico |
|||
Marasmiaceae |
Marasmius |
Marasmius haematocephalus* |
Saprofítico |
||
Marasmius graminum** |
Saprofítico |
||||
Pleurocybella |
Pleurocybella porrigens*** |
Saprofítico |
|||
Bolbitiaceae |
Panaeolus |
Panaeolus antillarum* |
Saprofítico |
||
Pleurotaceae |
Pleurotus |
Pleurotus djamor* |
Saprofítico |
||
Pleurotus pulmonarius*** |
Saprofítico |
||||
Pleurotus spp.*** |
Saprofítico |
||||
Mycenaceae |
Mycena |
Mycena chlorophos* |
Saprofítico |
||
Mycena haematopus** |
Saprofítico |
||||
Roridomyces |
Roridomyces austrororidus* |
Saprofítico |
|||
Amanitaceae |
Amanita |
Amanita spp. (1)*** |
Saprofítico |
||
Amanita spp. (2)*** |
Saprofítico |
||||
Hymenogastraceae |
Galerina |
Galerina marginata** |
Saprofítico |
||
Psilocybe |
Psilocybe cubensis* |
Saprofítico |
|||
Gymnopilus |
Gymnopilus lepidotus* |
Saprofítico |
|||
Gymnopilus penetrans** |
Saprofítico |
||||
Pluteaceae |
Pluteus |
Pluteus cervinus** |
Saprofítico |
||
Schyzophyllaceae |
Schizophyllum |
Schizophyllum commune** |
Saprofítico |
||
Psathyrellaceae |
Coprinellus |
Coprinellus disseminatus* |
Saprofítico |
||
Coprinellus domesticus* |
Saprofítico |
||||
Coprinopsis |
Coprinopsis spp.* |
Saprofítico |
|||
|
Auriculariales |
Auriculareaceae |
Auricularia |
Auricularia auricula-judae* |
Saprofítico |
|
Auricularia cornea* |
Saprofítico |
|||
|
Auricularia polytricha* |
Saprofítico |
|||
|
Boletales |
Boletaceae |
Boletellus |
Boletellus ananas* |
Micorrizas |
|
Leccinum |
Leccinum spp. ** |
Micorrizas |
||
|
Sclerodermataceae |
Pisolithus |
Pisolithus arhizus* |
Saprofítico |
|
|
Dacrymycetales |
Dacrymycetaceae |
Calocera |
Calocera cornea*** |
Saprofítico |
|
Geastreales |
Geastraceae |
Geastrum |
Geastrum triplex* |
Saprofítico |
|
Geastrum spp.*** |
Saprofítico |
|||
|
Hymenochaetales |
Hymenochaetaceae |
Fomitiporia |
Fomitiporia spp.* |
Saprofítico |
|
Hymenochaete |
Hymenochaete damicornis* |
Saprofítico |
||
|
Phallales |
Phallaceae |
Clathrus |
Clathrus crispus* |
Saprofítico |
|
Phallus |
Phallus indusiatus* |
Saprofítico |
||
|
Polyporales |
Ganodermataceae |
Ganoderma |
Ganoderma applanatum** |
Saprofítico/Parasito |
|
Ganoderma coffeatum* |
Saprofítico/Parasito |
|||
|
Polyporaceae |
Hexagonia |
Hexagonia hydnoides* |
Saprofítico |
|
|
Lentinus |
Lentinus crinitus * |
Saprofítico |
||
|
Pseudofavolus |
Pseudofavolus miquelii* |
Saprofítico |
||
|
Pycnoporus |
Pycnoporus sanguineus (=Trametes sanguinea)** |
Saprofítico/Parasito |
||
|
Panus |
Pannus strigellus* |
Saprofítico |
||
|
Trametes |
Trametes gibbosa*** |
Saprofítico |
||
|
Trametes maxima** |
Saprofítico |
|||
|
Trametes versicolor ** |
Saprofítico |
|||
|
Trichaptum |
Trichaptum biforme** |
Saprofítico |
||
|
Sparassidaceae |
Sparassis |
Sparassis crispa** |
Micorriza |
|
|
Meruliaceae |
Irpex |
Irpex lacteus* |
Saprofítico |
|
|
Meripilaceae |
Rigidoporus |
Rigidoporus microporus** |
Saprofítico |
|
|
Russulales |
Stereaceae |
Stereum |
Stereum hirsutum* |
Saprofítico |
|
Thelephorales |
Bankeraceae |
Phellodon |
Phellodon spp*** |
Saprofítico |
|
Tremellales |
Tremellaceaea |
Tremella |
Tremella fuciformis** |
Saprofítico |
|
Tremella mesenterica* |
Saprofítico |
|||
Ascomicota |
Pezizales |
Sarcoscyphaceae |
Cookenia |
Cookeina sulcipes (=Cookenia speciosa)* |
Saprofítico |
Cookeina tricholoma* |
Saprofítico |
||||
Phillipsia |
Phillipsia domingensis** |
Saprofítico |
|||
Morchellaceae |
Morchella |
Morchella elata** |
Saprofítico |
||
Xylariales |
Xylariaceae |
Xylaria |
Xylaria cubensis* |
Saprofítico |
|
Hypoxylaceae |
Daldinia |
Daldinia concentrica* |
Saprofítico |
*** Primer reporte del género (o especie) para el país
** Reportado en la Cordillera Central y primer reporte para zona.
* Primer reporte para la zona.
De las 66 especies encontradas, 60 de ellas pertenecen a la división Basidiomycota que corresponde a un 90,9% y 6 a la división Ascomycota (9,1%). Dentro de la división Basidiomycota se encuentran los órdenes: Agaricales, Auriculariales, Boletales, Dacrymycetales, Geastreales, Hymenochaetales, Phallales, Polyporales, Russulales, Thelephorales y Tremellales, mientras que dentro de Ascomycota se registran los órdenes Pezizales y Xylariales. Los órdenes más abundantes son Agaricales (43,94%) y Polyporales (21,21%), ambos de la División Basidiomycota (Figura 2).
Figura 2
Porcentajes de frecuencia de los órdenes de macrohongos presentes en la comunidad de Sonador, Provincia Monseñor Nouel, República Dominicana
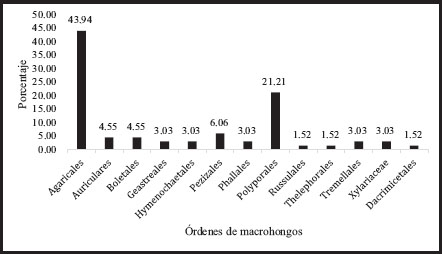
En el orden Agaricales se observó la mayor cantidad de familias, las cuales fueron: Agaricaceae, Omphalotaceae, Marasmiaceae, Bolbitiaceae, Pleurotaceae, Mycenaceae, Amanitaceae, Hymenogastraceae, Pluteaceae, Schyzophyllaceae y Psathyrellaceae. El órden Polyporales, quedó representado por las familias Ganodermataceae, Polyporaceae, Sparassidaceae, Meruliaceae y Meripilaceae. En excepción del orden Boletales, cuyas familias son Boletaceae y Sclerodermataceae, el resto de los órdenes de Basidiomicetes sólo presentaron una familia cada una, a saber, Auriculariales: Auriculareaceae, Dacrymycetales: Dacrymycetaceae, Geastreales: Geastraceae, Hymenochaetales: Hymenochaetaceae, Phallales: Phallaceae, Russulales: Stereaceae, Thelephorales: Bankeraceae y Tremellales:Tremellaceaea. En total se registraron 26 familias.
En el caso de los Ascomicetes, los órdenes quedaron representados de la siguiente manera: Pezizales por las familias Sarcoscyphaceae y Morchellaceae y el orden Xylariales con las familias Xylariaceae y Hypoxylaceae. En esta división se encontraron 4 familias, que sumándolas a las identificadas los órdenes basiodiomicetes se obtiene un total de 30 de macrohongos.
En las familias del orden Agaricales, se identificaron 29 especies, lo que representa más del 40% de las especies encontradas, sin embargo, la familia Poliporaceae del orden Polyporales fue la que concentró la mayor cantidad de especies en una misma familia pudiéndose identificar 9 especies distintas.
Con respecto a los géneros, se identificaron 50, de los cuales 5 (10%) pertenecen a la división ascomicota y 45 (90%) a la basidiomicota. Los géneros más frecuentes fueron: Auricularia (5,8%), Pleurotus (5,8%) y Trametes (4,4%). En la Figura 3 se muestran las fotos de los géneros y especies nuevas en el país encontrados en la zona.
Figura 3
Especies y géneros reportadas por primera vez para República Dominicana localizadas en la comunidad de Sonador, Provincia Monseñor Nouel

Amanita spp. (1)

Amanita spp. (2)

Calocera cornea (Batsch)

Geastrum spp.

Marasmiellus spp.

Phellodon spp.

Pleurocybella porrigens (Pers.)

Pleurotus pulmonarius (Fr.) Quél.

Pleurotus spp.

Trametes gibbosa (Pers.) Fr.
Discusión
Muchos de los pueblos que forman parte de la Provincia Monseñor Nouel limitan por el norte y el oeste con la Cordillera Central y son consideradas como las laderas de esta extensión montañosa. Desde el punto de vista micológico, algunas de estas regiones son vírgenes, al no existir información sobre la presencia y diversidad de hongos, como es el caso de la municipalidad de Sonador, por lo que los resultados de esta investigación constituyen datos completamente nuevos para la zona. De la diversidad encontrada sólo el 9,09% son ascomicetes. Esta prevalencia de hongos ascomicetes sobre los basiodiomicetes en República Dominicana ha sido reportada por otros autores (Angelini, 2022; Perdomo, 2007). Angelini y Medardi (2012) indican que los hongos ascomicetes parecen ser más comunes y numerosos en áreas antrópicas, cerca de ciudades o pueblos donde se cultivan árboles frutales o donde los residuos leñosos que yacen en el suelo son bastante abundantes, mientras que las áreas y reservas protegidas parecen ser desfavorables para los ascomicetos saprotróficos.
De las 66 especies identificadas, 18 de ellas habían sido reportadas para la Cordillera Central, anexándose ahora las 48 especies restantes como nuevos datos que enriquecen la biodiversidad de esta área del país. Las especies que habían sido documentadas son: Agaricus arvensis Schaeff, Ganoderma applanutum (Pers.) Pat., Marasmius graminum (Lib.) Berk, Morchella elata Pers, Mycena haematopus (Pers.) P. Kumm, Gymnopilus penetrans (Fr.) Murrill, Pluteus cervinus (Schaeff.) P. Kumm, Pycnoporus sanguineus (L.) Murrill, Rigidoporus microporus (Sw.) Overeem, Trametes versicolor (L.) Lloyd, Trichaptum biforme (Fr.) Ryvarden, Galerina marginata (Batsch) Kühner, Sparassis crispa (Wulfen) Fr., Trametes maxima (Mont.) A. David & Rajchenb, Leccinum spp., Phillipsia domingensis (Berk.) Berk. ex Denison, Tremella fuciformis Berk. y Schizophyllum commune Fr. (Ciferri, 1961; Hawksworth, 1995; Perdomo, 2001; Angelini y Medardi, 2012; Aquino et al., 2021; Angelini, 2022). Aquino et al. (2021) informa la presencia de otras especies en zonas correspondientes a la cordillera central, los cuales no fueron encontradas es esta investigación.
Por otro lado, 10 grupos identificados taxonómicamente son nuevos reportes para el país, 4 a nivel de especie y 6 a nivel de género. Estas especies son: dos del género Amanita, una de cada uno de los géneros Geastrum, Marasmiellus, Phellodon y Pleurotus, Calocera cornea (Batsch), Pleurocybella porrigens (Pers.), Pleurotus pulmonarius (Fr.) Quél. y Trametes gibbosa (Pers.) Fr.
Los especímenes del género Amanita encontrados en esta investigación poseen anillos, volva y laminas libres. Los sombreros son carnosos de colores claros, de beige a blanco, observándose en la parte superior de Amanita spp. (2) escamas o verrugas volvales claramente diferenciables. Muchas de las especies de Amanita son hongos mortales y otros muy tóxicos, aunque también engloba especies comestibles (UNAM, 2021). Su área de distribución se extiende desde el este de América del Norte hasta el sur de México y también se han encontrado en las plantaciones de pino en Colombia (Vargas et al., 2011).
Con respecto a los individuos del género Geastrum spp., se destacaron por ser globosos, cerrados, con piel muy gruesa y con brazos estrellados y arqueados hacia abajo, de color rosado. Cuando se abren, al madurar, se observan dentro de los brazos una masa esporular parduzca oscura que sale a través de un ostiolo situado en la parte superior (Ubillos, 2020). Son hongos fáciles de identificar puesto que la pared externa del peridio (exoperidio) se abre en lóbulos, pareciendo entonces una estrella que sostiene una bola. Por sus características podría corresponder a G. rufescens.
Las características del hongo perteneciente al género Marasmiellus spp. corresponden a un hongo de talla pequeña, de convexo se observa translúcido y con márgenes ondulados. Su sombrero del frágil y gelatinoso. La cutícula es lisa, brillante con humedad, acanalada radialmente mediante surcos bastante profundos. Es de color blanco crema y sus láminas están separadas, intervenadas, con pliegues muy marcados. Estas características corresponden a las descritas por Fernández (2023) para este género. Se ha documentado la presencia de este género en Puerto Rico, Estados Unidos, El Salvador, Colombia entre otros paises (GBIF, 2023).
Phellodon es un género de hongos de la familia Bankeraceae. Todas las especies tienen cuerpos fructíferos de tamaño pequeño a mediano que pueden fusionarse, produciendo grandes esteras. Sus píleos poseen espinas blancas (desde donde se liberan las esporas) y es duro, correoso, con superficie rugosa, hoyos y crestas. En los ejemplares estudiados se observan las características de este género, sin embargo, la coloración blanca difusa en el margen que se oscurece hacia el centro del sombrero tomando una coloración gris-negruzca hace pensar que pudiese estar en presencia de alguna de las especies descritas u otra nueva para la ciencia. Los individuos de este género han sido reportados en varios países de Asia, Europa, América del norte, central y sur, Australia y Nueva Zelanda (GBIF, 2023).
Los hongos del género Pleurotus poseen sombreros casi siempre carnosos de formas variables, de embudo, de ostra, redondas y generalmente con colores grises y pardos con láminas decurrentes, de colores blancos cremosos. El píe es igual de carnoso ya que son una misma unidad, absolutamente homogénea. La mayoría tienen un comportamiento lignícola (sobre madera) y algunas especies son de habitual cultivo, comercio y consumo. En este trabajo se identificaron a dos grupos de este género. El primer grupo de hongos presentaron sombreros entre 5 a 20 cm de diámetro, firme, algo duro en los ejemplares adultos y de olor agradable. La superficie era lisa y brillante con un color crema claro en los ejemplares jóvenes que se oscurecían a tonos gris desde el centro hacia los bordes a medida que eran más adultos, presentando márgenes enrollados en los individuos jóvenes y abierto en los adultos. Tenían láminas apretadas, delgadas, decurrentes y de color blanquecino y un pie casi imperceptible. El segundo grupo presentaron características que correspondían a Pleurotus pulmonarius, conocida como “ostra pulmonar”. Este es un hongo muy similar al anteriormente descrito, pero con algunas diferencias notables en su morfología ya que el sombrero de P. pulmonarius es mucho más blanco y pequeño y desarrollan un pie un poco más largo.
Calocera cornea Fr. también es denominada “calocera cornuda” y posee un cuerpo fructífero hasta de 4 cm de longitud, en forma cilíndrica, corniculada y gelatinoso, de color amarillo vivo o anaranjado. Su presencia en América, solo se ha reportado en estados Unidos (GBIF, 2023).
Pleurocybella porrigens, también llamada “ala de ángel”, posee un sombrero 2 a 8 de alto e igual de ancho, en forma irregular a modo de lengua; sus láminas son muy delgadas y apretadas, de color blanco que va cambiando a amarillo o naranja. La carne es delgada y frágil en comparación con los hongos ostra (Pleurotus ssp.). Aunque P. porrigens alguna vez se consideró como comestible (Miller et al., 2006) a partir de 2011, se ha detectado su toxicidad (Wakimoto et al., 2011). Su presencia es extraña en América, registrándose en el Salvador y México (GBIF, 2023).
Por su lado, Trametes gibbosa, es un hongo poliporoso que causa la podredumbre blanca. Sus cuerpos miden entre 8 y 15 cm de diámetro y tienen forma semicircular y aplanado presentando un color que suele ser gris a blanca, pero puede ser verdosa en individuos viejos debido al crecimiento de algas y otros microorganismos. Su textura es dura y coriácea. Su presencia en América sólo se ha reportado en Estados Unidos y Canadá (GBIF, 2023).
Con respecto al resto de las especies encontradas en este estudio, todas han sido reportadas en investigaciones anteriores para otras regiones del país (Angelini, 2022: Huhndorf, 1992; Perdomo et al., 2018)
Dentro de la micodiversidad encontrada en esta investigación, resaltan los órdenes Agaricales y Polyporales, por concentrar la mayor cantidad de especies (Figura 2). De hecho, Parra et al. (2018) presenta una larga lista de Agaricales en el país, donde se incluyen investigaciones realizadas por otros autores (Vizzini et al., 2012; Justo et al., 2015), a la cual hay que agregar reportes recientes (Baroni et al., 2020). En este estudio el mayor número de especies colectadas fue en el orden Agaricales y las familias que presentaron mayor frecuencia de especies fueron Agaricaceae, Marasmiaceae y Pleurotaceae.
Las publicaciones realizadas por Lodge et al. (2001) y Angelini y Losi (2013a, 2014, 2015, 2021, 2023) resaltan la importancia del orden Polyporales en la biodiversidad fúngica del país. Perdomo et al. (2007) también aporta información sobre familias y especies de estos órdenes. Estos resultados encontrados en esta zona del país son contrarios a los obtenido por Perdomo (2001) en la reserva Científica de Ébano Verde y el Parque Nacional Los Haitises, en la cual la familia más representativa fue la Coriolaceae del orden Poriales.
Otras investigaciones indican la presencia de ejemplares de los órdenes Auriculariales (Perdomo et al., 2007); Boletales (Gelardi et al., 2019, 2020; Perdomo, et al., 2007); Pezizales (Baroni et al., 2018; Angelini y Medardi, 2012; Perdomo et al., 2007), Russulales (Angelini y Losi, 2013b) Tremellales y Xylariales (Angelini y Medardi, 2012).
Con excepción de algunos ascomicetes de los géneros Xylaria y Phillipsia y algunos basidiomicetos de los géneros Macrolepiota y Clathrus, que se encontraron en las cercanías de los poblados, el resto de las especies de macrohongos crecían en los bosques de Sonador, ya sea entre árboles frondosos siempreverdes o caducifolios. En la tabla 1 puede observarse que la mayoría se alimentan saprofíticamente, desarrollando su cuerpo fructífero entre la abundante hojarasca, donde está la madera muerta o sobre troncos caídos cumpliendo su función de regeneración de los bosques al atacar y pudrir los ejemplares muertos descomponiendo la materia desechada para reciclarla como humus. Por lo tanto, la mayoría de ellos presentaban un hábito lignícola (ya sea solitarios o gregarios) y otros, como por ejemplo, Panaeolus antillarum y Psilocybe cubensis se desarrollaron sobre estiércol de animales, para lograr su descomposición.
Géneros como Agaricus, Morganella, Marasmius, Coprinellus y Amanita, entre otros, se observaron creciendo entre pinos (Pinus spp.), araucarias (Araucaria araucana) y otras gimnospermas, mientras que los hongos de los géneros Ganoderma y Trametes se encontraban formando comunidades simbióticas con briofitas, pteridofitas y plantas pequeñas en los troncos de algunos árboles leñosos a pesar de tener naturaleza saprofítica. También se identificaron macrohongos con otra forma de alimentación y hábitat, como Boletellus ananas y Leccinum spp., los cuales crecían directamente en el suelo e intervenían en la construcción del sistema de micorrizas. De esta manera, cada hongo que forma parte de estos ecosistemas, independientemente de su forma de alimentación, proporciona nutrientes vitales, incrementando su productividad y aumentando su salud.
El mayor número de individuos se recolectó en períodos de invierno y el 60% de ellos aproximadamente fueron encontrados en áreas sombreadas con una elevación entre 400 a 510 m.s.n.m. y en las riberas del rio Sonador. Se observó que, con la disminución de la altura, la diversidad de hongos era menor probablemente porque la zona en estudio es afectada por los herbicidas aplicados en los cultivos de la zona. Sin embargo, la cantidad de macrohongos registrada en este trabajo es bastante alta si se considera que el área estudiada fue pequeña.
Hasta ahora, son pocos los estudios realizados sobre macrohongos en el Municipio Bonao, a pesar de ser una zona que presenta condiciones climáticas que favorecen la replicación de estos organismos como lo son temperaturas cálidas, alta humedad y cobertura boscosa. En las investigaciones realizadas por Toro (1927), los datos colectados de la provincia Monseñor Nouel corresponden a microhongos, muchos de ellos patógenos para cultivos comerciales y al realizar una comparación de las especies reportadas con las encontradas en este trabajo, el porcentaje de coincidencias es nulo. Situación similar se presenta con los trabajos de Kern (1928) y Ellis (1968).
De todos los hongos nombrados en este inventario, las autoras sólo encontraron una página de internet llamada “Inaturalist” ubicada en la dirección: https://www.inaturalist.org/ identificada como una comunidad de naturalistas que comparten sus observaciones en repositorios de datos científicos, donde se publican fotografías de seis de las especies conseguidas en esta investigación para la provincia Monseñor Nouel, a saber, Psilocybe cubensis, Cookeina speciosa y Boletellus ananas en el municipio de Bonao, Trametes sanguinea y Lentinus berteroi ubicados en el municipio de Maimón y Phallus indusiatus que no se indica lugar de colecta.
Los bosques de República Dominicana albergan una gran diversidad de hongos, desconocidos muchos de ellos y probablemente buena parte de estos posean algún tipo de potencial de uso en la industria alimenticia, en la producción de fármacos, en la agricultura, en procesos biológicos de importancia ambiental y económica, así como también información importante de especies toxicas o mortales para los seres vivos. Angelini (2022) y Aquino et al., (2021) comentan que se necesita con urgencia la documentación de la diversidad de hongos en el país porque los hábitats naturales se están perdiendo a gran escala debido a la alteración del uso de la tierra y el cambio climático. Por lo tanto, es conveniente continuar aportando el conocimiento micológico, mediante trabajos de exploración e inventarios detallados en regiones ya trabajadas y extendiéndose a aquellas poco conocidas o no estudiadas.
Conclusiones
En las tres zonas de estudio exploradas en la Comunidad de Sonador se encontraron 1034 macrohongos que conformaron 66 especies, distribuidos en las divisiones Ascomycota, con sus 2 órdenes y 4 familias y Basidiomicota con sus 11 órdenes y 26 familias. Dentro de esta última división se incluyen los órdenes más representativos y abundantes en la presente investigación que son Polyporales y Agaricales. Las familias Agaricaceae, Pleurotaceae, Hymenogastraceae, Auriculareaceae, y Polyporaceae fueron las que presentaron mayor diversidad de géneros y especies. En esta investigación todas las especies inventariadas son nuevos reportes para la localidad de Sonador, Provincia Monseñor Nouel, República Dominicana y se identificaron 10 grupos nuevos para el país, 4 a nivel de especie y 6 a nivel de género, que son: Amanita spp. (1), Amanita spp. (2), Geastrum spp., Marasmiellus spp., Phellodon spp., Pleurotus spp., Calocera cornea, Pleurocybella porrigens, Pleurotus pulmonarius y Trametes gibbosa.
Cuantificar la biodiversidad de macrohongos en un área específica es dificultoso dado la naturaleza efímera de los cuerpos fructíferos cuya visualización depende del ciclo de vida del hongo, de la vegetación circundante, las condiciones del clima, entre otros aspectos, razón por la cual este tipo de investigación puede llevarse muchos años para poder encontrar, si no todas, por lo menos la mayoría las especies existentes empleando métodos oportunísticos, por lo que es probable que en futuros inventarios se registren mayor número de especies en la zona estudiada que aporte importante información sobre la riqueza fúngica de la cordillera central de la República Dominicana, que hasta ahora, desde el punto de vista micológico, ha sido poco estudiada. El hallazgo de especies nuevas para el país y la variedad de macrohongos encontrados en la región, lleva a concluir que el potencial total de especies que puede aportar información a la biodiversidad del área debe ser mucho mayor.
Agradecimientos
Las autoras queremos expresar nuestro agradecimiento a la Universidad Adventista Dominicana por su apoyo en la logística para realizar esta investigación, la dotación de materiales y reactivos, así como el espacio físico para el guardado y manteamiento de los ejemplares.
Referencias
Alcántara, M. (2010). La importancia de los hongos. Ecología 6. Recuperado de: https://www.ecologistasenaccion.org/19972/la-importancia-de-los-hongos/.
Angelini C. (2022). Macrofungi of the Dominican Republic: a first checklist and introduction to www.neotropicalfungi.com. Current Research in Environmental & Applied Mycology (Journal of Fungal Biology) 12(1): 238–258. https://doi.org/10.5943/cream/12/1/15
Angelini, C & Medardi, G. (2012). Tropical fungi: twelve species of lignicolous Ascomycota from the Dominican Republic. Mycosphere. 3. 567–601. https://doi.org/10.5943/mycosphere/3/5/6.
Angelini, C. & Losi, C. (2013a). Polyporoid Fungi in the Dominican Republic Ist Part. Ganodermataceae & Hymenochaetaceae. Bol. AMER 89, Año XXIX (3): 27-39
Angelini, C. & Losi, C. (2013b). Annotaded list of Steroid fungi in RD_Part II. Bol. AMER 90, Anno XXIX (3): 31-38
Angelini, C. & Losi, C. (2014). Annotated list of Polyporaceae in the Dominican Republic. Third Part. Bol. AMER 91, Anno XXX (1): 31-45.
Angelini, C. & Losi, C. (2016). Fungus flora of the Dominican Republic. Part V. Other polyporoid, corticioid and stereoid fungi. RMR, Boll. AMER, Anno XXXII (2): 3-22.
Angelini, C. & Losi, C. (2015). Annotaded list of polyporoid fungi in the Dominican Republic. 4th Part. RMR, Bol. AMER, Anno XXXI (3): 3-19.
Angelini, C. & Losi, C. (2021). Fungus flora of the Dominican Republic. VII. Some unreported polyporoid, stereoid and corticioid fungi. RMR Boll. AMER, numero speciale (fuori serie), Anno XXXVII: 3-33.
Angelini, C. & Losi, C. (2023). Fungus flora of the Dominican Republic. VIII. Some unrecorded polyporoid, corticioid, stereoid and clavarioid fungi. RMR, Bol. AMER, primo numero speciale (fuori serie) Anno XXXVIV: 3-18. https://doi.org/10.57624/AMER.2022.05
Aquino, C., Almonte, B. M., & Pimentel, Y. (2021). Hongos del monumento natural Pico Diego De Ocampo: listado preliminar. Ciencia, Ambiente y Clima, 4(2), 19–26. https://doi.org/10.22206/cac.2021.v4i2.pp19-26
Baroni T., Beug, M., Sharon, M., Cantrellc, T., Iturriagae T., Laessoef, T., Holgado, M., Aguilarh, F., Quispeh, O., Lodgei, J., & O’Donnell, K. (2018). Four new species of Morchella from the Americas. Mycologia 110 (6): 1205–1221. https://doi.org/10.1080/00275514.2018.1533772.
Baroni, T., Angelini, C., Bergemann, S., Lodge, J., Lacey, L., Curtis, T., & Cantrell, S.(2020). Rhodocybe-Clitopilus clade (Entolomataceae, Basidiomycota) in the Dominican Republic: new taxa and first reports of Clitocella, Clitopilus, and Rhodocybe for Hispaniola. Mycological Progress 19:1083–1099. https://doi.org/10.1007/s11557-020-01619-y
Burt, E.A. (1920). The Thelephoraceae of North America. XII. Stereum. Annals of the Missouri Botanical Garden 7 (2-3): 81-248.
Cantrell, S., Lodge, J. & Baroni, T J. (2001). Basidiomycetes of the Greater Antilles Project. Mycologist 15(3): 107-112.
Cappello, S., López, E S. & Sánchez, V. (2006). Educación ambiental para conocimiento y uso de hongos en una comunidad chontal. Olcuatitán, Nacajuca. Tabasco. Horizonte Sanitario 5(2): 44-54.
Ciferri, R. (1961). Mycoflora Domingensis Integrata. Quaderno. Laboratorio Crittogamico, Istituto Botanico della Università di Pavia 19: 539.
Ellis, M B. (1968). Hifomicetos dematiáceos. IX. Spiropes y Pleurophragmium. Mycological Papers 114: 1-44.
Estrada, G. & Ramírez, M. (2019). Micología general. Universidad Católica de Manizales. Centro Editorial UCM. Colombia. 306pp.
Fernández C, Avelino. 2023. Avelinosetas.info. Recuperado de: https://www.avelinosetas.info/fichas_generos/Marasmiellus.html.
Gelardi, M., Angelini, C., Costanzo, F., Ercole, E., Ortiz-Santana, B. & Vizzini. A (2020). Outstanding Pinkish Brown-Spored Neotropical Boletes: Austroboletus subflavidus and Fistulinella gloeocarpa (Boletaceae, Boletales) from the Dominican Republic. Mycobiology. https://doi.org/10.1080/12298093.2020.1843221
Gelardi., M., Angelini, C., Costanzo-. F, Dovana, F., Ortiz-Santana, B & Vizzini, A. (2019). Neoboletus antillanus sp. nov. (Boletaceae), first report of a red-pored bolete from the Dominican Republic and insights on the genus Neoboletus. MycoKeys 49: 73–97. https://doi.org/10.3897/mycokeys.49.33185.
Global de Información sobre Biodiversidad (GBIF). 2023. Recuperado de: https://www.gbif.org/
Hawksworth, D L., Kirk, P M., Sutton, B C. & Pegler, D N. (1995). Ainsworth & Bisby's Dictionary of the Fungi 8th Edition. Reino Unido, Oxfordshire, Wallingford; CAB Internacional. 616 págs.
Huhndorf, S. (1992) Neotropical Ascomycetes 2. Hypsostroma, A new genus from the Dominican Republic and Venezuela. Mycologia, 84:5, 750-758, https://doi.org/10.1080/00275514.1992.12026201
Inaturalist (2023). Lista de verificación de Monseñor Nouel. Recuperado de: https://inaturalist.nz/check_lists/15678-Monse-or-Nouel-Check-List?iconic_taxon=47170
Jaime, M., de la Rosa, J. G., & Santos Báez, H. J. (2021). Nuevo récord de Trametes hirsuta (Wulfen) Lloyd (Basidiomycota) en Refugio de Vida Silvestre Laguna Mallén, San Pedro de Macorís-República Dominicana. Ciencia, Ambiente y Clima, 4(1), 19-27. https://doi.org/10.22206/cac.2021.v4i1.pp19-27
Justo, A., Angelini, C., Bizzi, A. & Vizzini, A. (2015). Leucoagaricus sabinae (Agaricaceae), a new species from the Dominican Republic. North American Fungi 10(5): 1-15. https://doi.org/10.2509/naf2015.010.005
Kern, F.D. (1928). Fungi of Santo Domingo – II. Uredinales. Mycologia 20 (2): 60-82.
Lodge, J., Ryvarden, L. & Perdomo-Sanchez, O. (2001). Studies in neotropical polypores 11: Antrodia aurantia, a new species from the Dominican Republic, Greater Antilles. Mycotaxon LXXX: 261-266.
Medel-Ortiz, R., R. Garibay-Orijel, A. Argüelles-Moyao, G. Mata, R. Kerrigan, A. Bessette, J. Geml, C. Angelini, L. Parra & J. Chen. (2022). Agaricus macrochlamys, a new species from the (sub)tropical cloud forests of North America and the Caribbean, and Agaricus fiardii, a new synonym of Agaricus subrufescens. J. Fungi 8: 664. https://doi.org/10.3390/jof8070664
Miller Jr., Orson K. & Miller, H. (2006). North American Mushrooms: A field guide to edible and inedible fungi. Guilford, CN: FalconGuide. p. 141.
Ministerio de Medio Ambiente y Recursos Naturales. (2020). La Biodiversidad en la República Dominicana. Proyecto Aumento de la capacidad de adaptación ecosistémica en las Reservas de Biosfera fronterizas en la República de Haití y la República Dominicana, Cooperación Alemana, GIZ. Primera Edición. Santo Domingo, República Dominicana, pp. 5-1.
Ministerio del Medio Ambiente y Recursos Naturales. (2012). Memoria de gestión 2012. República Dominica. 282pp.
Minter, D W. & Perdomo, O P. (2006). Hongos de la República Dominicana. Recuperado de: www.cybertruffle.org.uk/dorefung
Minter, D W., M. Rodríguez & J. Mena. (2001). Fungi of the Caribbean. An Annotated Checklist. 713pp.
Ortiz-Santana, B., D. Lodge, T. Baroni & E. Both. (2007). Boletes from Belize and the Dominican Republic. Fungal Diversity 27: 247-416.
Parra, L., Angelini, C., Ortiz-Santana, B., Mata, G., Billette, C., Rojo, C. Chen, J. & Callac, P. (2018). The genus Agaricus in the Caribbean. Nine new taxa mostly based on collections from the Dominican Republic. Phytotaxa 345 (3): 219–271. https://doi.org/10.11646/phytotaxa.345.3.2.
Perdomo, O. P., Miniño, V., Rodríguez de Francisco, L., & León, Y. (2018). Cytospora rhizophorae Kohlm. & E. Kohlm (Valsaceae, Ascomycota) en la República Dominicana. Ciencia, Ambiente Y Clima, 1(1), 23-31. https://doi.org/10.22206/cac.2018.v1i1.pp23-31
Perdomo, O., Jean L. & Baroni, T J. (2007). Hongos comestibles en República Dominicana, Guía de campo. Santo Domingo, República Dominicana: Centro para el Desarrollo Agropecuarlo y Forestal, Inc. (CEDAF). Primera publicación. 99 pp.
Perdomo, Omar. (2001). Inventario de hongos poliporaceos en dos áreas protegidas de la República Dominicana. Tesis de grado para maestría. Universidad de Costa Rica. Costa Rica. 281pp.
Sierra, J. D., Arias J A. & Sánchez, M. (2011). Registro preliminar de macrohongos (Ascomycetes y Basidiomycetes) en el bosque húmedo montano del Alto el Romeral (Municipio de Angelópolis, Departamento de Antioquia - Colombia). Rev. Fac. Nal. Agr. Medellín 64(2): 6159-6174.
Toro, R. A. (1927). Hongos de Santo Domingo – I. Mycologia 19 (2): 66-85.
Ubillos, J. (2020). Geastrum rufescens. Fichas Micológicas. Recuperado de: https://www.fichasmicologicas.com/?micos=1&alf=G&art=383
Universidad Nacional Autónoma de México (UNAM). 2021. Hongos silvestres comestibles y tóxicos de México. Recuperado de: https://www.hongoscomestiblesytoxicos.ib.unam.mx/
Vargas, N., Bernal, A., Sarria, V., Franco-Molano, A. & Restrepo, A. (2011). Amatoxin and phallotoxin composition in species of the genus Amanita in Colombia: A taxonomic perspective. Toxicon 58 (6–7): 583-590.
Vizzini, A., Angelini, C. & Ercole, E. (2012). A new Neopaxillus species (Agaricomycetes) from the Dominican Republic and the status of Neopaxillus within the Agaricales. Mycologia, 104. 138-47. https://doi.org/10.3852/10-345
Wakimoto, T., Asakawa, T., Akahoshi, S., Suzuki, T., Nagai, K., Kawagishi, H & Kan, T. (2011). Proof of the Existence of an Unstable Amino Acid: Pleurocybellaziridine in Pleurocybella porrigens. Angewandte Chemie International Edition 50(5) 1168.
