Introducción
Las acciones antropogénicas han causado daños irreversibles al medio ambiente. Podemos notar evidencia de contaminación en los afluentes y zonas costeras que se encuentran cerca de viviendas y lugares dinámicos con actividades humanas (Escobar, 2002). Según Encinas (2011),
se entiende por contaminación la presencia en el aire, agua o suelo de sustancias o formas de energía no deseables, en concentraciones tales que puedan afectar al confort, salud y bienestar de las personas, y al uso y disfrute de lo que ha sido contaminado. (p. 3).
Los metales pesados son considerados contaminantes muy comunes en lugares con alta densidad de actividad humana (García et al., 2002).
Se denomina ‘metales pesados’ a cualquier elemento metálico y metaloide que tiene una densidad relativamente alta, que varía de 3.5 a 7 g/cm3 y es tóxico o venenoso a bajas concentraciones, e incluye mercurio (Hg), cadmio (Cd), arsénico (As), cromo (Cr), talio (Tl), cinc (Zn), níquel (Ni), cobre (Cu) y plomo (Pb) (Gautam et al., 2014, p. 1).
La metodología de detección de metales pesados en agua y sedimentos tiene ciertos obstáculos para la obtención de resultados. El análisis de sedimentos sufre limitaciones; las concentraciones de un metal en sedimento dependen, además de otros factores, de la tasa de deposición y la naturaleza de las partículas (Phillips, 1997; Villares et al., 2001). Para resolver esta problemática, Villares et al. (2001) describen que se pueden utilizar organismos que nos pueden brindar la facilidad de detectar estos metales, para esto se considera que el organismo puede ser adecuado como bioindicador, si este es sésil o sedentario, tolerante a grandes niveles de contaminación y diversos rangos de salinidad. La utilización de un organismo que prolifere en estas condiciones es apta para el seguimiento de una investigación como la presente. Como se menciona, una buena elección para el estudio es la utilización de algas, específicamente las macroalgas. Los metales pesados obtenidos están adheridos a las algas localizadas en el litoral sur de Santo Domingo, República Dominicana, las cuales se tomaron de un ecosistema costero.
Las algas son un grupo muy diverso de organismos fotosintéticos. Las macroalgas son morfológicamente mucho menos complejas que las plantas vasculares, ya que carecen de raíces, tallos, hojas, flores y frutos, lo mismo que de tejidos de conducción (Espinoza, 2005). En el caso de las Chlorophyta (algas verdes), su rol ecológico se encuentra en que son responsables de la mayor parte de la productividad primaria en algunos cuerpos de agua, a través de la fotosíntesis (Chakraborty et al., 2014).
Las macroalgas a menudo se consideran un indicador valioso de la contaminación por metales pesados en las zonas costeras, debido a su alto potencial de acumulación, facilitado por la presencia de tioles y péptidos (Lee & Wang, 2001). Además, Carvalho et al. (2008) exponen en su estudio, que las algas tienen un rico contenido de proteínas, polisacáridos, minerales y vitaminas.
Muchas especies de algas verdes crecen adheridas a sustratos rocosos y de concreto, en o cerca de la superficie del océano (Jayakumar et al., 2011). Un ejemplo de esto se puede ver en el género Ulva, el cual se caracteriza por ser muy abundante y se encuentra en todas partes de las comunidades bentónicas costeras del mundo (Wichard et al., 2015; Zhang et al., 2013a; Zhang et al., 2013b).
La capacidad de las algas para poder absorber metales pesados es denominada biosorción. La biosorción se caracteriza por la retención del metal mediante una interacción fisicoquímica del metal con ligandos presentes en la superficie celular, la cual se produce con grupos funcionales expuestos hacia el exterior celular, pertenecientes a partes de moléculas componentes de las paredes celulares, como por ejemplo carboxilo, amino, hidroxilo, fosfato y sulfhidrilo (Cuizano y Navarro, 2008). Hay que tomar en cuenta que existen tres categorías de metales pesados relacionados a la biosorción: los metales tóxicos (como Hg, Cr, Pb, Zn, Cu, Ni, Cd, As, Co, Sn, etc.), los metales preciosos (como Pd, Pt, Ag, Au, Ru, etc.) y radionúclidos (como U, Th, Ra, Am, etc.), cuyos pesos específicos son usualmente mayores de 5 g/mL (Cuizano y Navarro, 2008).
El conocimiento de la flora marina caribeña es limitado en comparación con la larga historia de colecciones ficológicas realizadas en todo el mar Caribe. La literatura disponible parece indicar que la flora marina del Caribe insular está relativamente muy escasa, pero estas estimaciones de diversidad, probablemente, reflejen un esfuerzo limitado de recolección e investigación. En la República Dominicana los estudios sobre ficología son muy escasos. Unos de los trabajos más completos es el de Betancourt y Herrera-Moreno (2001), que ofrece un listado de las principales algas bentónicas de la isla.
La taxonomía tradicional de Ulva se ha basado en características morfológicas como la forma y tamaño del talo, presencia/ausencia de dientes marginales, dimensiones celulares y número de pirenoides (Guiry y Guiry, 2020). Sin embargo, muchos estudios han demostrado que estas características son altamente variables (Zhang et al., 2013b; Wichard et al., 2015; Gao et al., 2016), por lo que la identificación a nivel de especies ha sido particularmente difícil, debido a la alta variabilidad morfológica y plasticidad fenotípica intraespecífica. En ese contexto, es fundamental el uso de herramientas complementarias como las técnicas moleculares, las cuales han tenido éxito en identificación de especies de Ulva (Baamondes et al., 2007; Aguilar-Rosas et al., 2008). Las especies del género Ulva son cosmopolitas y se distribuyen ampliamente, habitando todos los océanos del mundo.
El alga verde Chaetomorpha, descrita por Kützing (1845), puede crecer en ambientes con una amplia variabilidad de salinidad y temperatura, y es capaz de proliferar en aguas eutrofizadas (Tsutsui et al., 2010; Chen & Zou, 2015; Ge & Champagne, 2017; Meenakshisundaram et al., 1999). Además, Chaetomorpha a menudo se informa como una molestia en la acuicultura y, normalmente, se elimina y se descarta (Tsutsui et al., 2010). Sin embargo, este género puede representar una materia prima prometedora para diferentes propósitos debido a sus compuestos valiosos como proteínas, pigmentos, ácidos grasos y sus polisacáridos de la pared celular. Chaetomorpha sp., también posee una pared celular rígida con una parte exterior laminar que consiste, principalmente, en celulosa (Nicolai y Preston, 1952). La especie C. gracilis se caracteriza por tener una distribución cosmopolita.
En esta investigación, se analizan las algas identificadas de la clasificación Chlorophyta (Ulva fasciata y Chaetomorpha gracilis) para evaluar si estas pueden ser indicadoras de contaminación de metales pesados, a través de la técnica de Espectroscopia de Absorción Atómica (EAA), tomadas de una zona de muestreo de tipo costero-marítimo en el sur de la ciudad de Santo Domingo, República Dominicana.
Antecedentes
Para la elaboración del análisis de metales pesados en algas existen varias técnicas, entre estas: Espectroscopia de Absorción Atómica (EAA), Voltamperometría de Separación Anódica de Onda Cuadrada (VSAOC), Espectrometría de Emisión Atómica de Plasma Acoplado Inductivamente (EEA-PAI), Microscopía Electrónica de Barrido acoplado a Espectrometría de Rayos X de Dispersión de Energía (MEB-EDX) (Pourkhabbaz et al., 2016; Tamayo et al., 2014; Kumar et al., 2009; Lai et al., 2003). El método por Espectroscopia de Absorción Atómica (EAA) es la técnica más utilizada para determinar metales pesados en algas.
Existen normas en diversos países que explican cuáles son los límites de aceptación permisibles para los metales pesados, dependiendo del medio donde se encuentren (agua, suelo, aire, organismos, etc.). En República Dominicana no hay normas que representen los límites de aceptación de metales pesados en algas.
Tras la recolección de las algas en el litoral, se pudo identificar a Ulva fasciata como una de estas. Esta alga fue denominada así por Delile en 1813 y es un sinónimo de Ulva lactuca, la cual fue nombrada por Linnaeus en 1753. Sobre U. lactuca se decía que provenía del norte de Europa, pero la información molecular indica que el espécimen holotipo de U. lactuca, probablemente, provino del Indo-Pacífico (Hughey et al., 2019). Cabe destacar que la U. fasciata no es una especie nativa de República Dominicana y, posiblemente, fue introducida de forma accidental. Por su parte, se dice que la U. lactuca pudo haber sido introducida accidentalmente en el Mediterráneo, en donde se informó la primera vez desde Alejandría, Egipto (Guiry & Guiry, 2020).
Especies del género Ulva tienen un gran potencial como bioindicador, debido a su amplia distribución geográfica y gran tamaño. Además, muchas especies del género Ulva se utilizan como biofiltros de nutrientes debido a su alta eficiencia en la eliminación de compuestos nitrogenados inorgánicos. Asimismo, son capaces de absorber y metabolizar diferentes formas de nitrógeno inorgánico, principalmente nitrato y amonio (Lee & Wang, 2001). El crecimiento de las especies del género Ulva tiene frecuencia en ambientes enriquecidos con nutrientes procedentes de ríos o zonas donde hay contaminantes albañales (Cano, 2008). Ulva fasciata puede crecer sin ningún apego a sustrato y son capaces de proliferar cuando se les suministra agua de mar enriquecida con nutrientes, como los estuarios que se asocian con efluentes de aguas residuales; por lo tanto, se puede formar una gran masa de algas en áreas costeras, donde los niveles de nutrientes son muy altos (Cano, 2008).
La siguiente macroalga identificada tras la recolección fue Chaetomorpha gracilis. Sobre Chaetomorpha spp. hay investigaciones donde se mencionan ciertas especies de este género que acumulan concentraciones de cinc (Zn), arsénico (As), entre otros metales, en aguas contaminadas (De Arellano, 2007; González et al., 2011).
Kalesh y Nair (2005) estudiaron diversas algas marinas para ver los niveles de acumulación de metales pesados: níquel (Ni), cromo (Cr), estroncio (Sr) y plata (Ag), en la costa de Kerala, ubicada en India. Se estudiaron algunas algas de la división Chlorophyta (Ulva lactuca, Enteromorpha intestinalis, Chaetomorpha antennina) y otras de la división Rhodophyta. Se encontró que las concentraciones medias de Ni y Sr estaban dentro de los rangos reportados para las algas de la India, mientras que los contenidos de Cr eran considerablemente más altos que los valores reportados. Las Chlorophytas, Enteromorpha intestinalis y Chaetomorpha antennina estuvieron dentro de las algas que mostraron las mayores acumulaciones de Ni, Cr, Sr y Ag. Ulva lactuca exhibió la menor acumulación de Ni y Cr. Concluyeron que la Chaetomorpha antennina se puede utilizar para monitorear Sr y Cr en esa zona de estudio, mientras que la Ulva lactuca, al exhibir valores relativamente bajos de acumulación de metales, no se considera un buen indicador para este lugar.
En la investigación de Rai et al. (1981), se hizo una evaluación de la influencia de los metales pesados en algas, entre estas Cladophora glomerata, la cual es parte de la división Chlorophyta. Utilizando la técnica de Espectroscopia de Absorción Atómica (EAA), analizaron los metales pesados: plata (Ag), cromo (Cr), arsénico (As), cadmio (Cd), cobre (Cu), mercurio (Hg), níquel (Ni), plomo (Pb), cinc (Zn) y manganeso (Mn). Conclusiones destacadas de su estudio fueron que los metales pesados son extremadamente tóxicos para las algas a concentraciones elevadas; que el umbral de toxicidad de un metal pesado varía en condiciones de campo y laboratorio, principalmente debido a la interacción con factores ambientales como el pH, calcio, fósforo, magnesio y dureza del agua.
En los estudios de Kumar et al. (2009), se pudo analizar la Chaetomorpha sp. y otras algas para ver su capacidad de biosorción. Los resultados obtenidos en este estudio indicaron que la mayor capacidad de adsorción para cadmio (Cd) y plomo (Pb) se observó en la Chaetomorpha sp., al compararse con otras cuatro especies de algas verdes. Concluyeron que la concentración de los metales pesados analizados durante el estudio disminuyó significativamente durante el período experimental, lo cual demostró que las macroalgas marinas son excelentes biosorbentes.
De los estudios previamente hechos por El Nemr et al. (2011) dentro de la bahía de Abu-Qir, localizada en el mar Mediterráneo, se pudo estudiar diversas concentraciones de metales en diferentes tipos de algas. Entre estas algas, estuvo la U. fasciata. Concluyeron que el contenido de metales de las especies de algas puede ser el resultado del estado estacionario entre la concentración de contaminación y la movilización del agua de mar, por igual, la disponibilidad de los metales y la capacidad de acumulación de las algas. Por esta razón, las algas estudiadas pueden considerarse indicadores potencialmente adecuados de los efectos de contaminación en lugares específicos y en corto plazo.
En los estudios de Pourkhabbaz et al. (2016), hechos en el río Karún de Irán, se evaluó la correlación entre los metales pesados en Chaetomorpha sp., y los encontrados en agua y sedimentos. Concluyeron que existe una correlación positiva y significativa entre las concentraciones de metales en los sedimentos de tejido de algas, y mostró que Chaetomorpha sp. es un bioindicador adecuado para metales pesados.
Ibrahim et al. (2016) investigaron la capacidad de biosorción utilizando la macroalga Ulva lactuca y su carbón activado. Observaron los efectos de varios parámetros como el tiempo de contacto, la dosis de algas, el efecto del pH y la concentración inicial de iones metálicos sobre el proceso de adsorción. Pudieron notar que la adsorción óptima ocurre a pH 5.0, en un tiempo de contacto de 60 min, una dosis de adsorbente 0.8 g/L y concentración inicial 60 mg/L. Concluyeron que U. lactuca, basada en carbón activado, se puede utilizar para la eliminación de iones metálicos del medio ambiente contaminado.
En la investigación de Shams et al. (2014), se evaluó como bioindicadores de metales pesados a algunas algas de Chlorophyta (Enteromorpha compressa y Ulva fasciata), al igual que otras algas de las divisiones Phaeophyceae y Rhodophyceae. Concluyeron que E. compressa y dos algas más, que no son parte de la división Chlorophyta, obtuvieron los mayores valores de concentración de metales pesados estudiados durante el período 2008-2010.
Se encuentran dos investigaciones hechas en zonas costeras de República Dominicana, basadas en la utilización de macroalgas para la detección de metales pesados. En la investigación de Tejada et al. (2019) hecha en las playas La Caleta, Juan Dolio, San Andrés, Monte Río y La Saladilla, se pudieron analizar los metales: cadmio (Cd), cobre (Cu), cromo (Cr), níquel (Ni), plomo (Pb) y cinc (Zn), en dos algas del género Sargassum (Sargassum natans y Sargassum fluitans). El estudio demostró que las concentraciones se encontraban por debajo de los límites de aceptación. Se determinó que los valores de cobre eran relativamente más altos que los demás. En el estudio de Fernández et al. (2017) hecho en las playas Boca Chica, Guayacanes y Ojeda, se analizaron metales tóxicos como Hg, Pb, Cd, Ni y Cr; al igual, se buscó el contenido de otros 16 elementos utilizando las mismas especies de Sargassum mencionadas anteriormente. Se utilizó la técnica de espectrometría de masa por plasma acoplado inductivamente para determinar que no hubo niveles preocupantes de los elementos y que las algas estudiadas son capaces de bioacumular estos metales. Estas investigaciones afirman que la utilización de las macroalgas para la detección de metales pesados es factible.
Metodología
Localización y puntos de muestreo
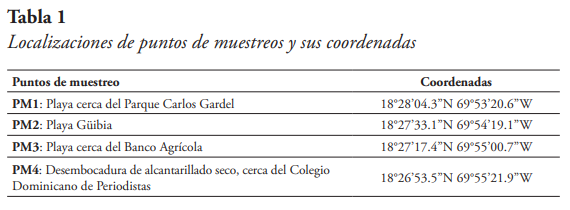
Se tomaron cuatro puntos de muestreo del farallón, que van desde una playa cerca del Parque Carlos Gardel hasta una desembocadura de alcantarillado cerca del Colegio Dominicano de Periodistas. Ambos géneros (Ulva y Chaetomorpha) se encuentran en estos puntos acopladas a las rocas del farallón y, usualmente, muy cerca del nivel del agua de mar. La distancia entre cada uno de estos puntos varió entre 1.00 a 2.6 km.
El litoral sur de Santo Domingo es muy extenso y gran parte es un acantilado, debido a esto se tomaron cuatro puntos accesibles para las colectas de las muestras (véase Tabla 1). Se llegó a tomar en cada uno de los puntos sus coordenadas, para así estar claro de la distancia entre estos. Cada punto fue nombrado como “PM” (PM = Punto de Muestreo), acompañado de un número asignado. En los puntos PM1 (véase Figura 2) y PM2 se tomaron muestras de Chaetomorpha sp. En los puntos PM3 (véase Figura 3) y PM4, se tomaron muestras de Ulva sp.

En la recolección de muestras no se tomaron ambas especies de todos los puntos. En PM1 hay Ulva fasciata y Chaetomorpha gracilis, en PM2 solo se encontró Chaetomorpha gracilis, y en PM3 y PM4 solo se pudo observar Ulva fasciata. Se decidió recolectar en dos puntos una sola alga y en los otros dos puntos la otra especie. Esto se debió a que no había forma de poder recolectar en más puntos, ya que el litoral sur es mayormente inaccesible para muestrear.


Muestreo e identificación de las especies
El muestreo se realizó en la zona intermareal. La toma de muestras se llevó a cabo de forma manual. El tipo de muestra es biológica, ya que los organismos tomados son macroalgas. Se tomaron tres réplicas en cada uno de los cuatro puntos de muestreo. Cada muestra fue anotada con las coordenadas de donde se tomó y con su identificación única ya establecida. La determinación de las algas se realizó in situ para Ulva fasciata con base en la experiencia de campo del sustentante y el asesor. Para la otra especie de alga, nos auxiliamos de literatura taxonómica general y especializada, y de estudios comparativos con muestras de herbarios. De igual manera, para verificar ambas especies con exactitud, también acudimos a la asistencia del especialista Oniel Álvarez del Instituto de Investigaciones Botánicas y Zoológicas (IIBZ), de la Universidad Autónoma de Santo Domingo.
Las muestras obtenidas se introdujeron en recipientes cilíndricos con tapas ajustadas (véase Figura 4). Dentro de los recipientes, se colectaron alrededor de 5 gramos de cada alga para cada muestra y suficiente agua del lugar donde se tomaron, para preservarlas por más tiempo hasta su análisis. Cada muestra tomada en los puntos fue clasificada por su cercanía al mar (véase Tabla 2).


Para poder ver alguna relación entre las concentraciones de cada punto de muestreo, se tomaron las muestras de lugares diferentes dentro del mismo punto. Las muestras que están en azul corresponden a C. gracilis. Las muestras que están en naranja corresponden a U. fasciata. Las muestras que terminan en .1 son las que se tomaron más cercanas a la posplaya y las muestras que terminan en .2 son las que se tomaron más cercana a la anteplaya, y eran las muestras que se encontraban más secas. Las muestras que terminan en .3 son las que se tomaron entre la posplaya y la anteplaya.
Determinación de metales pesados
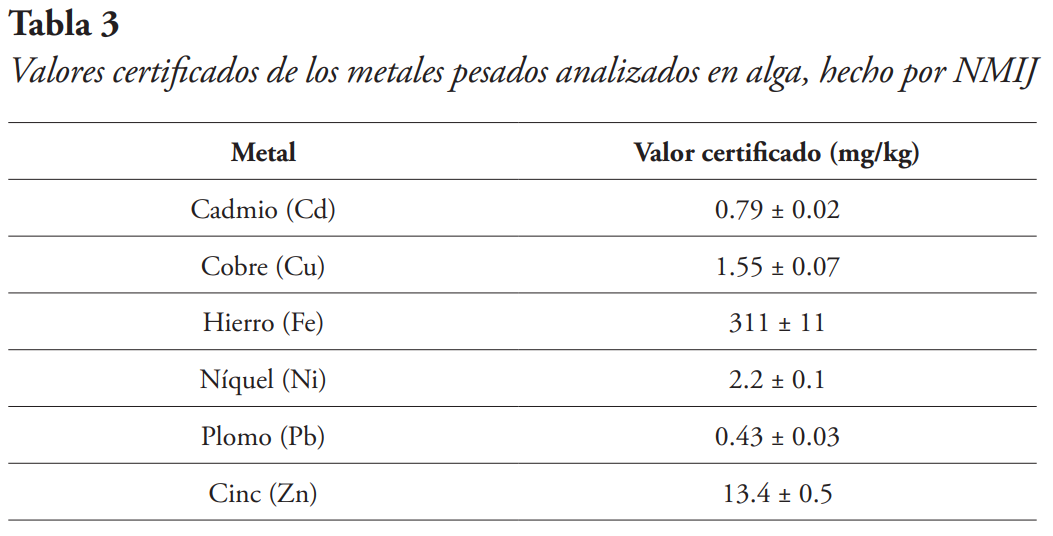
En República Dominicana no existen normativas para los límites de aceptación de metales pesados en algas, por lo que se utilizó la Tabla 3, la cual explica los valores certificados de los metales pesados en algas, hechos por el Instituto Nacional de Metrología de Japón (NMIJ), en la investigación de Narukawa et al. (2012).
Se utilizó el protocolo de Tejada et al. (2019), que consistió en utilizar espectrofotometría de absorción atómica. Además de extraer del alga los metales por digestión ácida y someterlos por el capilar de succión y detectar los metales deseados (Ghrefat y Yusuf, 2006; Bettiol et al., 2008; Martínez y Sanz, 2009; Díaz et al., 2010).
Los análisis de las muestras fueron realizados en el laboratorio ALTOL Dominicana.
Análisis por la técnica de Espectroscopia de Absorción Atómica
Los metales analizados fueron cadmio (Cd), cobre (Cu), hierro (Fe), níquel (Ni), plomo (Pb) y cinc (Zn). Los metales cadmio, cobre, níquel, plomo y cinc fueron elegidos ya que son metales tóxicos (Cuizano y Navarro, 2008; El-Naggar et al., 2018; Romera et al., 2007; Rybak et al., 2013), mientras que el hierro fue elegido debido a que este metal se encuentra frecuentemente en investigaciones de metales pesados en algas (Shams et al., 2014; Cano, 2008; Fernández et al., 2017; Cameron et al., 2018; Mehta y Gaur, 2005; Labib et al., 2014; Romera et al., 2007).
Curva de calibrado
La curva de calibración es un método de química analítica empleado para medir la concentración de una sustancia en una muestra, por comparación con una serie de elementos de concentración conocida (Rosas, 2014). Utilizando la Ley Fundamental de la Volumetría (C1xV1 = C2xV2), se calculó el volumen inicial del estándar utilizado según la concentración, de acuerdo con la metodología de Tejada et al. (2019).
Lectura de las muestras
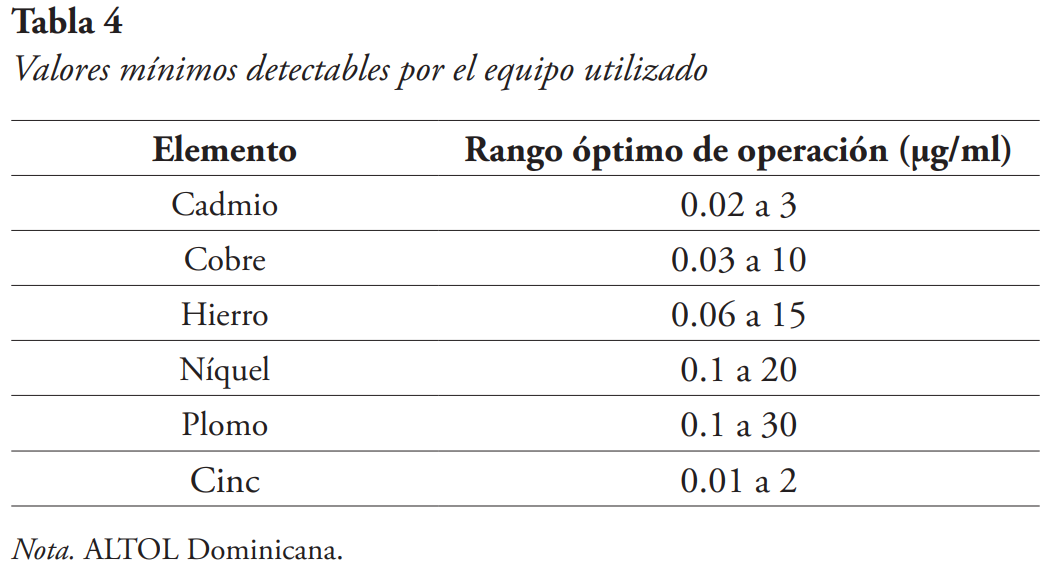
El protocolo metodológico fue de acuerdo con el estándar del laboratorio ALTOL Dominicana. El equipo utilizado fue de la marca Agilent, modelo 240AA, número de serie MY1050003. Los metales analizados tienen rangos óptimos de operación a las longitudes de onda trabajadas, en las cuales fueron preparadas las curvas de calibración; estos valores se pueden tomar como referencia a los mínimos detectables en el equipo (véase Tabla 4).
Resultados
Análisis de las muestras por Espectroscopia de Absorción Atómica
A través de los resultados se destacó que las concentraciones de los metales cadmio (Cd), níquel (Ni) y plomo (Pb) no estuvieron en rangos permisibles para su detección por este método (véase Tabla 5).
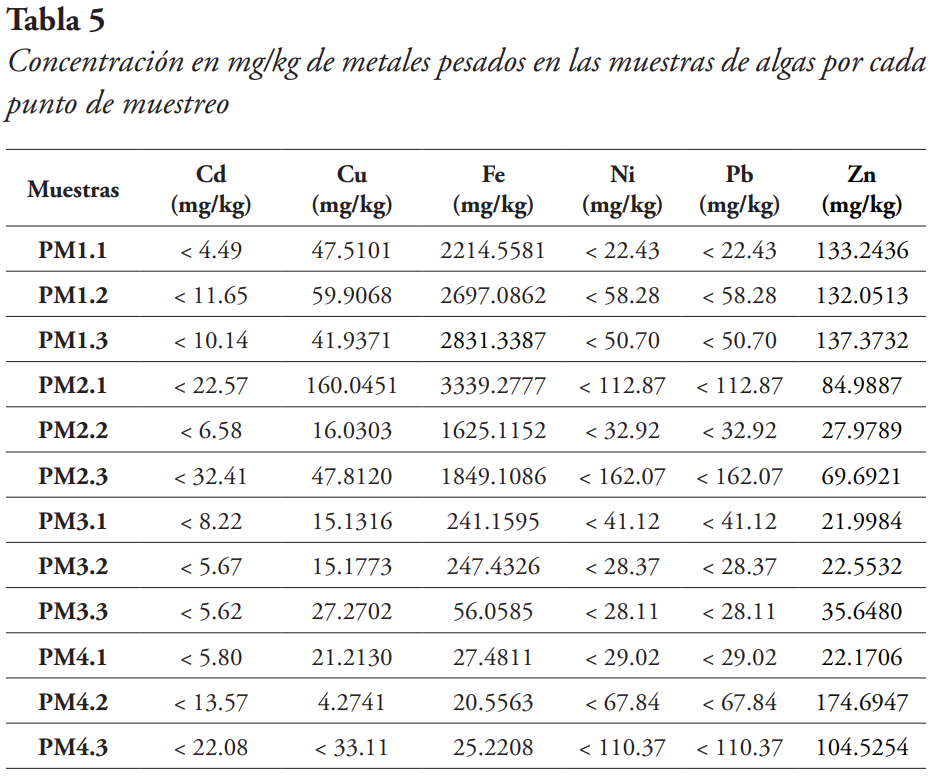
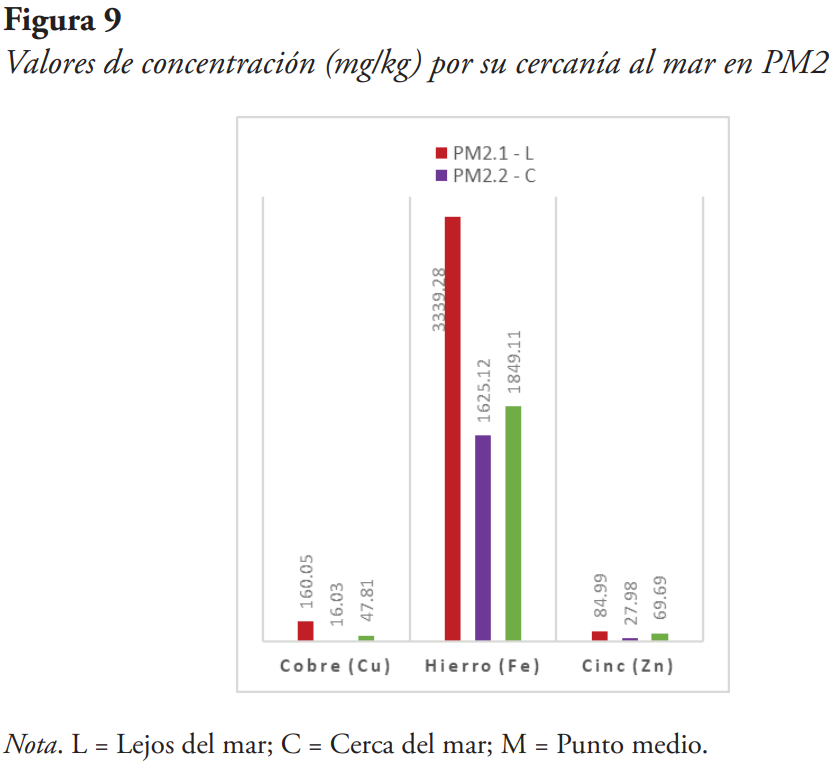
Cobre. Entre los cuatro puntos de muestreo se obtuvo la concentración más alta del metal en la muestra PM2.1, con una concentración de 160.0451 mg/kg.
Hierro. Para el hierro, el segundo punto de muestreo obtuvo la concentración más alta del metal y fue en la muestra PM2.1 con una concentración 3339.2777 mg/kg.
Cinc. Entre los cuatro puntos de muestreo, el cuarto punto obtuvo la concentración más alta del metal y fue en la muestra PM4.2, con una concentración de 174.6947 mg/kg.
Chaetomorpha gracilis
Los puntos de recolección para C. gracilis fueron PM1 y PM2, en donde se obtuvieron los valores de concentración promedio más altos del estudio (véase Tabla 6).
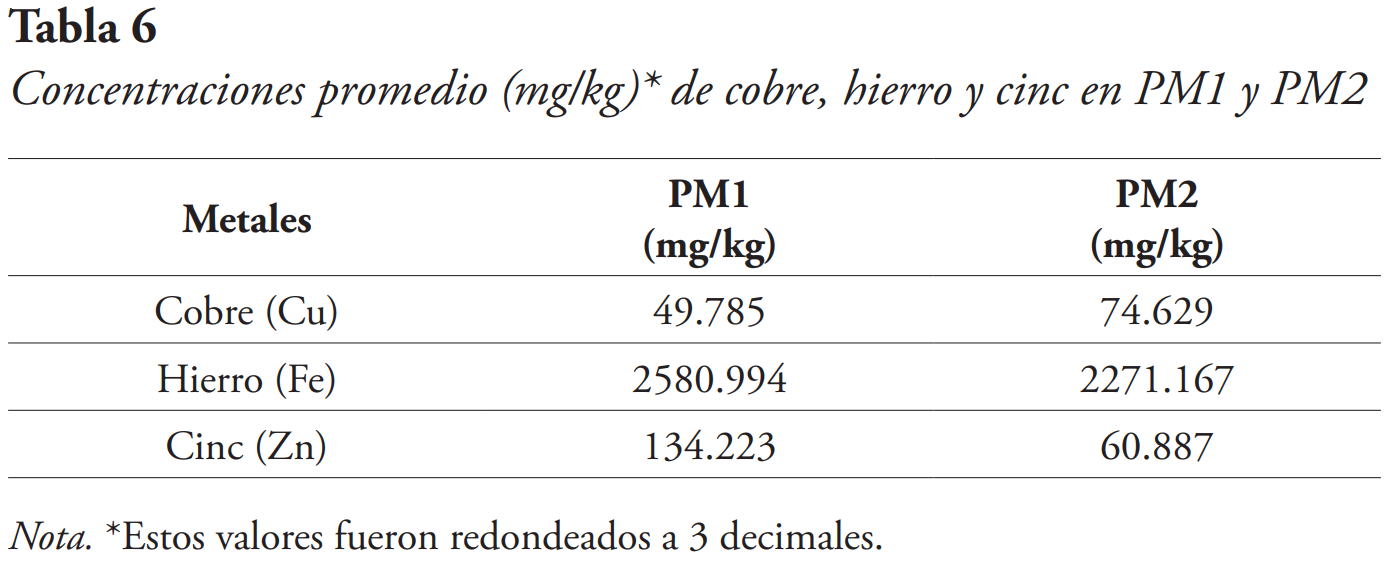
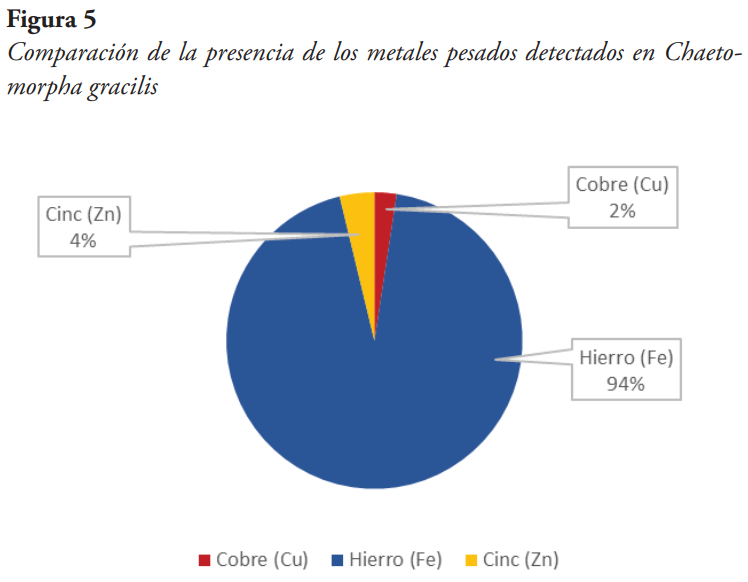
El metal con mayor presencia de los metales pesados detectados en el alga fue el hierro, estimándose a un 94 %, seguido del cinc con un 4 % y el cobre con un 2 % (véase Figura 5).
Ulva fasciata
Los puntos de recolección para U. fasciata fueron PM3 y PM4, en donde se obtuvieron valores de concentración promedio más bajos del estudio (véase Tabla 7).
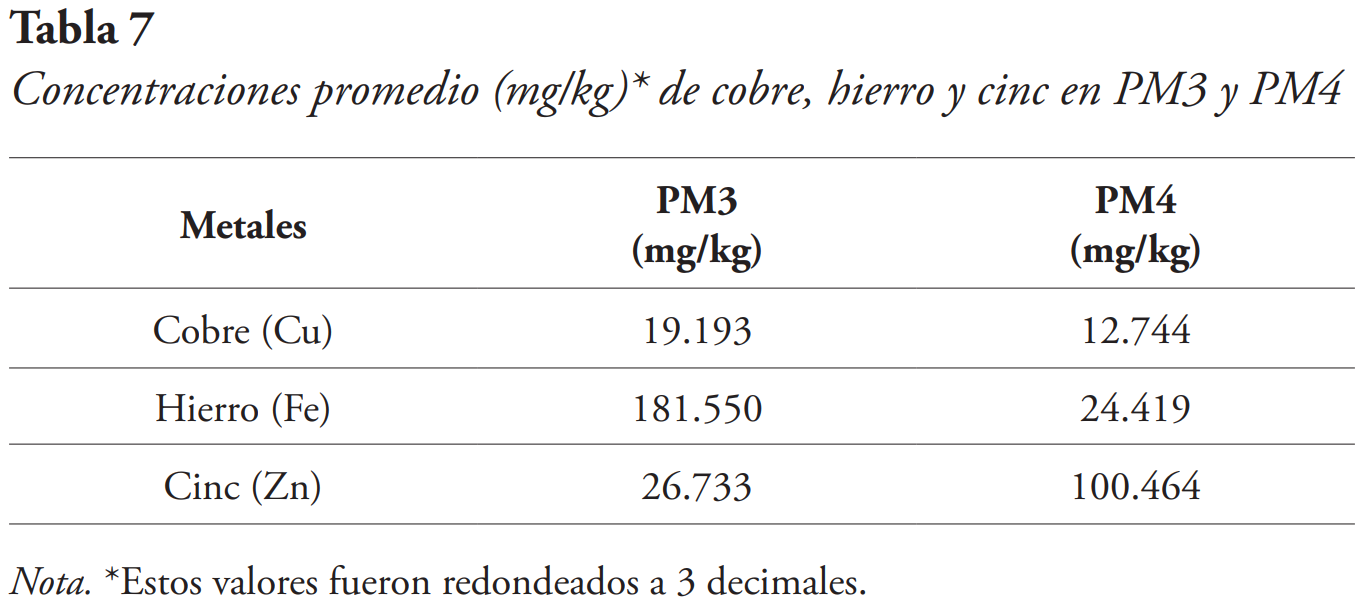
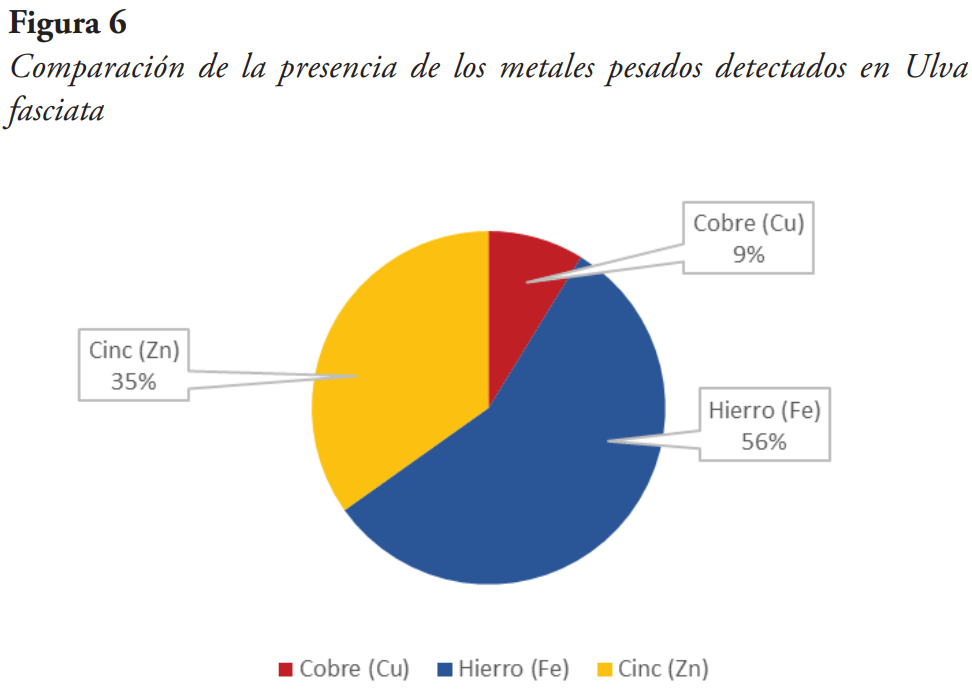
El metal con mayor presencia de los metales detectados en el alga fue el hierro, estimándose a un 56 %, seguido del Cinc con un 35 % y el cobre con un 9 % (véase Figura 6).
Variabilidad de las concentraciones promedio de U. fasciata y C. gracilis
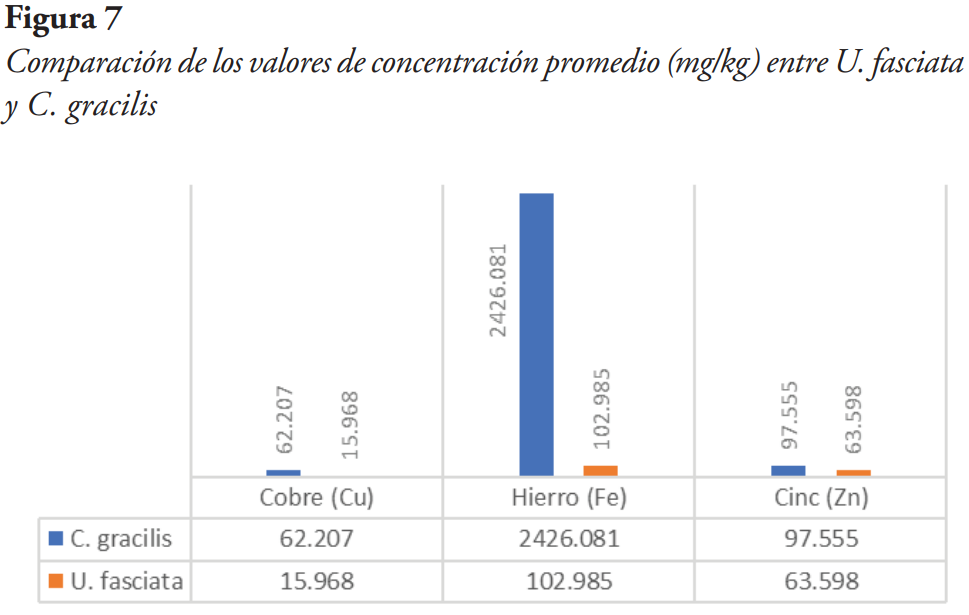
Ulva fasciata y Chaetomorpha gracilis obtuvieron concentraciones promedio muy diferentes entre los metales analizados. C. gracilis obtuvo un mayor valor de concentración de metales pesados en todos los análisis (véase Figura 7).
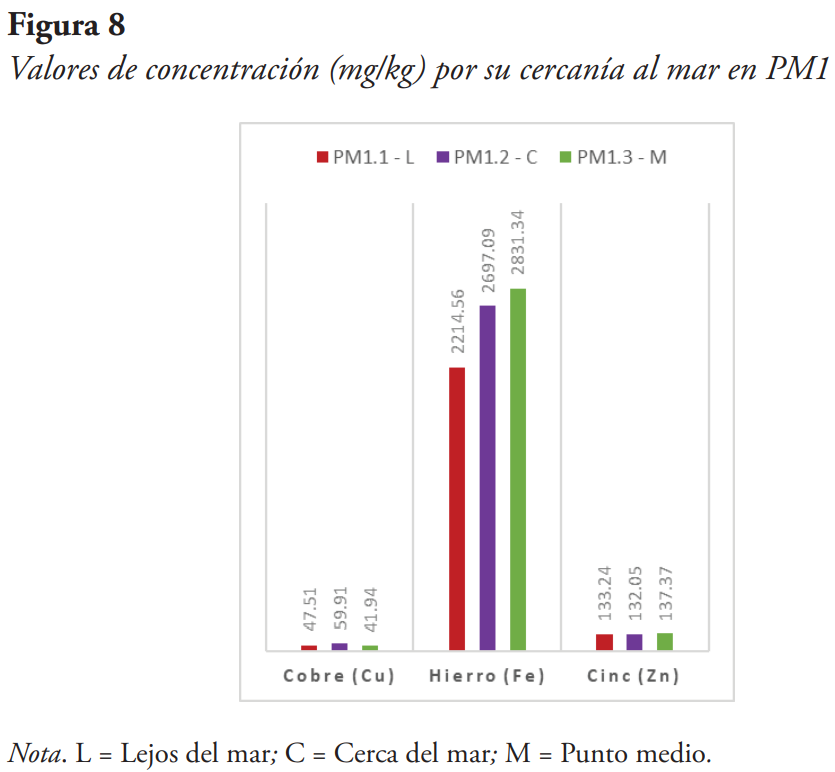
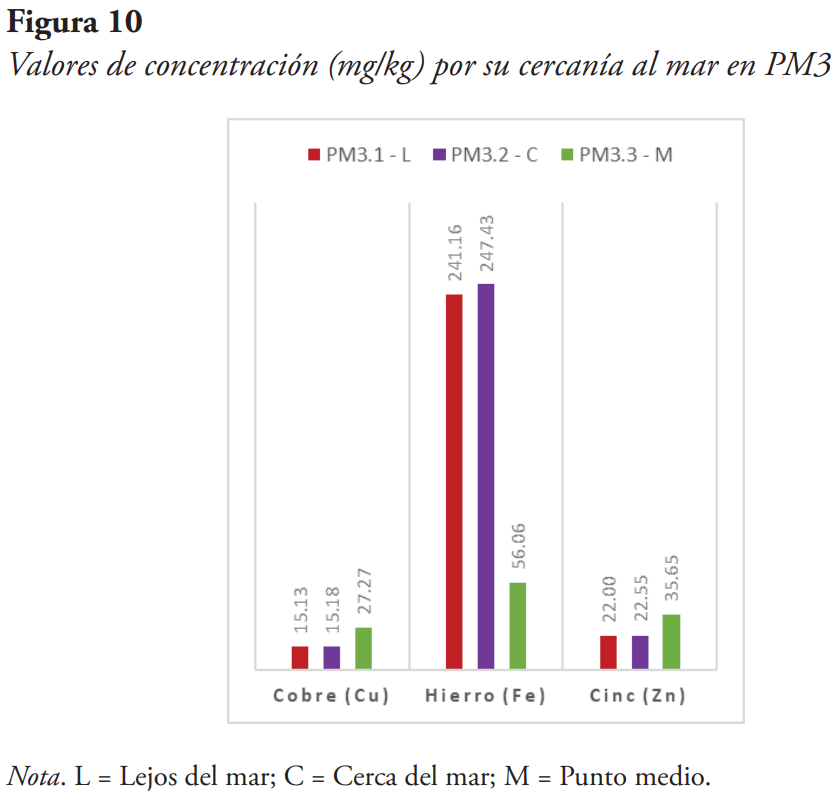
Variabilidad de las concentraciones por su cercanía al mar
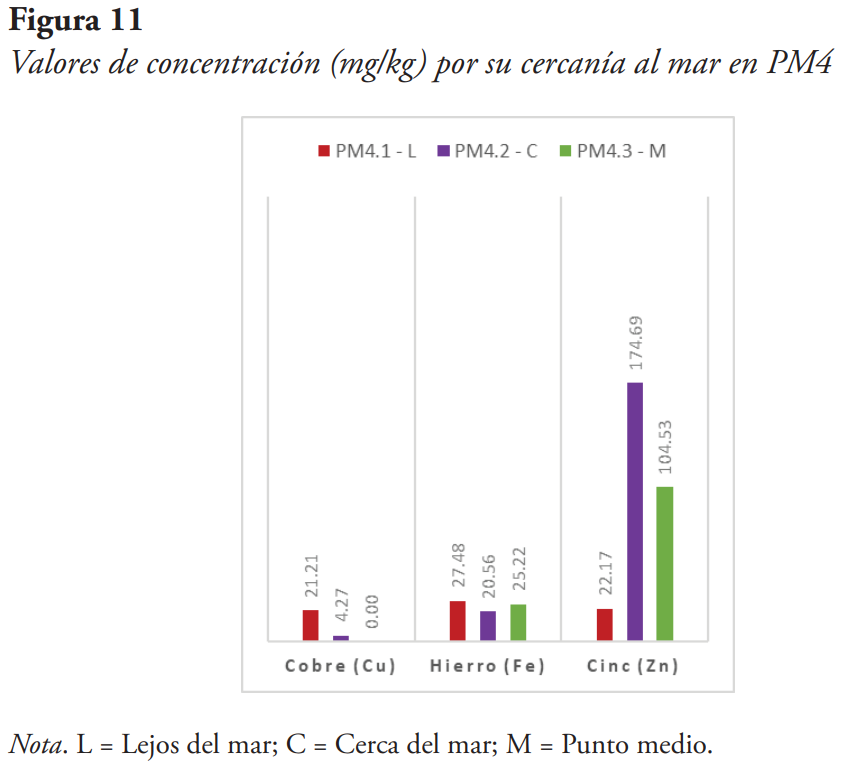
Para verificar si existe una relación entre la cercanía al mar, donde se toma la muestra, y su concentración, se colectaron estas algas en diferentes distancias subjetivas: una muestra más cercana al mar, una muestra en un punto medio y una muestra más lejana al mar (véanse Figuras 8, 9, 10 y 11).
Comparación de las concentraciones de metales pesados del estudio con investigaciones nacionales
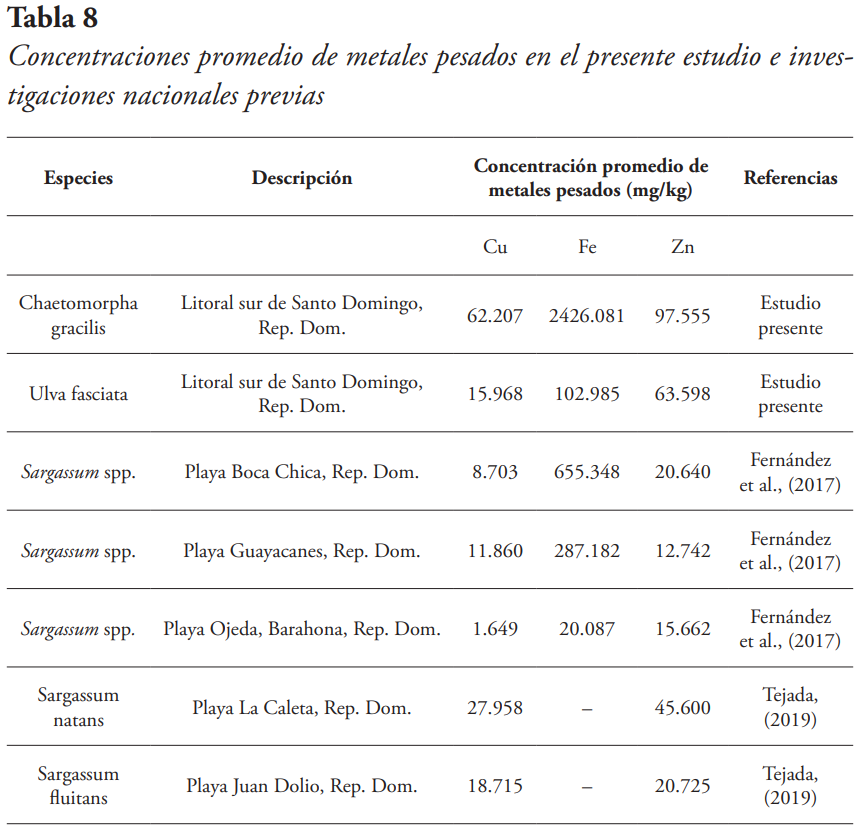
Los resultados obtenidos fueron comparados con investigaciones hechas en República Dominicana por Fernández et al. (2017) y Tejada et al. (2019), para así ver las variaciones de las concentraciones de los metales estudiados en diferentes géneros y especies de algas (véase Tabla 8).
Comparación de las concentraciones de metales pesados del estudio con investigaciones internacionales
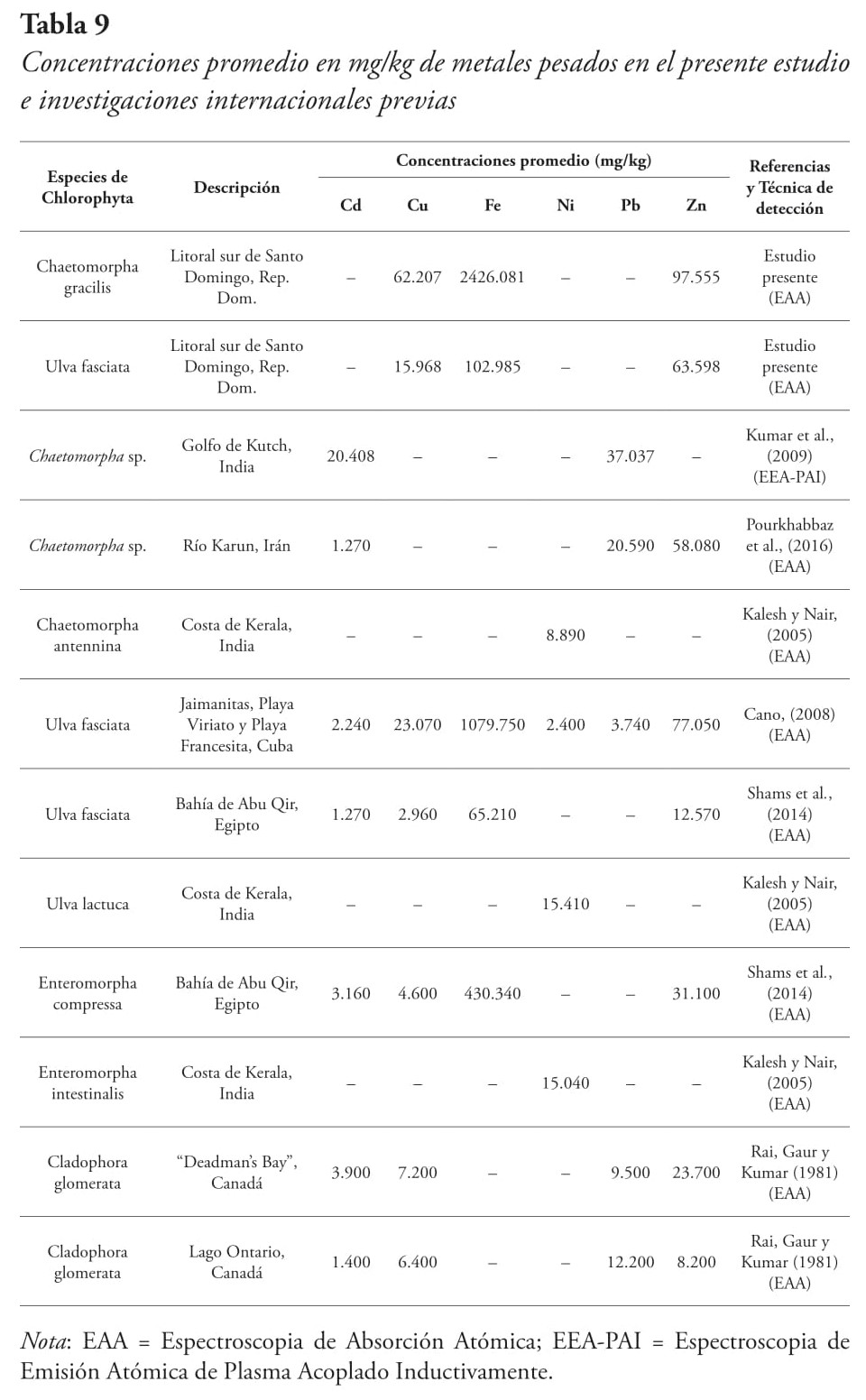
Los resultados obtenidos fueron comparados con diversas especies de la división Chlorophyta, para así ver las variaciones de las concentraciones de metales en las algas estudiadas y en otras algas verdes, provenientes de investigaciones internacionales (véase Tabla 9).
Discusión
Biosorción de metales pesados en algas
La capacidad de biosorción de metales pesados en algas son las interacciones fisicoquímicas entre los ligandos encontrados en la superficie celular y los iones metálicos presentes en el ambiente (Cuizano & Navarro, 2008). Según Navarro et al. (2007), la biosorción viene a través de la formación de complejos. En este estudio se dice que un complejo viene de la interacción de un ion metálico con orbitales de valencia vacíos (aceptor de electrones), con uno o varios ligandos con pares de electrones libres (dador de electrones). El metal se rodea de los ligandos formando un complejo. Esto explicaría la razón por lo cual los metales se mantienen adheridos a las algas. Navarro et al. (2007) explican que los ligandos que los metales pesados utilizan son aminoácidos y ácidos orgánicos, específicamente dos clases de péptidos: fitoquelatinas y metalotioneinas, los cuales muestran gran afinidad por determinados grupos funcionales, como grupos sulfhidrilo, radicales amino, fosfato, carboxilo e hidroxilo. Al final, estos ligandos son utilizados para crear complejos que tengan la facilidad de resistir la toxicidad del metal apegado.
Variabilidad de concentraciones promedio en las algas estudiadas
Se pudo observar una diferencia significativa entre las concentraciones promedio de metales pesados de las dos algas estudiadas. Una razón para esto podría ser que las algas tienen diferentes capacidades de adsorción. Esto podría llevar a pensar que la especie Chaetomorpha gracilis puede retener mayor cantidad de concentración de metales pesados en su superficie. Sin embargo, esto no es lo que se piensa, debido a que C. gracilis tiene menor área superficial en sus frondas para la retención de estos metales, comparándola a Ulva fasciata. Las frondas de C. gracilis son de menor tamaño, comparado a las de U. fasciata, por lo cual se espera ver menores valores de concentración de metales pesados (Quiroz et al., 2017). Se piensa que la verdadera razón no tiene que ver directamente con las capacidades de las algas, sino por una razón externa.
Se observó que el valor de concentración promedio del hierro en el presente estudio fue el más alto. El hierro es vital para la mayoría de los organismos vivos y, por esta razón, la mayoría de los organismos desarrollaron mecanismos específicos y de alta afinidad para adquirir este elemento. Cuando hay más hierro disponible, las células retienen más hasta llegar a un cierto límite (Botebol et al., 2014). Esto podría ser la razón del porqué los valores de concentración de hierro en C. gracilis fueron significativamente elevados, comparado a los demás metales estudiados.
Relación de la cercanía al mar y las concentraciones observadas
Se pudo determinar con las comparaciones de las figuras anteriores que, en este estudio, no existe una relación entre la cercanía al mar y las concentraciones observadas. Pensamos que se debe a dos posibles explicaciones:
- La primera explicación es que puede ser que estos metales pesados no estén acumulándose a través del mar. Esto significaría que los metales pueden estar en el suelo, en el aire o en la basura. En los puntos de muestreo PM1 y PM2 se vio una gran cantidad de basura alrededor de donde se encuentran estas algas. Aproximadamente, el 10 % de toda la basura en un lugar está compuesta de estos metales (García et al., 2002), lo cual explicaría por qué en los puntos se ve una diferencia en los valores de concentraciones de metales pesados observados.
- La segunda explicación es que esto se debe a que los lugares en donde se encuentran estas algas están los cambios de marea y oleaje. Para apoyar esta hipótesis, el oleaje de esta zona es un factor importante, ya que este suministra nutrientes y también participa en la eliminación de desechos. La fuerza ejercida por el oleaje puede ocasionar cambios en la composición de las poblaciones. Las olas, como agua en movimiento, también provocan un suministro continuo y la eliminación de factores ecológicamente significativos. Esto podría ocasionar tanto un aumento como una pérdida en las concentraciones de metales pesados, dependiendo de la fuerza del oleaje (Kingsbury, 1962).
El presente estudio y las investigaciones nacionales
Las concentraciones promedio del presente estudio fueron más altas para la C. gracilis que las algas estudiadas en las investigaciones hechas previamente en República Dominicana.
Si los metales pesados están acumulándose vía el mar, puede haber dos causantes para la elevada concentración encontrada en los puntos de C. gracilis:
- La primera causante sería que estos metales pudieran estar depositándose al mar a través del río Ozama, con base en los desechos industriales que son vertidos al río por las diferentes empresas que se encuentran en el margen de este (Mendoza, 1993; Contreras et al., 2004). Esto puede explicar por qué hay mayor concentración en los puntos más cercanos al río Ozama.
- La segunda razón sería que estos metales estén depositándose al mar a través de los alcantarillados cercanos. C. gracilis se encontró en dos puntos muy cercanos a los alcantarillados activos del litoral, por lo que se cree que esto podría estar aumentando la concentración de metales pesados en estas zonas.
El presente estudio y las investigaciones internacionales
Se pudo notar que las concentraciones promedio del presente estudio fueron mucho más para la Chaetomorpha gracilis que las que están en otras investigaciones, pero Ulva fasciata obtuvo valores similares a los demás estudios. Por igual, se pudo evidenciar en otros estudios que las especies de los géneros Chaetomorpha y Ulva sí pueden bioacumular todos los metales pesados analizados.
Para Chaetomorpha gracilis no se encontraron investigaciones de algas de este género que tuvieran los mismos metales estudiados y poder compararlos. A pesar de esto, se pudo encontrar investigaciones que sí mencionan la habilidad de adsorción para los metales no detectados: Kumar et al. (2009); Pourkhabbaz et al. (2016); Kalesh y Nair (2005). Para Ulva fasciata, los valores fueron muy diferentes a los encontrados en otros estudios. Sin embargo, la investigación de Cano (2008) nos brinda información útil para ver los valores de concentración de metales pesados en U. fasciata, ya que en esta investigación se obtuvieron valores para todos los metales analizados en el presente estudio. El valor de concentración del cobre fue el más cercano al valor obtenido de la investigación de Cano (2008).
Con base en los resultados de nuestra investigación, los géneros Ulva y Chaetomorpha pueden ser utilizados como un modelo para indicar contaminación ambiental por metales pesados. Esto coincide con las investigaciones realizadas por Haritonidis y Malea (1999), y Pourkhabbaz et al. (2016), en donde los géneros Ulva y Chaetomorpha han sido utilizados como bioindicadores de la contaminación por metales pesados.
En el presente estudio se observó que Ulva fasciata y Chaetomorpha gracilis son macroalgas representativas para la determinación de metales pesados utilizando la técnica de Espectroscopia de Absorción Atómica.
Conclusiones
Se observó, por la técnica de Espectroscopia de Absorción Atómica, la capacidad biosorción de los metales detectados en las Chlorophytas (Chaetomorpha gracilis y Ulva fasciata), para considerarlas indicadores de metales pesados. Partiendo de los resultados, la técnica por Espectroscopia de Absorción Atómica es un método factible para analizar metales pesados en algas.
Se determinó la presencia de los metales pesados: cobre (Cu), hierro (Fe) y cinc (Zn). Para U. fasciata, la concentración promedio de cobre fue de 15.968 mg/kg, de hierro fue de 102.985 mg/kg y para el cinc fue de 63.598 mg/kg. Para C. gracilis, la concentración promedio de cobre fue de 62.207 mg/kg, de hierro de 2426.081 mg/kg y para el cinc fue de 97.555 mg/kg, lo cual evidencia la importancia de la utilización de las Chlorophytas para la detección de metales pesados.
No se pudo establecer una relación entre la cercanía al mar y las concentraciones de metales pesados de las algas observadas en el litoral sur de Santo Domingo, República Dominicana, debido a patrones variables de marea y el oleaje.
Los resultados de los valores de concentración de cada metal analizado y detectado para la Chaetomorpha gracilis fueron significativamente mayores que los demás estudios nacionales e internacionales.
El problema de la contaminación en zonas costeras de la República Dominicana ha incrementado y afecta la funcionalidad de los ecosistemas costeros-marinos. Los cambios bruscos en las relaciones tróficas, el incremento en nutrientes y los contaminantes químicos aportados por los procesos industriales son cada vez más incidentes.
Agradecimientos
Agradezco al INTEC y sus docentes. A la Vicerrectoría de Investigación de INTEC por facilitarme financiar los análisis de laboratorio dentro del marco del proyecto “Producción de carbón activado a partir de sargazo y estudio de su potencial para el tratamiento de efluentes”, financiado por FONDOCYT.
Le agradezco al Dr. Ricardo A. Martínez y al Ing. Augusto De Peña, por asistirme en la recolección de muestras.
Muchas gracias a ALTOL Dominicana, por sus servicios y esfuerzo en la elaboración de la metodología empleada en este trabajo, y a Oniel Álvarez del Instituto de Investigaciones Botánicas y Zoológicas (IIBZ) de la Universidad Autónoma de Santo Domingo, en la asistencia de la identificación a nivel de especie de las algas.

