1. Introducción
La contaminación de las aguas superficiales, subterráneas y residuales ha aumentado en los últimos años debido a la presencia de los llamados contaminantes emergentes, como los medicamentos y los pesticidas (Fekadu, Alemayehu, Dewil, & Van der Bruggen, 2019; Li Puma & Yue, 1999). La incidencia de estos contaminantes es de gran interés, debido a la escasa información disponible sobre sus efectos en el medio ambiente o sus interferencias en los procesos biológicos. Muchas investigaciones reportan la ineficiencia de las plantas de tratamiento de aguas residuales convencionales (PTAR) y, como resultado, la presencia de contaminantes en los efluentes de las plantas de tratamiento, los ríos, los lagos y, en menor medida, las aguas subterráneas (Lawrence, Tavengwa, & Chimuka, 2017). El diazepam (7-cloro-1,3-dihidro-1-metil-5-fenil-2H-1,4-benzodiazepin-2-ona) y el midazolam (8-cloro-6-(2-fluorofenil)-1-metil-4H-imidazo[1,5-a][1,4]benzodiazepina) (Tabla 1) son las benzodiazepinas más prescritas por sus propiedades hipnóticas, tranquilizantes y anticonvulsivas. Los niveles de notificación en los cuerpos de agua van desde 9,5 ng L-1 hasta 1 μg L-1 (Ashfaq et al., 2017; Catalá et al., 2015; Hass et al., 2012; Hummel et al., 2006; Bautitz 2012; Kosjek et al., 2012; López, et al., 2010; Meng et al., 2016; Paredes et al., 2018; Subedi & Kannan, 2015; Yanga et al., 2018; Yuan et al., 2013) (Ye et al., 2021). Llama la atención el aumento de concentración de benzodiacepinas y otros ansiolíticos en aguas residuales en varias comunidades durante la pandemia de COVID-19 (Montgomery, 2021).
La exposición de los organismos acuáticos a hipnóticos-sedantes afecta la reproducción y las funciones endocrinas, entre otras (Petrie, Barden, & Kasprzyk-Hordern, 2015; Subedi & Kannan, 2015) (Lebreton et al., 2021; Lei et al., 2021; Subedi et al., 2021). La unión de DZP con los receptores GABA en el cerebro de los peces puede afectar sus respuestas de comportamiento, así como causar problemas con la reproducción de organismos acuáticos (Lorenzi, Choe, Schlenk, 2014).
Los estudios han demostrado que la exposición de DZP en los peces provoca efectos ansiolíticos, así como alteraciones en el comportamiento de la natación y la expresión de genes circadianos. También se ha reportado una disminución en el comportamiento grupal, la presencia de pigmentación oscura y el comportamiento anormal con respecto al letargo y la preferencia por nadar cerca de la superficie; además, que la presencia de drogas psicoactivas en los ecosistemas acuáticos podría causar disfunción neuroendocrina en peces Danio rerio y cucaracha (Abreu et al., 2014; David, Lange, Tyler, & Hill, 2018). Las modificaciones en las funciones endocrinas y los valores de exposición de 1 ng mL-1 de DZP causan modificaciones en los genes esteroidogénicos (Overturf, Overturf, & Huggett, 2016), a diferencia del MDZ, cuyos efectos nocivos en los organismos acuáticos no han sido ampliamente estudiados.
Teniendo en cuenta el alto impacto de los productos farmacéuticos en los ecosistemas, es sumamente importante eliminarlos de las aguas residuales antes de la descarga a los cuerpos acuáticos receptores. Las investigaciones llevadas a cabo en los últimos años apuntan al uso de procesos avanzados de oxidación (PAOs) como tecnologías innovadoras en la eliminación de contaminantes persistentes. Los PAOs producen cambios en la estructura química de los contaminantes, a través del ataque de radicales hidroxilos (HO•), los cuales son altamente reactivos y pocos selectivos (Ribeiro, 2015). Estos radicales tienen un alto poder oxidante (E = 2.80 V), baja selectividad y pueden generarse por medios fotoquímicos (incluida la luz solar) u otras formas de energía externa (Mohapatra, 2014; Ortız de la Plata, 2012; Quero, 2014).
Entre los métodos más utilizados como procesos de oxidación avanzada para la degradación de medicamentos se encuentran la radiación gamma, el ultrasonido de alta frecuencia, la radiación ultravioleta (artificial y natural) y la ozonización, combinados con agentes oxidantes como el peróxido de hidrógeno y el reactivo de Fenton, entre otros (Adityosulindro et al., 2017; Durán, Monteagudo & Martín, 2018; Kanakaraju, Glass & Oelgemoller, 2018).
Fundamentalmente, en la degradación del diazepam por PAOs se han publicado trabajos relacionados con el uso de la fotólisis asociada con agentes oxidantes donde el porcentaje de degradación alcanzado oscila entre un 80 % y un 96 %, con una mineralización del 60 % a los 60 minutos (Bautitz, 2012; Bautitz, 2010; Sulaiman, 2017). En el caso del midazolam, no se reportan estudios de degradación mediante el uso de procesos avanzados de oxidación; sin embargo, nadie ha publicado un trabajo en el que se haga sistemáticamente una comparación entre varios de estos métodos, razón por la cual en este estudio se comparan tres de los métodos de oxidación avanzada más estudiados.
Materiales y métodos
Se realizó una búsqueda en bases de datos especializadas (Chemical Abstract y Science Direct) que abarcó el período 1996-2019. Se utilizaron como palabras clave: ultrasonido de alta frecuencia, radiación gamma, radiación UV, diazepam, midazolam, benzodiacepinas, aguas residuales, compuestos orgánicos persistentes y tratamiento de residuales líquidos. La búsqueda bibliográfica se realizó en inglés, combinando las palabras clave con la utilización de operadores lógicos.
Resultados y discusión
Contaminación de las aguas con compuestos orgánicos persistentes
La contaminación de las aguas constituye uno de los problemas más alarmantes que afecta a todos los países por igual: subdesarrollados, en vías de desarrollo y desarrollados. Este problema viene dado por el vertiginoso desarrollo tecnológico, conjuntamente con el elevado crecimiento sociocultural, los cuales, si bien influyen en el progreso económico y social, también son responsables del origen de gran cantidad de residuos que pueden atentar contra el equilibrio ecológico de la Tierra. Entre los contaminantes emergentes, se encuentran los fármacos y los pesticidas, que por su persistencia en el medio pueden causar efectos nocivos a la salud humana y al medio ambiente (Cizmas, Sharma, Gray & McDonald, 2015; Rivera, Sánchez, Ferro, Prados & Pérez, 2013).
Dentro de los contaminantes emergentes, se encuentran los productos farmacéuticos, las drogas de abusos, los productos de cuidado personal y aquellos relacionados con el estilo de vida de las personas, como la cafeína, los cuales se han detectado en los efluentes de plantas de tratamiento de agua residual y en los ecosistemas acuáticos que lo reciben (Bautitz, 2012; Yanga et al., 2018). El estudio de estos contaminantes constituye una de las principales preocupaciones a nivel mundial, pues algunos de ellos son disruptores endocrinos y su exposición puede dar lugar a alteraciones en el crecimiento, el desarrollo, la reproducción y el comportamiento de los organismos acuáticos (Stuart, Lapworth, Crarie & Hart, 2012; Phung et al., 2017). Además, numerosos estudios han demostrado la presencia de productos de transformación y metabolitos, algunos de los cuales son potencialmente más tóxicos, más recalcitrantes e incluso más bioacumulables que los contaminantes precursores (Torun, Solpan, & Güven, 2014). De manera general, pueden ser tóxicos y persistentes, pues a pesar de ser emitidos en muy bajas concentraciones, su emisión se realiza de manera continua, lo que facilita su detección en los sistemas acuíferos (Yanga et al., 2018; Bautitz, 2012; Metcalfe et al., 2011; Santos et al., 2010; Spongberg et al., 2011).
Los productos farmacéuticos llegan a los ecosistemas por diferentes rutas, a través de la excreción post-consumo por humanos y animales, la disposición inadecuada de medicamentos, el vertimiento de aguas residuales de las industrias farmacéuticas, la administración directa sobre cuerpos de agua o estanques en acuicultura (Cardoso, Porcher, & Sanchez, 2014; Godoy, Kummrow, & Pamplin, 2015; Prieto, Díaz, & Hernández, 2016; Taylor & Senac, 2014). Por otra parte, las plantas de tratamiento no garantizan la remoción de los contaminantes emergentes, por lo que contribuyen a la persistencia de estos en los cuerpos de aguas (Bautitz, 2012; Rizzo, Della, Fiorentino, & Li Puma, 2014; Yanga et al., 2018). Los efluentes y lodos de las plantas de las estaciones depuradoras de aguas residuales están diseñadas para eliminar materiales sólidos y reducir los niveles de metales, bacterias y otros patógenos; sin embargo, son poco eficientes e incapaces de degradar determinados compuestos orgánicos (Pereira, Silva, Meisel, Lino, & Pena, 2015; Rothenberg et al., 1993; Valdez, Reyes, Cedeño, Ordaz, & Acuña, 2008). Diversos estudios reportan su presencia en aguas superficiales y subterráneas en concentraciones de hasta miles de μg L-1 o μg kg-1, que se distribuyen en dependencia de sus propiedades físico-químicas, metabolitos, productos de degradación y características de los suelos (Ballesteros Lara, 2011; Mendoza, Aceña, Pérez, de Alda, Barceló, Gil, Valcárcel, 2015; Mendoza et al., 2013; Quesada, Haza, Wilhelm, & Delmas, 2009; Yanga et al., 2018).
Los fármacos hipnóticos-sedantes son sustancias que tienden a deprimir el sistema nervioso central sin afectar el estado de ánimo ni reducir la sensibilidad al dolor. Las benzodiacepinas pertenecen a este grupo y tienen un grado variable de efecto sedante, hipnótico, amnésico, ansiolítico, anticonvulsivo y relajante muscular. Es por eso que en la actualidad son las drogas más ampliamente prescriptas a nivel mundial, dando lugar a su utilización indiscriminada e irracional por millones de usuarios crónicos (Brandt, Alkabanni, Alessi-Severini, & Leong, 2018). Su estructura química básica es la 1,4 benzodiacepina, que presenta un anillo heterocíclico de cinco átomos de carbono y dos de nitrógeno que contienen un grupo carboxamida unido a dos anillos aromáticos con cuatro grupos fundamentales en los que se hacen sustituciones con grupos nitro o halogenados, sin pérdida de la actividad farmacológica (USP-37, 2014). Su compleja estructura química, conjuntamente con su uso masivo, constituyen las causas fundamentales de su persistencia en el medio ambiente, donde los niveles de concentración varían en dependencia de la tasa de producción, la dosis y la frecuencia de uso, el metabolismo y la eficacia de eliminación en las plantas de tratamiento. Según el informe de la Junta Internacional de Fiscalización de Estupefacientes (INCB, 2013) la fabricación mundial comunicada de sedantes hipnóticos de tipo benzodiacepínico fue de 7,700 millones de dosis diarias, definida con fines estadísticos (S-DDD). Para esa fecha, Cuba ocupaba el lugar 25 con el registro más alto de consumo de sedantes hipnóticos de tipo benzodiacepínico en el mundo y el segundo en América Latina, solo superado por Argentina, con 31,60 S-DDD por cada 1,000 habitantes.
El desarrollo de nuevos fármacos y su introducción al medio ambiente supone un reto en el estudio de nuevas tecnologías que permitan la remoción eficiente de estos compuestos en los sistemas acuáticos, así como el estudio de las causas adversas a los organismos que en ellas viven. En esa misma línea, también los efectos nocivos que le ocasiona al hombre el consumo de aguas o alimentos contaminados por estas moléculas.
En la búsqueda realizada para el período de 1996-2021 en la base de datos Science Direct, que proporciona acceso por suscripción a una gran base de datos de investigación científica, se han publicado una gran variedad de artículos científicos que relacionan la presencia de fármacos en las aguas, el desarrollo e implementación de tecnologías novedosas para la remoción de los llamados compuestos persistentes y el incremento en el desarrollo y la elaboración de nuevos fármacos por parte de la industria farmacéutica. La búsqueda en estas temáticas fue realizada con los términos pharmaceutical + wastewater + detection (ocurrence)” y “pharmaceutical + wastewater + degradation (removal).
Estos datos confirman el crecimiento exponencial de los estudios sobre la contaminación de los cuerpos de aguas con fármacos; no obstante, la investigación referente a la producción de compuestos farmacéuticos continúa siendo miles de veces superior. Por tanto, el campo de estudio del tratamiento de las aguas contaminadas con fármacos de interés emergentes contiene muchas lagunas del conocimiento y constituye uno de los temas prioritarios en la preservación y el cuidado de los acuíferos, así como la salud humana. Dentro de estos contaminantes encontrados en los cuerpos de aguas superficiales y en los sistemas de las plantas de tratamientos se encuentran las benzodiazepinas.
El diazepam (DZP) (7-cloro-1,3-dihidro-1-metil-5-fenil-2H-1,4-benzodiazepin-2-ona) y el (MDZ), (8-cloro-6-(2-fluorofenil)-1-metil-4H-imidazo [1,5-a][1,4]benzodiazepina), representan el 23 % y 8 %, respectivamente, de la fabricación total comunicada de ansiolíticos de tipo benzodiacepínico de las previsiones con fines médicos que Cuba reporta a la INCB.
Sus altos niveles de fabricación están relacionados directamente con sus niveles de consumo, pues son las benzodiacepinas que más suelen ser objeto de desviación y abuso (INCB, 2013). La tasa de eliminación es menor a un 10 %, lo que está relacionado con la presencia del halógeno en su estructura química, reduciendo significativamente su susceptibilidad a la biodegradación (Echevarría et al., 2019; Kosjek et al., 2012). Es por este motivo que constituye una de las más ampliamente investigadas por diversos autores en gran cantidad de países, pues constantemente se ha reportado la presencia de este fármaco en aguas residuales y de consumo (Tabla 1).
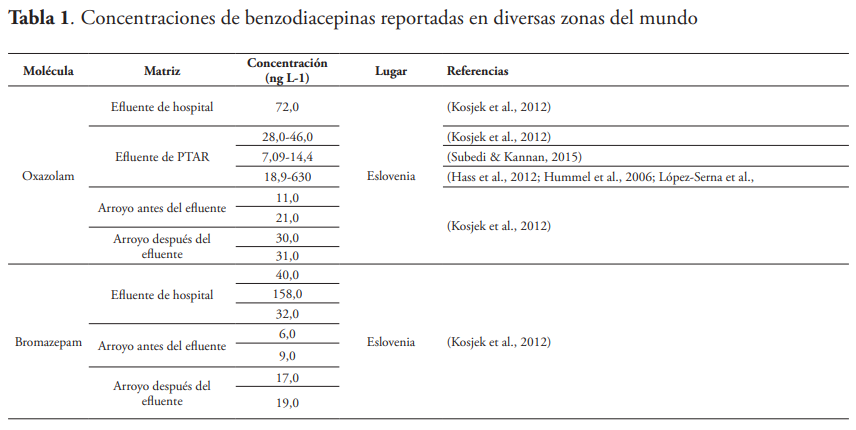
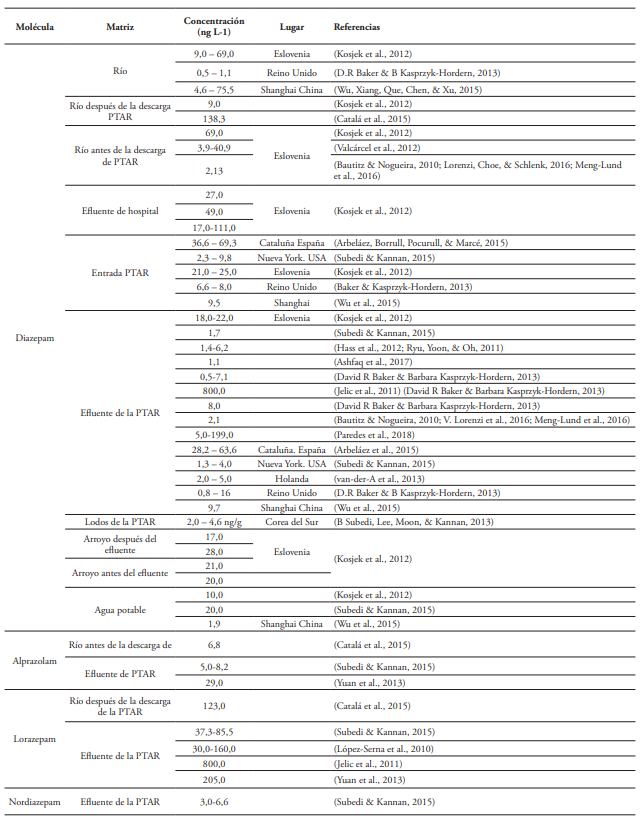
Eliminación de los fármacos en las aguas
El tratamiento de aguas residuales consiste en la aplicación de procesos físicos, químicos y biológicos con el objetivo de eliminar los contaminantes presentes en aguas residuales y potables (Overturf et al., 2016). Su aplicación depende, fundamentalmente, de la naturaleza y de las propiedades físico-químicas de las aguas o los efluentes a tratar, y se clasifican de acuerdo a la finalidad que se logre con cada cual. Los tratamientos primarios son aquellos donde se produce un asentamiento de sólidos mediante tratamientos mecánicos; los secundarios, donde se trata la materia orgánica disuelta mediante procesos biológicos; y los terciarios, donde se logra adecuar el efluente del tratamiento secundario para su vertimiento final o reutilización, y tienen como fin la eliminación de los contaminantes orgánicos no eliminados con anterioridad (Caban, Kumirska, Bialk-Bielińska, & P, 2015; Gao et al., 2016).
Los tratamientos convencionales de aguas residuales resultan inadecuados para tratar los contaminantes emergentes, pues no alcanzan el grado de pureza requerido por las regulaciones ambientales de vertimiento o por el uso ulterior del efluente tratado (Bouissou et al., 2014; Van der Aa et al., 2013). Es por esto que cada día cobran mayor auge los Procesos Avanzados de Oxidación (PAOs), los cuales pueden aplicarse solos o como procesos complementarios a los ya existentes, como la floculación, absorción, combustión, ósmosis inversa y nanofiltración (Bagheri, Afkhami, & Noroozi, 2016; Caban et al., 2015; Gadipelly & Pérez-González, 2014).
Procesos avanzados de oxidación
Los PAOs son procesos físico-químicos capaces de producir cambios en la estructura química de los contaminantes, mediante el ataque de radicales altamente reactivos y poco selectivos como es el caso de las radicales HO• (Doménech, Jardim, & Litter, 2014; Ribeiro et al., 2015). Estos radicales tienen gran poder oxidante (E = 2,80 V) (Glaze, 1987), poca selectividad y se pueden generar por medios fotoquímicos (incluida la luz solar) o por otras formas de energía. La oxidación de la materia orgánica suele ocurrir por dos vías diferentes: mediante la abstracción de un átomo de hidrógeno o por adición electrofílica a dobles enlaces, generándose radicales orgánicos libres, propiciando una serie de reacciones de degradación oxidativa que pueden conducir a la completa mineralización de los contaminantes. La constante de velocidad de reacción de los radicales hidroxilos con moléculas orgánicas está en el rango de los 106-109 M-1s-1 (Rivera, Sánchez, Ferro, Prados, & Ocampo, 2013), dando lugar a dióxido de carbono, agua y productos menos perjudiciales o inorgánicos (An et al., 2015; Asghar, Raman, & Daud, 2015). Los PAOs pueden combinarse con diferentes reactivos en dependencia de los requerimientos específicos de cada residual.
Parámetros que influyen en la eficiencia de los PAOs
Además de los parámetros específicos vistos anteriormente para cada PAO, existe una serie de parámetros comunes a estos y que influyen de igual forma en su eficiencia.
Efecto de la temperatura
El papel de la temperatura en la eficiencia de los PAOs está relacionado con su influencia sobre la producción de radicales HO•. Existen PAOs que son muy dependientes de este parámetro, como la ozonización, donde la eficiencia del proceso aumenta con la disminución de la temperatura, debido fundamentalmente a la mayor solubilidad del O3 a bajas temperaturas (Cunha, 2022; Von Sonntag & Von Gunten, 2012). De igual forma, según la ley de Arrhenius, es de esperar que con el aumento de la temperatura en la reacción Fenton aumente la generación de radicales HO•; sin embargo, varios estudios han reportado un valor óptimo alrededor de los 40 ºC, debido a la acelerada descomposición del H2O2 en oxígeno y agua a temperaturas superiores a los 30 ºC (Babuponnusami & Muthukumar, 2014; Dükkancı, Gündüz, Yılmaz, & Prihod’Ko, 2010). En el caso de los procesos ultrasónicos, valores elevados de temperatura tienen un efecto negativo, debido a que aumentan la cantidad de vapor en las burbujas de cavitación, amortiguando la implosión de estas y aumentando así el número de burbujas, atenuándose la propagación de la onda ultrasonora (Darsinou, Frontistis, Antonopoulou, Konstantinou, & Mantzavinos, 2015; Mason & Lorimer, 2002).
Efecto del pH en los PAOs
La influencia del pH en la degradación de contaminantes ha sido estudiada para los diferentes PAOs. Los compuestos se comportan de manera diferente en medios ácidos, neutros y alcalinos, por sus capacidades de protonación y deprotonación que facilitan el proceso de degradación. Diferentes autores reportan una mayor eficiencia en la degradación de contaminantes en medio ácido, que decrece a medida que aumenta el pH del medio (De Bel, Dewulf, De Witte, Van Langenhove, & Janssen, 2009; J. Wang and L. Chu, 2016), mientras que algunos reportan una máxima eficiencia en la degradación en medios altamente ácidos (Zheng & Lu, 2011). Para los procesos basados en la reacción Fenton, es imprescindible trabajar a pH ácidos (inferior a 3), debido a la solubilidad del hierro.
Efecto de la concentración inicial del contaminante
Frente a la misma concentración de radicales HO•, el porcentaje de degradación de un compuesto está en dependencia de su concentración inicial. Diferentes autores reportan que, a medida que la concentración inicial aumenta, el porcentaje de degradación de los contaminantes en cuestión disminuye, por causa de una insuficiencia en la cantidad de radicales HO• (Iqbal, 2015; Quesada, Carine, Ulises-Javier, AnneMarie, & Henri, 2009; Sayed, 2015).
Efecto de la composición química de la matriz
El efecto de la composición química del agua en la eficiencia de los PAO es fundamental para la aplicación real de estas técnicas, puesto que las aguas naturales, usualmente, contienen concentraciones significativas de sustancias orgánicas e inorgánicas (Qourzal et al., 2006). La presencia de iones inorgánicos y otros compuestos orgánicos afectan la eficiencia de estos procesos, retardando la velocidad de degradación de los contaminantes que se quieren eliminar, debido a una competición por los radicales HO• disponibles (Sirtori, Agüera, Gernjak, & Malato, 2010; Von Sonntag & Von Gunten, 2012).
Proceso Avanzado de Oxidación - Sonólisis
Las ondas ultrasónicas son aquellas que tienen frecuencias superiores a las que pueden ser percibidas por el oído humano (16 kHz) e inferiores a 1 GHz. Cuando una onda ultrasonora se propaga en un medio líquido, ocurre el fenómeno conocido como cavitación acústica. La disminución de presión en un punto determinado da lugar a la formación de burbujas de vapor o de gas, las cuales crecen, oscilan e implosionan bajo la acción del campo ultrasonoro. El tiempo de vida de las burbujas de cavitación es del orden de los microsegundos y la implosión violenta de estas genera, de manera localizada y transitoria, altas temperaturas (5000 ℃ en el interior de la burbuja), altas presiones (100 MPa) y la formación de radicales altamente reactivos como los hidroxilos (HO•), los hidroxiperoxilos (HO•2) y el peróxido de hidrógeno (H2O2). Las condiciones creadas al momento de la implosión favorecen tanto las reacciones de oxidación como los radicales formados, por lo que, para lograr los efectos deseados, es necesario tener en cuenta los parámetros propios de la onda, como frecuencia e intensidad, así como las propiedades del medio y las condiciones operatorias del sistema. Las reacciones 1-16 muestran la sonólisis en solución acuosa y la subsecuente oxidación de contaminantes en presencia del US (Quesada et al., 2009).
(1) (2) (3) (4) (5) (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16)
El US ha sido evaluado constantemente en el tratamiento de aguas contaminadas con compuestos aromáticos, alifáticos clorados, herbicidas y pesticidas, compuestos orgánicos sulfurados, alcoholes, fármacos, productos cosméticos, patógenos y bacterias (Bremner, Burgess, & Chand, 2011; Cruz et al., 2015; Xu, 2014), lo que evidencia su efectividad para tratar cualquier agua residual. Sin embargo, la ineficiente conversión de energía en la producción de cavitación acústica y la dificultad ante un posible escalado provocan la inexistencia de instalaciones industriales para el tratamiento de aguas residuales con esta técnica. En los últimos años, las investigaciones se han centrado en la combinación de esta con otros procesos, lo que facilita la disminución del costo de tratamiento y una mejora en cuanto a la eficiencia de degradación. Se han reportado estudios combinados con ozono (Ji, Zhang, & Wu, 2012), radiación UV (Naddeo, Landi, Belgiorno, & Napoli, 2009), peróxido de hidrógeno (Lastre, Cruz, Nuevas, Jáuregui, & Teixeira, 2015), reactivo de Fenton (Siddique, Farooq, & Price, 2014), fotoFenton (Araújo, Antonelli, Gaydeczka, Granato, & Malpass, 2016), fotocatálisis (Ziylan, Koltypin, Gedanken, & Ince, 2013), y enzimas (Chakma, Praneeth, & Moholkar, 2017). En muchos casos, los procesos de US se ven limitados por presentar una velocidad lenta de mineralización, debido al comportamiento refractario de los intermediarios que se forman (Gogate, 2008), por lo que la generación adicional de radicales libres que resulta de la combinación de estos dos procesos debe mejorar la mineralización total en el sistema (Chakinala, Gogate, Burgess, & Bremner, 2009).
Influencia de los parámetros de operación La intensidad ultrasonora
La intensidad ultrasonora es la relación entre la potencia de entrada al sistema y el área de irradiación, siendo uno de los parámetros importantes a controlar en su aplicación en la degradación de los contaminantes, ya que en los procesos de cavitación acústica existe un límite por encima del cual la cavitación es tan fuerte que se forma una capa de burbujas en la superficie emisora que amortigua el paso de las ondas y disminuye el impacto de estas (Torres & Serna, 2018).
Frecuencia
La frecuencia ultrasónica afecta el proceso de cavitación modificando el tamaño de la burbuja formada, así como su tiempo de vida. Un incremento en la frecuencia induce un tiempo más corto en el colapso de la burbuja y, por ende, un tamaño menor. Es por esto que la frecuencia utilizada va a determinar el radio de resonancia de la burbuja formada, así como el tiempo de vida de estas (Thompson & Doraiswamy, 1999). Por ejemplo, a 20 kHz, el radio de resonancia de las burbujas de cavitación es de aproximadamente 170 µm, y el tiempo de vida es del orden de 1-100 μs. Bajo estas condiciones, la implosión de la burbuja ocurre después de varios ciclos de compresión y expansión, lo que conlleva, de un lado, a la recombinación de los radicales formados e impide la transferencia de estos a la fase líquida. Por el contrario, a frecuencias medias (300-1000 kHz), el radio de resonancia de las burbujas de cavitación es extremadamente pequeño (aproximadamente 4,6 μm a 500 kHz), y el tiempo de vida es de aproximadamente 0,4 μs como promedio. Por tanto, a mayor frecuencia, el tamaño de la burbuja de cavitación es más pequeña y la energía liberada durante el colapso es menor; empero, se ha constatado que los efectos radicalarios son mayores a estas frecuencias. Los radicales HO• pueden ser expulsados más eficientemente a la fase líquida antes de tener tiempo para recombinarse en la burbuja de cavitación (Thompson & Doraiswamy, 1999). Por otro lado, a bajas frecuencias la burbuja tiene un mayor tiempo de crecer, lo cual implica un colapso violento, generando ondas de choque y efectos mecánicos. Numerosos trabajos han estudiado el efecto de la frecuencia, concluyendo que el rango óptimo de frecuencias depende de la molécula contaminante y del transductor utilizado (Bautitz, Velosa, & Nogueira, 2012; Goel, Hongqiang, Mujumdar, & Ray, 2004; Güyer & Ince, 2011; Manariotis, Karapanagioti, & Chrysikopoulos, 2011; Quesada et al., 2009; Xiao, He, Diaz-Rivera, Pee, & Weavers, 2014). La degradación de compuestos volátiles se ve favorecida a bajos valores de frecuencia, mientras que la eliminación de compuestos no volátiles aumenta generalmente con el aumento de la frecuencia, existiendo un valor óptimo por encima del cual los efectos en la degradación son negativos (Goel et al., 2004).
Potencia ultrasónica
Algunos investigadores reportan la existencia de un valor óptimo por encima del cual el efecto sonoquímico es reducido debido a la coalescencia de las burbujas de cavitación, resultando en bajas presiones al implotar (González et al., 2010; Sivakumar & Pandit, 2001). Igual que la frecuencia ultrasónica, la potencia en los procesos sonoquímicos depende del transductor.
Tendencias
Son pocos los estudios enmarcados en el empleo del ultrasonido para la eliminación parcial o total de contaminantes orgánicos persistentes, esto ocasionado por la variabilidad de optimización de las condiciones operacionales como la frecuencia y la potencia ultrasónica, las cuales fluctúan dependiendo de las propiedades químico-físicas de las moléculas a degradar. Por otra parte, el bajo porcentaje de degradación y de mineralización alcanzado por esta técnica y los tiempos prolongados del tratamiento del residual líquido propician una baja aplicabilidad para la eliminación de fármacos. Debido a estas deficiencias, no se reportan estudios de su empleo para la degradación de benzodiacepinas, dentro de las cuales el diazepam y el midazolam son dos de los fármacos más representativos de esta familia.
Proceso Avanzado de Oxidación – Radiación gamma
Las radiaciones ionizantes son aquellas que ionizan la materia y extraen los electrones de sus estados ligados al átomo. Estas pueden provenir de sustancias radiactivas, en las cuales la radiación es espontánea; o de generadores artificiales, como los generadores de Rayos X y los aceleradores de partículas (Nielsen & McMorrow, 2011; Uhlig et al., 2015). La interacción de las radiaciones ionizantes con el agua se divide en tres etapas: física, físico-química y química. La primera etapa se caracteriza por los procesos electrónicos, los cuales ocurren a aproximadamente 10-16 segundos después del paso de la radiación donde aparecen moléculas excitadas (H2O•), sobreexcitadas (H2O••), iones (H2O+) y electrones secundarios. La segunda etapa comienza luego de 10-14 segundos, el sistema alcanza el equilibrio térmico, y tienen lugar las reacciones de disociación de las moléculas de agua excitadas y sobreexcitadas, y las reacciones ion-moleculares entre el ion H2O+y las moléculas de H2O. Así, al final de esta etapa coexisten en el agua las partículas siguientes: e-(ac), H•, O•, HO•, H+(ac), H2, H2O2. En la etapa química, estas partículas se alejan de las esporas y reaccionan en el volumen del sistema con las sustancias disueltas (Nielsen & McMorrow, 2011).
A continuación, se muestran algunas de las reacciones que ocurren durante la radiólisis del agua: (Ashfaq et al., 2017; Rothenberg et al., 1993).
(17) (18) (19)
Reacciones primarias principales: (Ashfaq et al., 2017; Sayed, 2015)
(20) (4) (5) (9) (21) (22) (23) (24) (25) (26) (27)
En presencia de oxígeno: (Ashfaq et al., 2017; Sayed, 2015; Torun et al., 2014)
(28) (29)
En presencia de N2O: (Ashfaq et al., 2017; Bojanowska-Czajka, 2015)
(30)
En presencia de H2: (Ashfaq et al., 2017)
(31)
La característica cuantitativa de la radiólisis es el rendimiento radiolítico (G-value) que constituye el número de moléculas, radicales libres, iones, partículas excitadas, y otras, que se forman o descomponen cuando el sistema absorbe 100 eV de la energía de la radiación ionizante. Según el Sistema Internacional, se representa en mol L-1; sin embargo, la unidad que más se utiliza es moléculas/100 eV. Esta variable es utilizada constantemente para caracterizar las transformaciones radiolíticas del disolvente (Bojanowska-Czajka, 2015; Iqbal, 2015) y se calcula según la ecuación 1.
(Ec. 1)
donde R es el cambio en la concentración (M), NA es el número de Avogadro, D la dosis absorbida (Gy) y 6,24 · 1016 es el factor de conversión de Gy a eV/L. Para la conversión a mol J-1 se multiplica por 1,04 · 10-7 (Bojanowska-Czajka, 2015; Liu et al., 2015).
Otro criterio a tener en cuenta en los procesos radiolíticos, además de la degradación del fármaco, son los productos intermediarios formados durante la radiólisis, nombrados como G-valuec, representando un nuevo criterio a tener en cuenta en la eficiencia de eliminación del residual tratado (Rivas et al., 2017). Este nuevo criterio está determinado por la ecuación 2.
(Ec. 2)
donde COTo y COT, en este caso, son las concentraciones de carbono orgánico total antes y después de la irradiación.
Para evaluar el grado de descomposición de un contaminante se utiliza la constante de dosificación (k) y se describe a partir del modelo cinético de una reacción de pseudo primer orden (ecuación 3), en función de la dosis absorbida (J. Wang & L. Chu, 2016), permitiendo predecir la concentración del compuesto a una dosis determinada.
(Ec. 3)
donde C y Co corresponden a la concentración final e inicial del compuesto orgánico, respectivamente, y D es la dosis absorbida.
Una vez obtenida k, se puede predecir la concentración del compuesto a una dosis dada u obtener la dosis para la cual se degrada; por ejemplo, un 50 %, por la ecuación 4 (Alkhuraiji & Alkhuraiji, 2019; Bao, Chen, Tian, & Wang, 2014; Bojanowska-Czajka, 2015; Changotra, Guin, Varshney, & Dhir, 2018; Mohammadian-Kohol, Nasrabadi, Navarchian, Jabbari, & Seyedhabashi, 2018; Sayed, 2015).
(Ec. 4)
La constante de dosificación está relacionada con la temperatura, la concentración inicial del contaminante, el pH de la disolución, la estructura de la molécula y la presencia de aniones inorgánicos.
La radiación gamma ha sido estudiada constantemente para la degradación de diversos productos orgánicos, entre ellos fármacos, aditivos químicos utilizados en la síntesis de compuestos, compuestos de polimetilmetacrilato, ésteres, entre otros (Albano, Karam, Domínguez, Sánchez, & González, 2016; Chu & Wang, 2016; Kongmany et al., 2014; Shah et al., 2015). Los resultados alcanzados en estas investigaciones se basan en la eficiencia radiolítica y la mineralización de los contaminantes, así como en los productos intermediarios y finales, en el mecanismo de reacción y en la influencia de diferentes factores en el proceso. La aparición de efectos sinérgicos dentro de la radiación gamma depende del tipo y la energía de aparición, la dosis absorbida, la tasa de dosis de radiación, la concentración inicial del contaminante, el pH de disolución y la temperatura (Getoff, 2002).
El uso de las radiaciones ionizantes en la degradación de los contaminantes emergentes provoca una mayor biodegradabilidad de los productos de degradación para posteriores tratamientos, por lo que no es necesario alcanzar elevados porcentajes de mineralización. Se ha reportado el incremento de un 18,9 %, 28,3 % y 36,6 % de la biodegradabilidad de la lincomicina, el sulfametoxazol y la tetraciclina, respectivamente, a una dosis de 2 kGy (H. Kim, Lee, Kim, & Yu, 2015).
La radiación gamma es una tecnología que requiere de bajo consumo de energía, no es sensible a la coloración del agua ni a las partículas en suspensión, presenta un alto grado de penetración y permite la descomposición de los compuestos persistentes por la acción de especies reactivas durante la radiólisis del agua (Alkhuraiji & Alkhuraiji, 2019; Hai, Yamamoto, & Fukushi, 2007; Tegze et al., 2019). Pero, el alto costo y las preocupaciones por el uso de radioisótopos constituyen los principales factores que limitan su utilización (J. Wang and L. Chu, 2016).
Tasa de dosis
Cuando las tasas de dosis son bajas, se incrementa el tiempo para suministrar una dosis predefinida. Esto es favorable en la degradación radiolítica, puesto que aumenta el tiempo de exposición a la radiación, aumentando así la posibilidad de reacción del radical HO• con el contaminante. Por otra parte, a tasas de dosis altas, las especies reactivas producto de la radiólisis del agua se forman en grandes cantidades y la mayor parte de estas se consumen reaccionando entre ellas (Getoff, 2002). De igual forma, para tasas de dosis altas se observa una disminución del rendimiento radiolítico, justificado por un aumento en la probabilidad de recombinación de las especies reactivas (Shah et al., 2015).
Degradación de benzodiacepinas con radiación gamma
El empleo de la radiación gamma en la degradación de fármacos ha sido poco estudiado, a pesar de los elevados porcentajes de degradaciones alcanzados (Montanari et al., 2001; Werner, Altorfer, & Perlia, 1990). Las principales ventajas del uso de esta técnica radican en las altas cantidades de radicales hidroxilos que se generan en el proceso de radiólisis, los cuales al ser altamente reactivos y poco selectivos favorecen la eficiencia del proceso de degradación. En la Tabla 2 se muestran dos de los estudios reportados en el uso de la radiación gamma en la degradación del clorazepam y el medazepam.

Tendencias
Se han reportado varios trabajos de degradación de compuestos farmacéuticos por radiación gamma y su combinación con otros tratamientos en los cuales se evidencian la factibilidad del uso de estos procesos en la descontaminación de las aguas (Bojanowska-Czajka, 2015; Kim, Lee, Kim, & Yu, 2015; Montanari et al., 2001; Sayed, 2015; Werner et al., 1990) , en los cuales solo dos hacen alusión a las benzodiacepinas, siendo este un nicho aún por explorar.
Proceso Avanzado de Oxidación – Fotólisis
El rango de UV-visible cubre longitudes de onda entre 400 y 800 nm. La región UV abarca desde 100 a 400 nm y se divide en tres intervalos (Pouran, Aziz, & Daud, 2015). El ozono, el vapor de agua, el oxígeno y el dióxido de carbono absorben toda la radiación UVC y el 90 % de la UVB, una vez que la luz solar atraviesa la atmósfera; mientras que los rayos UVA y el resto de UVB inciden directamente sobre la superficie terrestre.
La fotólisis constituye la ruptura de enlaces químicos al irradiar un sistema con luz de energía en el rango UV-visible. Su eficiencia en aguas superficiales depende de diversos factores medioambientales, ya sea la profundidad de la columna de agua, la turbidez, la latitud geográfica, la estación, el tiempo y la sombra proporcionada por los árboles y arbustos. Las transformaciones fotoquímicas pueden ser directas, donde la molécula absorbe la radiación UV disociándose en fragmentos más simples; o indirectas, donde tienen lugar la formación de radicales libres altamente reactivos (Carra et al., 2016). La intensidad y la longitud de onda de la radiación o el rendimiento cuántico del compuesto que se pretende eliminar son factores que influyen en el rendimiento del proceso. Como fuente de radiación UV, se utilizan lámparas de vapor de mercurio (Fatta, Vasquez, & Kümmerer, 2011; Lin, Yang, Chou, & Liou, 2016), pero el uso de luz solar garantiza un ahorro considerable de energía.
Influencia de los parámetros de operación Potencia de la lámpara y longitud de onda
En los experimentos fotoquímicos la velocidad de la reacción está determinada por la radiación absorbida por las especies foto-reactivas y la intensidad de la fuente emisora. Para lograr altas velocidades de reacción, debe coincidir la longitud de onda de la radiación emitida por la fuente con el máximo de absorción de la molécula que se quiere eliminar o de la especie foto-reactiva a descomponer (ejemplo el H2O2) (Li et al., 2015; Oppenländer, 2007; Li et al., 2015).
Las radiaciones UV han sido estudiadas por diferentes autores para el tratamiento de aguas contaminadas con compuestos orgánicos, disruptores endocrinos, tales como pesticidas, alquil fenoles, ftalatos, esteroides naturales y sintéticos, antibióticos (Aguirre, Pérez, Esteban, Peñuela Mesa, & Jiménez Cartagena, 2015; Gmurek, Olak-Kucharczyk, & Ledakowicz, 2017; Rizzo, Fiorentino, & Anselmo, 2013), lo que evidencia su efectividad para tratar prácticamente cualquier agua residual. En estos momentos, las investigaciones se han centrado en su combinación con otros procesos, lo que constituye una mejora en cuanto a la eficiencia de degradación. Se han realizado estudios combinados con ozono, con peróxido de hidrógeno, reactivo Fenton, catálisis, con dióxido de titanio, entre otros (Cunha, 2022; Illés et al., 2014; Karthikeyan & Gopalakrishnan, 2017; Shakir, Faraz, Sherwani, & Al-Resayes, 2016; Ye et al., 2021) (ver Tabla 3).

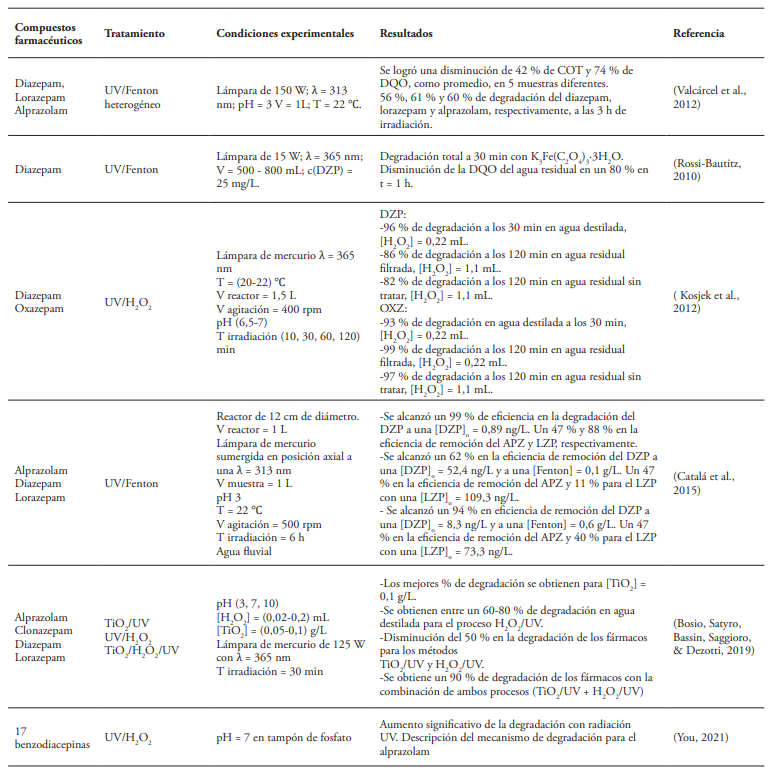
Intensificación de los PAOs con agentes oxidantes
La descomposición de los contaminantes orgánicos (RH) por los radicales HO• mediante la abstracción del protón de los enlaces C-H, N-H o O-H, y la adición de un doble enlace C = C dependen del potencial de ionización de los contaminantes orgánicos. Los intermediarios radicálicos formados (R•) pueden reaccionar con Fe3+y H2O2 formando R+y ROH, que pueden ser oxidados con más facilidad [96]. En presencia de oxígeno, los radicales R• reaccionan con O2 dando lugar a HO2•, ROO• y RO•, que finalmente pueden degradarse a CO2, H2O y ácidos orgánicos de cadena corta (Du, Zhou, & Lei, 2007).
Peróxido de hidrógeno
El uso de H2O2 da lugar a una mayor generación de radicales HO• (ecuación 35) (la entalpía de disociación de enlace O-O es de 210 kJ mol-1), que degradan los contaminantes orgánicos y forman compuestos más simples (ecuación 36), dando lugar a otras reacciones de propagación asociadas a este fenómeno.
(35) (36) (37) (38) (39) (40)
El uso de los PAO combinados con el reactivo H2O2 ofrece grandes ventajas, ya que el oxidante es comercialmente muy accesible, es térmicamente estable y puede almacenarse en el lugar. Posee solubilidad infinita en agua, por lo que no existen problemas de transferencia de masa asociados a gases, como en el caso del ozono. En contraposición, el exceso de H2O2 produce altas concentraciones de HO•, dando lugar a reacciones competitivas que provocan una disminución de la degradación. Los HO• son susceptibles a recombinarse o a reaccionar según las ecuaciones 9, 12 y 13 (Rauf & Ashraf, 2009; Sánchez, López, Prados, Ferro, & Rivera, 2009).
Reactivo Fenton
En los procesos Fenton, los radicales HO• son generados por la descomposición catalítica del H2O2 usando como catalizador iones Fe3+ en medio ácido a pH en el rango 2-4 (Jiang et al., 2011; Méndez et al., 2010). La pérdida de eficacia en medio básico se relaciona con la transición del hierro de la forma ferrosa hidratada a especies férricas coloidales, bajo las cuales el Fe2+ descompone al H2O2 en O2 y H2O, pero sin promover la formación de radicales (Mijaylova, Estrada, & Ramírez, 2014). Estos radicales pueden reaccionar por dos vías, la oxidación de Fe2+(ecuación 42), que constituye una reacción improductiva; y el ataque a la materia orgánica (ecuación 36).
(36) (41) (42)
A pH menor que 3, la reacción es autocatalítica, ya que el Fe3+descompone el H2O2 en O2 y H2O a través de un mecanismo en cadena (Pignatello, 1992), (ecuaciones 38, 41, 43-46).
(43) (44) (45) (46)
Este método facilita una alta formación de HO•, sin embargo, un exceso de Fe2+puede atrapar a estos (reacción 49), al igual que los halógenos, el H2O2 o el HO2• (reacción 13).
Las reacciones 9,13, 47-61 representan algunas de las reacciones que participan en el mecanismo de reacción del proceso Fenton.
(47) (48) (49) (50) (51) (52) (53) (54) (55) (56) (57) (58) (59) (60) (61)
El uso de agentes oxidantes presenta diversas ventajas debido a la abundancia y no toxicidad del Fe2+, y a la facilidad de manejo del H2O2, y su no contaminación del medio ambiente. No se forman compuestos clorados como en otras técnicas oxidantes y no existen limitaciones de transferencia de masa por tratarse de un sistema homogéneo. Además, el diseño de reactores para la aplicación tecnológica es bastante sencillo (González, 2013). En contraposición, el almacenamiento y transporte del H2O2 es relativamente costoso y arriesgado; el sistema requiere la adición continua estequiométrica de Fe2+ y H2O2 (Doménech et al., 2014), la cual, teóricamente, debe oscilar entre 2 y 10 para la destrucción de compuestos solubles (Doménech et al., 2014). Se necesita, además, la eliminación del hierro en los fangos y sedimentos, la acidificación de los efluentes a pH 2 y pH 4 antes de la eliminación y la neutralización del medio luego de la degradación de los contaminantes (Long & Jin, 2012). En el laboratorio, la adición del metal se realiza tradicionalmente en forma de sales ferrosas puras, pero en escalas mayores el uso de estas se vuelve prohibitivamente caro, y normalmente se usa Fe2(NH4)2SO4, que contiene 20 % de hierro activo (Teel, Warberg, Atkinson, & Watts, 2001).
Según la bibliografía consultada (Alalm, Tawfik, & Ookawara, 2015; Expósito, Patterson, Monteagudo, & Durán, 2017; Gong et al., 2016; Weng & Huang, 2015), la combinación de agentes oxidantes como el peróxido de hidrógeno y Fe2+ con el US, la radiación gamma y las radiaciones UV muestra resultados positivos en cuanto a la degradación de los compuestos persistentes. Una de las principales desventajas de la utilización del US por sí sola para la degradación de contaminantes emergentes es el bajo grado de mineralización alcanzado, debido al comportamiento refractario de los intermediarios que se forman (Cruz et al., 2015), por lo que la generación adicional de radicales libres debe aumentar la velocidad de la mineralización (Oppenländer, 2007; Xiao et al., 2014). La integración de estos dos procesos es conceptualmente ventajosa en el tratamiento de aguas residuales partiendo de que puede eliminar las desventajas asociadas a cada proceso individual. Las investigaciones realizadas hasta el momento muestran resultados prometedores en la degradación de contaminantes como pesticidas, tintes, fármacos y compuestos orgánicos complejos, como son la diazina, el dimetoato, el carbofurano, la antraquinona (Azul ácido 25, BA25), el fenitrotion, los azo-colorantes, como la rodamina B, el azul de metileno y la metilnaranja, el diclofenaco, el naproxeno y el paracetamol (Jyothi, Yesodharan, & Yesodharan, 2018; Mackuľak et al., 2015; Peng, Li, Shi, Wang, & Gao, 2016; Saharan, Chaudhary, Lata, Mehta, & Mor, 2015; Soltani & Entezari, 2013; Torrades & García-Montaño, 2014).
Hasta nuestros días, son insuficientes los estudios realizados en la degradación del DZP y el MDZ o de las benzodiacepinas, de manera general, mediante el empleo de los PAO y su combinación con agentes oxidantes.
Criterios energéticos sobre la introducción de los PAOs en la industria
Los costos globales en una industria se expresan como la combinación de los costos de inversión, de operación y mantenimiento. Para analizarlos dentro de una planta de tratamiento es necesario tener en cuenta la naturaleza y la concentración del contaminante, así como la relación entre el flujo del efluente y la configuración de los reactores. La introducción de los PAOs en el tratamiento de residuales líquidos, como etapa previa a los procesos biológicos, representa una gran oportunidad de disminuir los costos de tratamientos. Su uso no exige la mineralización total del contaminante, pues brindan la ventaja de degradar los compuestos bio-recalcitrantes en intermediarios más biodegradables y de menor toxicidad.
Criterios energéticos sobre la introducción de los PAOs en la
industria
Los costos globales en una industria se expresan como la combinación de los costos de inversión, de operación y mantenimiento. Para analizarlos dentro de una planta de tratamiento es necesario tener en cuenta la naturaleza y la concentración del contaminante, así como la relación entre el flujo del efluente y la configuración de los reactores. La introducción de los PAOs en el tratamiento de residuales líquidos, como etapa previa a los procesos biológicos, representa una gran oportunidad de disminuir los costos de tratamientos. Su uso no exige la mineralización total del contaminante, pues brindan la ventaja de degradar los compuestos bio-recalcitrantes en intermediarios más biodegradables y de menor toxicidad.
La aplicación del US, la radiación gamma y UV en el tratamiento de residuales a escala industrial no se ha reportado en la literatura. La mayoría de las aplicaciones de estos procesos han sido investigadas y desarrolladas solamente a escala de laboratorio y, en algunos casos, a escala de planta piloto. Esto pudiera explicarse por la ineficiente conversión de energía en la producción de cavitación acústica en el caso del US, las dificultades para un posible escalado, así como al alto costo de adquisición e instalación de estas tecnologías.
Para la estimación de consumo de energía en la degradación por las técnicas estudiadas, pueden utilizarse dos criterios diferentes. El primero es el propuesto por Bolton y Carter en 1994, donde se determina la Energía Eléctrica por Orden de Magnitud (EE/O) (ecuación 5), que se expresa en kWh L-1 y representa la energía necesaria para degradar un litro de disolución contaminada (Kim et al., 2015; Zhang, Xiao, Zhang, Chang, & Lim, 2017). El segundo es el DW [124] (ecuación 6), que expresa la cantidad de energía necesaria para degradar un miligramo de contaminante y su unidad de medida es kWh mg-1.
(Ec. 5)
donde P es la potencia de consumo en la instalación (kW), t el tiempo de irradiación (h), V el volumen del agua tratada (L), Co y C las concentraciones inicial y final en la disolución de trabajo (mg L-1).
(Ec. 6)
donde (Co - C)V es la masa del contaminante degradado (mg).
Expectativas
Los compuestos orgánicos persistentes son trasparentes a los sistemas convencionales de tratamiento de aguas residuales, alcanzándose solo un 10 % de remoción (Echevarría et al., 2019; Kosjek et al., 2012). Por otra parte, los procesos avanzados de oxidación logran una alta degradación de esos contaminantes, pero su implementación supone una alta carestía energética, por lo que sería factible realizar una preconcentración de los contaminantes en carbón activado y su ulterior tratamiento con los PAOs.
El uso de la radiación gamma ha alcanzado altos porcentajes de degradación de COPs (Montanari et al., 2001; Werner et al., 1990), pero ha estado limitado por causa de la poca disposición de estos sistemas y al alto consumo energético al irradiar a altas dosis. La introducción de los aceleradores de partículas en el tratamiento de residuales supondrá una mejora en la eficiencia energética, debido a que este proceso brinda mejores rendimientos en la producción de partículas que interactúan con los contaminantes, favoreciéndose la degradación.
La degradación fotolítica de los COPs mediante el uso de lámparas UV con intensidades variables ha sido el PAO más empleado en la remoción de COPs presentes en los residuales líquidos. Los procesos fotolíticos requieren largos tiempos de irradiación y ser combinados con agentes oxidantes para alcanzar valores superiores al 80 %, siendo esta su principal desventaja. Serían necesarios estudios de fotólisis donde se utilice la radiación solar como concepto de energía verde, donde con un aumento del tiempo de residencia de los contaminantes con la radiación podrían alcanzarse excelentes resultados.
El uso del ultrasonido de alta frecuencia ha estado limitado por los bajos porcentajes de degradación y los prolongados tiempos de exposición que presentan los contaminantes para alcanzar una elevada tasa de remoción. Por otra parte, los porcentajes de mineralización alcanzados en este proceso son bajos, suponiendo un vertimiento de nuevos contaminantes con elevada toxicidad y baja biodegradabilidad a los sistemas receptores de los residuales tratados.
Conclusiones
La presencia de productos farmacéuticos en los diferentes cuerpos de aguas ha sido constantemente reportada en la literatura, así como el alto riesgo para los ecosistemas y para la salud humana que esto implica. El grado de contaminación se debe fundamentalmente a la ineficiencia de las plantas de tratamientos cuyos métodos biológicos no son eficaces en la remoción de esos compuestos y a las emisiones deslocalizadas de los contaminantes.
Las benzodiacepinas constituyen a nivel mundial una de las familias de fármacos de mayor incidencia en las aguas superficiales y residuales, debido a sus múltiples usos y al incremento en su producción y consumo.
Los PAOs son técnicas novedosas que pueden modificar la estructura de los contaminantes persistentes mediante procesos físicos-químicos. Su uso ha sido estudiado y aplicado para el tratamiento de las aguas contaminadas; sin embargo, el alto costo de tratamiento constituye una de las principales desventajas para su aplicación a nivel industrial.
La combinación de los procesos avanzados de oxidación con agentes oxidantes como el H2O2 y el reactivo de Fenton suponen una mejora en la eficiencia de degradación de los compuestos orgánicos persistentes, pero, a su vez, genera costos adicionales en los tratamientos. Se necesita un cambio drástico del pH de las aguas tratadas, así como el empleo de reactivos adicionales para la eliminación del hierro asociado al uso del reactivo de Fenton.

