1. Introducción
Los Biorreactores con Membranas (BM) se han convertido en una tecnología ampliamente empleada como un tratamiento avanzado de aguas residuales urbanas e industriales (Ferrero et al., 2012; Kumar et al., 2014; Singh et al., 2019). Los BM son sistemas en los que se integra la degradación biológica de los efluentes residuales con la filtración con membranas (Cicek et al., 1999). Desde hace muchos años, estos sistemas han mostrado su eficiencia en el tratamiento de aguas residuales municipales e industriales (Jimenez et al., 2010). En las últimas dos décadas, las tecnologías de los Biorreactores con Membranas Sumergidas han crecido exponencialmente debido a las ventajas que ofrecen sobre los procesos convencionales de tratamiento de aguas residuales, tales como: menor impacto ambiental, mejor calidad de los efluentes y un mejor control de los procesos (Buer & Cumin, 2010; Du et al., 2020; González-Zarragoitia et al., 2009; Hoinkis et al., 2012; Judd, 2016; Keskes et al., 2012; Kimura et al., 2019; Lin et al., 2011; Palani et al., 2019; Song et al., 2007).
La mayor ventaja potencial de esta tecnología está en el campo de la reutilización del agua. Esto se debe a que las membranas de los reactores pueden ser de ultrafiltración, por lo que retienen las bacterias, algunos virus y muchos componentes orgánicos e inorgánicos que frecuentemente se encuentran en los efluentes de los tratamientos biológicos convencionales (De Luca et al., 2013). Por tanto, dependiendo del uso que se le quiera dar, el efluente de un biorreactor con membranas sumergidas (BMS) puede ser adecuado para la reutilización directa en la agricultura, la industria o en el uso doméstico de agua no potable (Zanetti et al., 2010). Estas son algunas de las razones por las cuales la investigación en el campo de los BMS está actualmente en continuo incremento dado el interés comercial y científico que han despertado. Sin embargo, los BM presentan algunas desventajas que limitan su aplicación, en particular, la colmatación de la membrana (Diez et al., 2014; Drews, 2010; Goswami et al., 2018; Le-Clech et al., 2006; Mannina & Cosenza, 2013; Meng et al., 2009) y el consumo energético asociado a este fenómeno (Krzeminski et al., 2017). La colmatación de la membrana se define como la deposición y acumulación indeseable de microorganismos, coloides, solutos y células muertas dentro y sobre la superficie de la membrana (Böhm et al., 2012; Meng et al., 2009). La aireación con burbujas gruesas se emplea con el propósito de inhibir el proceso de colmatación de la membrana (Menniti & Morgenroth, 2010), la cual, a su vez, constituye la principal contribuyente al consumo energético del sistema (Drews, 2010). Por otro lado, la experimentación en estos sistemas requiere de un gran consumo de recursos y de tiempo, por lo que la modelación matemática constituye una alternativa para la realización de estudios de optimización del funcionamiento de estas instalaciones (González-Hernández et al., 2016).
La modelación matemática de estos sistemas presenta deficiencias apreciables por la complejidad que representa la unión de un sistema de tratamiento biológico con un componente de separación física, teniendo en cuenta el proceso de colmatación de la membrana, lo que dificulta el proceso de optimización de las condiciones operacionales de estos sistemas. Por esta causa, se considera que existe una reserva considerable en las potencialidades de esta tecnología, una vez que la mayoría de las instalaciones no operan a su máxima eficiencia (Liu et al., 2005). Los modelos integrados vinculan los procesos de degradación biológica con los procesos de filtración a partir de la estimación de los sólidos suspendidos totales y las sustancias poliméricas extracelulares en el interior del reactor biológico, debido a que constituyen los parámetros más influyentes en el proceso de colmatación de la membrana. Sin embargo, al principio, los procesos biológicos y el proceso de colmatación de la membrana eran modelados por separado. Para la simulación de los procesos biológicos, los modelos más utilizados son los modelos de lodos activados ASM (siglas en inglés: Activated Sludge Model), que se desarrollaron como parte de una iniciativa de la Asociación Internacional de la Calidad del Agua, en 1982. De estos modelos, los más empleados son el ASM1 y el ASM3. El modelo ASM1 describe la degradación de materia orgánica, nitrificación y desnitrificación en un proceso de lodos activados (Henze et al., 1987), mientras que el ASM3 tiene en cuenta fenómenos que el ASM1 fue incapaz de simular, como es el caso del almacenamiento de sustrato de reserva, para los períodos de ausencia de sustrato (Henze, 2000). En cuanto al sistema de colmatación de la membrana, son varios los modelos que se han desarrollado para su descripción (Janus, 2014; Li & Wang, 2006; Navaratna et al., 2012; Wu et al., 2011; Wu et al., 2012; Zuthi et al., 2017).
No obstante, en la actualidad existe una tendencia marcada al empleo de modelos integrados dinámicos en la simulación del funcionamiento de los BMS; hasta la fecha, la mayoría de estos modelos tiene en cuenta únicamente la producción de sustancias poliméricas extracelulares (SPE) solubles (Di Bella et al., 2008; Janus, 2014; Mannina et al., 2011), mientras que solo unos pocos modelos consideran el efecto de las SPE particuladas enlazadas a los flóculos (Suh et al., 2013), que influyen de manera considerable en el proceso de colmatación de la membrana. Por otro lado, la cinética de formación de las SPE enlazadas al flóculo se complejiza, debido fundamentalmente a las divergencias de criterios en cuanto al origen de estas, así como a la relación que guardan con el modelo de colmatación de la membrana. Otro aspecto importante a tener en cuenta en estos modelos es el fenómeno de almacenamiento de sustrato, que tiene lugar en sistemas que presentan irregularidades en su alimentación, lo cual ocurre con mucha frecuencia en condiciones reales. Esto se observa claramente en los respirogramas correspondientes a la degradación del sustrato fácilmente biodegradable, presentando una cola al final del proceso, asociada a la degradación del material almacenado (Guisasola et al., 2005). Este fenómeno se incluye por primera vez en el modelo ASM3, considerando que todo el sustrato fácilmente biodegradable que llega al sistema se almacena en forma de polímeros y que, posteriormente, son utilizados en la producción de energía y nuevas células. A pesar de esto, en realidad solo una parte de este sustrato fácilmente biodegradable que llega al sistema se almacena mientras que la otra parte se emplea simultáneamente en la producción de energía y nuevas células (Fan et al., 2011; Fan et al., 2012; González-Hernández et al., 2019; Krishna & Van Loosdrecht, 1999). Estas transformaciones por las cuales transita el sustrato fácilmente biodegradable implican un menor rendimiento en el crecimiento de los microorganismos heterótrofos para poder subsistir por un mayor período de tiempo. Por tanto, teniendo en cuenta la importancia del modelo biológico en la modelación del proceso de colmatación de la membrana, para la optimización del funcionamiento de estas instalaciones, en el presente trabajo se realizará un análisis de la modelación matemática del proceso de degradación biológica, teniendo en cuenta el fenómeno de crecimiento y almacenamiento simultáneo de sustrato, así como la producción de las sustancias poliméricas extracelulares solubles y enlazadas al flóculo. Posteriormente, se discutirán los modelos de colmatación de la membrana, teniendo en cuenta los principales fenómenos que en ellos se consideran, así como el enlace de estos con el sistema biológico, con respecto a la influencia de las SPE solubles y enlazadas.
2. Biorreactores con membranas
2.1. Procesos de tratamiento de aguas residuales basados en lodos activados
Hace más de un siglo, en 1913, Ardern y Lockett aplicaron por primera vez el uso de los lodos activados en el tratamiento de residuales. El principio de funcionamiento de estos procesos se basa en aprovechar la capacidad de degradación que poseen poblaciones de microorganismos sobre múltiples sustancias orgánicas e inorgánicas, las cuales pueden encontrarse en estado soluble o coloidal. La biomasa, como también se conoce a este conjunto de poblaciones de microorganismos, está compuesta en mayor proporción por especies de bacterias y protozoos. Estas especies se unen entre ellas mediante sustancias poliméricas extracelulares, dando origen a la formación de flóculos con tallas que pueden variar en un intervalo de 50-200 µm (Fenu et al., 2010a). Durante el proceso, estos flóculos pueden eliminarse mediante la sedimentación gravitatoria, obteniéndose un efluente clarificado con una menor concentración de contaminantes.
La selección y el diseño del sistema a utilizar, así como su modo de operación, estará en dependencia del tipo de residual a tratar. Las plantas de tratamiento de aguas residuales basadas en procesos clásicos de lodos activados son numerosas hoy en día. Entre los sistemas comunes en este tipo de instalación se encuentran los biorreactores convencionales, cuyo principio de funcionamiento se basa, fundamentalmente, en dos procesos: la degradación biológica de las sustancias orgánicas e inorgánicas presentes en el agua residual y la separación física del lodo del agua tratada mediante la decantación.
A pesar de su estabilidad y robustez, los biorreactores convencionales han alcanzado sus límites de explotación en determinados parámetros. Uno de los aspectos más vulnerables es la eficiencia de la etapa de sedimentación, que es inestable y está directamente vinculada al comportamiento biológico y cinético del sistema. Aspectos como una alta edad del lodo o la aparición de organismos filamentosos dentro del tanque de aireación conducen a la modificación de las características de la biomasa, que se transforma en poco sedimentable y provoca una disminución en la calidad de la corriente de salida. Otra desventaja la constituyen los grandes espacios que estos biorreactores ocupan. Por estas razones se trabaja en el desarrollo de nuevos procesos de tratamiento bajo el principio de la utilización de lodos activados, pero sustituyendo la etapa de sedimentación por otros procesos de separación, como la filtración con membranas.
2.2. Biorreactores con membranas
La primera utilización de los BM para el tratamiento de residuales data de la década de los sesenta del siglo pasado y es en la década de los setenta que la tecnología entra al mercado (Stephenson et al., 2000). La tecnología de membrana, en un principio, tenía un uso muy limitado y solamente se empleaba como tratamiento terciario en los procesos convencionales. La microfiltración (MF), la ultrafiltración (UF) y la ósmosis inversa (OI) se utilizaron en áreas donde había requerimientos de vertido muy rigurosos o donde se pretendía reutilizar el agua depurada. Los factores principales que limitaron el desarrollo de la tecnología de membrana fueron el elevado costo de inversión, de operación, y un inadecuado conocimiento de las ventajas potenciales de las membranas en el tratamiento de las aguas residuales (Fane et al., 2002; Fenu et al., 2010a). Sin embargo, con la aparición de módulos de membrana menos costosos y más efectivos, junto con el aumento gradual de la exigencia de las normas de vertimiento, la tecnología de membrana volvió a cobrar interés.
En los últimos años, se ha diversificado su utilización, se ha construido un mayor número de instalaciones pilotos y se han incrementado los trabajos de investigación básica y perfeccionamiento del proceso (Krzeminski et al., 2017; Meng et al., 2017). No solo se han desarrollado numerosos estudios en plantas piloto, sino que en varias partes del mundo hay plantas a escala industrial que utilizan esta tecnología. Los usos actuales incluyen el tratamiento y reciclado de agua en comunidades y edificios, el tratamiento de aguas residuales municipales, y el tratamiento de efluentes en determinadas industrias (Bani-Melhem et al., 2015; Bracklow et al., 2010; Brepols et al., 2010; Friha et al., 2015; Krzeminski et al., 2017; Mutamim et al., 2013; Santos et al., 2011).
Existen varias áreas de aplicación muy prometedoras que están todavía en fase de desarrollo. Entre ellas se encuentra el tratamiento de efluentes procedentes de actividades ganaderas, aguas residuales de industrias alimentarias, la eliminación de herbicidas y pesticidas de las corrientes de aguas residuales, la eliminación biológica de los nitratos, y el tratamiento de los residuales farmacéuticos (Bracklow et al., 2010; Brepols et al., 2010; Fenu et al., 2010a; Katsuki et al., 2005; McArdell et al., 2011; Mutamim et al., 2013; Nguyen et al., 2017; Ouarda et al., 2018; Quesada et al., 2015; Santos et al., 2011; Urase et al., 2005). Existen dos configuraciones fundamentales para esta tecnología: los Biorreactores con Membrana Externa (BME) y los Biorreactores con Membrana Sumergida (BMS) (Figura 1).
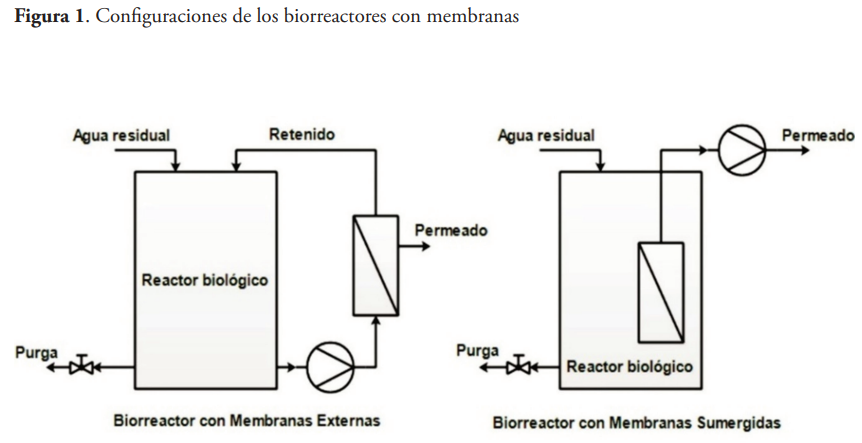
La limpieza de la membrana usualmente se realiza a través de retrolavados, con agua permeada y aire, u ocasionalmente mediante retrolavados con soluciones químicas. Generalmente, se coloca un difusor de aire justo debajo del módulo de membranas para suministrar el aire necesario para homogeneizar el contenido del tanque, para el proceso biológico y para la propia limpieza de la membrana (Witzig et al., 2002). El tiempo de vida útil de la membrana depende de la efectividad de las limpiezas químicas y de las medidas encaminadas a inhibir la colmatación de la membrana. La realización de limpiezas químicas de la membrana con frecuencia conduce a un rápido deterioro de esta; aún más cuando se emplean reactivos ácidos o alcalinos. El empleo de flujos bifásicos de aire/agua minimiza los impactos negativos de la limpieza química, especialmente para aplicaciones acuáticas.
El análisis de los materiales de las membranas muestra que los flujos bifásicos de aire/agua limpian la membrana (Wibisono et al., 2014). Cada una de estas configuraciones tiene sus ventajas y desventajas. Una tabla comparativa con algunos de los aspectos más importantes a tener en cuenta antes de seleccionar la configuración a instalar se presenta a continuación.
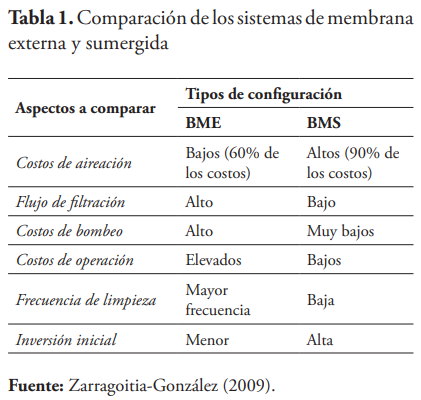
Para ambas configuraciones, el estado de la tecnología actual ha alcanzado un desarrollo importante en los últimos años, de forma que los BM se emplean cada vez más en el tratamiento, tanto de aguas residuales municipales como industriales. Atendiendo a la elevada calidad del efluente y al alto grado de compactación de las plantas, estos procesos están particularmente adaptados para la aplicación en áreas de elevada sensibilidad ambiental; el tratamiento de efluentes industriales complejos que requieren un sistema que permita operar a elevadas edades de lodos; aplicaciones específicas donde el proceso convencional de lodos activados no puede producir un efluente de calidad adecuada a costos razonables; en áreas donde existen limitaciones espaciales y en ampliaciones de plantas convencionales (Metcalf & Eddy, 2003; Mutamim et al., 2013; Santos et al., 2011; Stephenson et al., 2000).
3. Modelación matemática de los sistemas con BM
A partir del establecimiento de la tecnología de los BM como proceso confiable, respaldado por sus resultados iniciales y su paulatina generalización, diversos investigadores se han dado a la tarea de profundizar en la descripción matemática del proceso (Baek et al., 2009; Bolton et al., 2006; Brannock et al., 2010; Brannock et al., 2009; Fenu et al., 2010b; González-Zarragoitia et al., 2008; Li & Wang, 2006; Lubello et al., 2009; Ognier et al., 2004; Wintgens et al., 2003; Wu et al., 2011; Wu et al., 2012). Aunque todavía no puede hablarse de la modelación general de todo el proceso y mucho menos de la optimización final de la tecnología, se ha avanzado en la descripción de manera particular de muchos de los mecanismos y los fenómenos presentes en estos sistemas e incluso algunas de las interacciones existentes.
Analizando la literatura enfocada en los temas de la modelación de los BM, puede observarse diversos modos de afrontar el problema. Tomando como punto de partida los modelos convencionales más conocidos de la propia teoría de la filtración o de aquellos provenientes de otras tecnologías que utilizan la filtración con membrana, los estudios actuales se orientan, sobre todo, al desarrollo matemático de los siguientes aspectos (Bolton et al., 2006; Brannock et al., 2010; Brannock et al., 2009; Fenu et al., 2010b; Li & Wang, 2006; Lubello et al., 2009; Tian et al., 2011; Verrecht et al., 2010; Wang et al., 2010; Wintgens et al., 2003):
- Modelación de la cinética de los procesos de remoción de sustratos.
- Modelación de los mecanismos de colmatación de la membrana.
- Modelación de la disminución del caudal durante la filtración y el incremento de la resistencia a la filtración.
- Modelación de la colmatación producida por determinados elementos (proteínas, polisacáridos, biomasa, entre otros), tanto de manera independiente como conjugada.
- Modelación de la evolución de los mecanismos de colmatación a corto y largo plazo.
- Modelación de la generación por parte de la biomasa de las SPE enlazadas al flóculo y los productos microbianos solubles (PMS).
- Modelación de la degradación de determinados compuestos sintéticos.
- Adecuación a los BM de modelos propuestos para el proceso clásico de lodos activados.
Para llevar a cabo estos trabajos, debe emplearse un número considerable de ecuaciones y variables.
3.1. Modelación del sistema biológico
En 1982, la Asociación Internacional de la Calidad del Agua (IAWQ, por sus siglas en inglés) incentivó la formación de un grupo de estudio internacional encargado de acelerar el desarrollo de la modelación dinámica de las plantas de tratamiento, crear una plataforma común consensual y proponer un modelo simple de inicio. El grupo concentró sus primeros esfuerzos en inventariar los modelos existentes, así como los obstáculos para su desarrollo. Se llegó a concluir que existía un gran número de modelos dinámicos, cuya difusión fue obstaculizada por la complejidad, la falta de orden para presentarlos y las limitaciones en el poder de las computadoras. Las conclusiones del grupo fueron publicadas en 1987 en un informe que presentaba lo conocido hoy como el modelo ASM1, dedicado a describir la degradación de materia orgánica, nitrificación y desnitrificación en un proceso de lodos activados (Henze et al., 1987). Los logros más destacados del grupo fueron un consenso en los procesos biológicos que integran el modelo, la estandarización de los símbolos, la presentación del modelo utilizando una notación matricial, la propuesta de valores “por defecto” de los parámetros del modelo y la adopción de la DQO y su fraccionamiento para caracterizar las aguas y los lodos.
En 1995, los trabajos del grupo de estudio renovado se prolongaron para publicar la versión ASM2, la cual está dirigida a predecir el comportamiento del fósforo. En 1999, hubo otras dos modificaciones con la aparición de la versión ASM2d (versión modificada del ASM2) y de la versión ASM3 (alternativa al ASM1), diseñado para ser el núcleo de diferentes modelos. El modelo ASM3 dio respuesta a fenómenos que el ASM1 fue incapaz de simular, como es el caso del almacenamiento de sustrato de reserva, para los períodos de ausencia de sustrato. Tomando en cuenta las semejanzas entre los sistemas convencionales de lodos activados y la parte biológica de los BM, la tendencia actual está enfocada al desarrollo de modelos dinámicos para los BM, tomando como base los principios y las ecuaciones biocinéticas agrupadas o desarrolladas para la familia de modelos ASM, los que constituyen, hasta el momento, el paradigma de la modelación dinámica de procesos de tratamiento basados en lodos activados.
3.1.1. Crecimiento y almacenamiento simultáneo de sustrato
En el modelo ASM1 se describió el crecimiento de la biomasa como resultado solamente de la degradación biológica del sustrato externo presente y, una vez agotado este sustrato, el consumo de oxígeno se debía a la muerte de microorganismos. En los sistemas convencionales de lodos activados, los regímenes de alimentación son altamente variables, por lo que la biomasa está sujeta a condiciones alternantes: de disponibilidad de sustrato externo (fase de abundante sustrato) y ausencia de sustrato externo (fase de hambruna) (Guisasola et al., 2005). Durante estas condiciones dinámicas de alimentación, el almacenamiento interno de polímeros juega un papel importante en el consumo de sustrato (Majone et al., 1999). El almacenamiento de sustrato ocurre fundamentalmente en forma de polímeros y lípidos, y constituye un mecanismo adicional y alternativo durante condiciones dinámicas de alimentación (Majone et al., 1999). Como consecuencia de este fenómeno, los coeficientes cinéticos y de rendimiento son diferentes. Este fenómeno de almacenamiento ocurre debido a que la síntesis de polímeros almacenados resulta más simple que la síntesis de una célula completa, requiriéndose de esta manera una menor adaptación por parte de los microorganismos, siendo mayor la respuesta del almacenamiento de sustrato que el propio crecimiento o la formación de más células a partir del consumo directo de sustrato (Daigger & Grady, 1982). Van Aalst-van Leeuwen et al. (1997) realizaron un estudio empleando un cultivo puro de Paraccocus pantotrophus, donde pudieron observar que durante estas condiciones de almacenamiento y crecimiento simultáneo el rendimiento heterótrofo era un 6 % menor al registrado para el consumo directo de acetato, en condiciones donde no ocurre almacenamiento de sustrato. El crecimiento en acetato con polihidroxibutirato (PHB) como intermedio parece ser bastante eficiente desde el punto de vista energético.
Por su parte, Beun et al. (2000) estudiaron el metabolismo del PHB en condiciones aerobias y el crecimiento paulatino de las bacterias, empleando lodos activados compuestos por diferentes cultivos de microorganismos, basándose en datos experimentales y en el empleo de modelos metabólicos. Durante el estudio se observó que, en condiciones de almacenamiento de sustrato en forma de polímeros, durante la fase de suministro de sustrato, entre un 66 % y un 100 % del sustrato consumido se emplea en la síntesis de PHB, mientras que el restante se emplea en el crecimiento directo de microorganismos y los procesos relacionados con el mantenimiento de la célula. Al mismo tiempo, se encontró que a altas edades de lodo las velocidades de crecimiento, tanto para la fase de abundante sustrato como para la fase de hambruna, resultaron ser similares, mientras que a bajas edades de lodo las velocidades de crecimiento en la fase de abundante sustrato resultaron ser relativamente mayor que en la fase de hambruna o ausencia de sustrato.
Carta et al. (2001) estudiaron la respuesta de los microorganismos en condiciones dinámicas de alimentación, para lo cual trabajaron con una población mixta de microorganismos, empleando como sustrato una mezcla de glucosa con acetato. Durante este estudio se evidenció un aparente consumo simultáneo de ambos sustratos, con un comportamiento relativamente similar a los reportados en estudios realizados con un solo sustrato, registrando una proporción de sustrato almacenado/sustrato consumido de 0.6 para ambos sustratos. La velocidad de consumo de acetato no se vio influenciada por el consumo simultáneo de glucosa. La cinética de degradación de los compuestos almacenados resultó ser la misma que para los sistemas en los que se estudió el almacenamiento de un solo sustrato. Por último, concluyeron que el crecimiento de un cultivo de microorganismos en sustratos mezclados se puede describir como la suma de las conversiones observadas en cultivos de microorganismos alimentados con sustratos individuales.
3.1.2. Estequiometría de la utilización de la materia carbonada considerando el fenómeno de crecimiento y almacenamiento simultáneo de sustrato
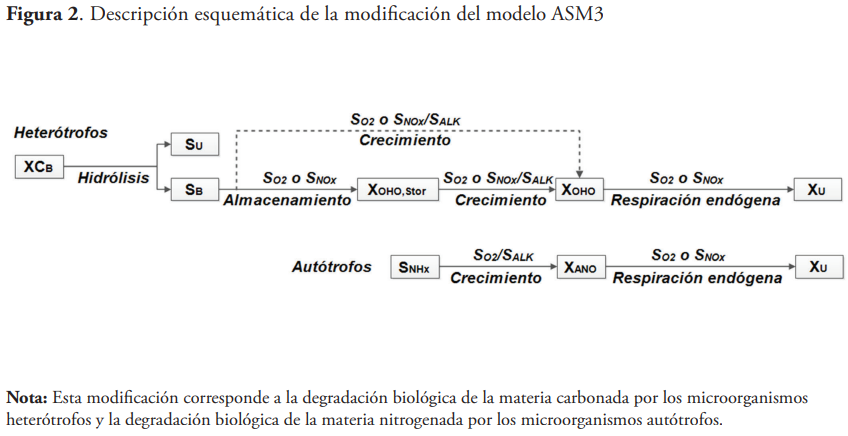
En los últimos años, se han realizado diversos trabajos de modelación relacionados con el crecimiento y almacenamiento simultáneo de sustrato, mediante la modificación de los modelos ASM1 y ASM3. El modelo ASM3 se desarrolló principalmente para tener en cuenta el fenómeno de almacenamiento de sustrato en forma de polímeros (Henze, 2000). A partir del comportamiento del sistema biológico de la instalación en estudio se puede concluir que para la simulación del sistema biológico se debe trabajar con el modelo ASM3, que tiene en cuenta el fenómeno de almacenamiento de sustrato, aunque para eso se trabajará con una versión modificada de este, en aras de lograr una mejor descripción y cuantificación de los fenómenos que ocurren en el referido sistema.
A continuación (figura 2), se muestra una descripción esquemática del modelo ASM3, así como también las modificaciones realizadas a ese modelo por varios autores, las cuales tienen en cuenta el crecimiento y el almacenamiento de sustrato en forma de polímeros (Beun et al., 2000; Carucci et al., 2001; Fan et al., 2011; Fan et al., 2012).
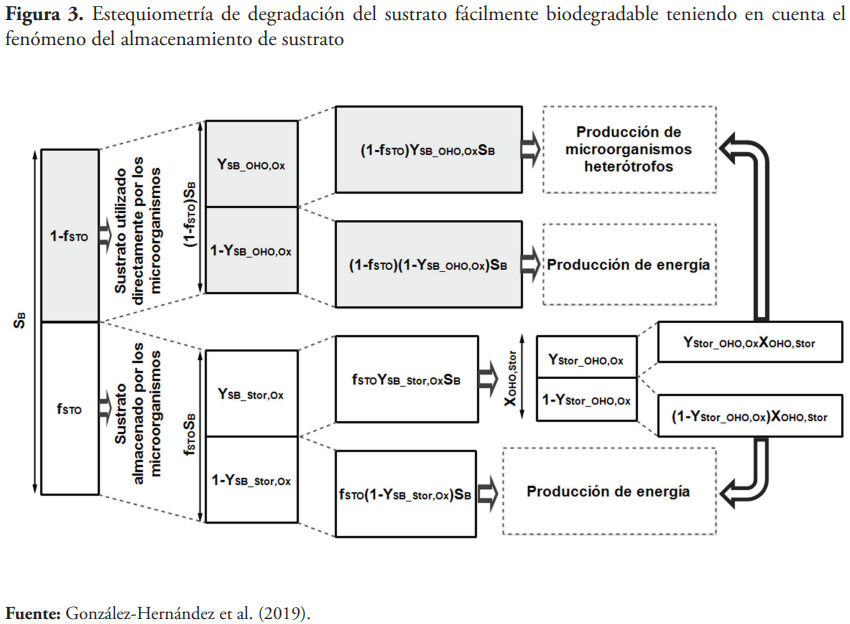
De acuerdo a la versión original del modelo ASM3, todo el sustrato fácilmente biodegradable es directamente almacenado por la biomasa cuando se le suministra sustrato externo y luego se utiliza como fuente de carbono y energía para el crecimiento de la biomasa en ausencia de sustrato (Guisasola et al., 2005). Sin embargo, esta hipótesis ha sido altamente criticada por muchos autores, quienes han propuesto otras versiones de ASM3 que tienen en cuenta la ocurrencia simultánea del proceso de almacenamiento de sustrato y el crecimiento de la biomasa a partir del consumo de sustrato externo (Fan et al., 2012; González-Hernández et al., 2019; Karahan-Gül et al., 2003; Krishna & Van Loosdrecht, 1999; Van Aalst-van Leeuwen et al., 1997; Van Loosdrecht & Heijnen, 2002). A continuación, se muestra la estequiometría de degradación del sustrato fácilmente biodegradable teniendo en cuenta el fenómeno del almacenamiento de sustrato, según lo reportado en la literatura (figura 3).
Guisasola et al. (2005) realizaron una comparación de los perfiles de respirometría, tras la adición de una misma cantidad de acetato para dos sistemas de lodos activados. Para el caso de los lodos que provenían de una instalación con una alimentación variable, los perfiles de respiración mostraron dos etapas claramente distinguibles: una primera etapa relacionada con el consumo directo de sustrato externo y una segunda etapa que corresponde al consumo de los polímeros almacenados inicialmente (Van Loosdrecht et al., 1997). Mientras que para el caso de los lodos que provenían de una planta con una alimentación estable, esta segunda fase no se observó.
Para la simulación de estos sistemas, es necesario tener en cuenta que una parte del sustrato fácilmente biodegradable que llega al sistema se almacena y se convierte en reserva por las bacterias en forma de polímeros para ser empleados en caso de ausencia de sustrato, mientras que la otra parte del sustrato fácilmente biodegradable se utiliza directamente en el crecimiento de los microorganismos. Las observaciones experimentales muestran que la razón de sustrato almacenado puede considerarse como constante (fSTO= 0.67 gDQOSSTO (gDQOSB)-1) (Beun et al., 2002; Beun et al., 2000; Dircks et al., 2001).
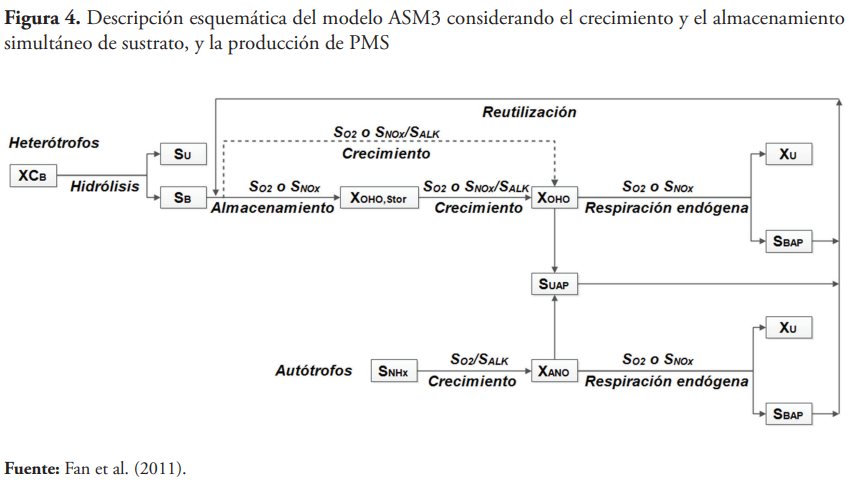
Por su parte, Fan et al. (2011) desarrollaron un modelo de lodos activados partiendo del modelo ASM3, pero teniendo en cuenta el crecimiento y el almacenamiento de sustrato simultáneo. Además, incluyó la producción de productos microbianos solubles asociados al uso (PAU) y asociados a la biomasa (PAB). En su modelo, la formación de PAU se asoció a los procesos de crecimiento de los microorganismos heterótrofos y autótrofos a partir de sustrato fácilmente biodegradable y de la reserva, tanto en condiciones aerobias como anóxicas, pudiendo ser reutilizadas solamente por los microorganismos heterótrofos. Sin embargo, la formación de PAU durante el proceso de almacenamiento de sustrato no se tuvo en cuenta. Por otro lado, la formación de PAB se asoció solamente a los procesos de muerte celular y no se tuvo en cuenta la formación de estos productos a partir de la hidrólisis de SPE. La figura 4 muestra la descripción esquemática de ese modelo.
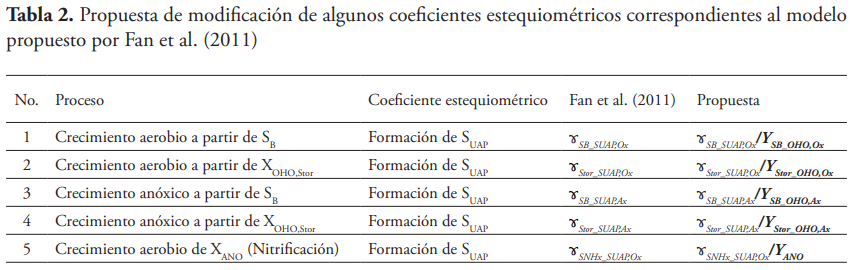
Cuando se analiza la continuidad del modelo propuesto por Fan et al. (2011), se puede constatar que presenta algunas deficiencias de continuidad, debido a la omisión del componente SN2 en el modelo y a errores en algunos de los coeficientes estequiométricos.
En la Tabla 2 se muestran los principales errores de continuidad que presenta el modelo de Fan et al. (2011) y la corrección propuesta en este trabajo.
En cuanto a la cinética de degradación del sustrato fácilmente biodegradable, se plantean dos teorías fundamentales: 1) El material almacenado se utiliza exclusivamente cuando escasea el sustrato fácilmente biodegradable (Bing-Jie & Han-Qing, 2008; Krishna & Van Loosdrecht, 1999; Saroj et al., 2008; Sin et al., 2005). En este caso, se emplea la expresión de Monod, que inhibe la utilización de material almacenado cuando existe suficiente sustrato fácilmente biodegradable disponible (KSB_OHO/KSB_OHO+SB); 2) El material almacenado se utiliza aun cuando existe sustrato fácilmente biodegradable disponible (Fan et al., 2012; González-Hernández et al., 2019). Los estudios realizados por González-Hernández et al. (2019) y Fan et al. (2012), donde se comparan ambas teorías, mostraron que la segunda, donde el sustrato fácilmente biodegradable y el sustrato almacenado se utilizan simultáneamente para la producción de energía y microorganismos, es la más adecuada.
3.1.3. Producción de sustancias poliméricas extracelulares enlazadas y solubles
En la actualidad, existe una tendencia marcada al empleo de modelos dinámicos integrados en la simulación del funcionamiento de BMS, donde se vinculan los procesos de degradación biológica con los procesos de filtración. Como bien se pudo apreciar anteriormente, ambos procesos están fuertemente relacionados entre sí por la producción de sustancias poliméricas extracelulares por los microorganismos durante el proceso de degradación biológica, sustancias que son muy dañinas para la membrana, debido a la gran viscosidad que presentan y a que se adhieren con facilidad a las paredes de la membrana, causando una rápida colmatación de esta. Hasta la fecha, diversos han sido los modelos biológicos desarrollados que tienen en cuenta la producción de estas sustancias (Di Bella et al., 2008; González-Zarragoitia et al., 2008; Janus & Ulanicki, 2010; Janus & Ulanicki, 2016; Lee et al., 2002; Lu et al., 2001; Mannina & Di Bella, 2012; Mannina et al., 2010; Mannina et al., 2011; Menniti & Morgenroth, 2010; Navaratna et al., 2012; Tian et al., 2011; Zuthi et al., 2012). De acuerdo con la teoría unificada de Laspidou y Rittmann (2002), las bacterias producen dos tipos de sustancias poliméricas extracelulares: enlazadas, que forman parte del flóculo; y solubles, que se encuentran disueltas en el lodo.
3.1.3.1. Sustancias poliméricas enlazadas al flóculo
La mayoría de las bacterias produce sustancias poliméricas extracelulares, las cuales participan en la formación de agregados microbianos donde viven comunidades de microorganismos suspendidos. Estos agregados microbianos formados por una matriz de grandes moléculas poliméricas que suspenden estas comunidades de microorganismos se denominan flóculos. Por definición, las SPE están en/o sobre la superficie de la célula. Su composición se puede controlar por diferentes procesos, tales como la secreción activa, el derrame de material de la superficie celular, la lisis celular, y la adsorción del medio ambiente (Laspidou & Rittmann, 2002). Entre las funciones de la matriz polimérica formada están la adhesión a las superficies, la formación de agregados de células bacterianas en flóculos o biofilmes, la estabilización de la estructura del flóculo, la formación de una barrera protectora que provee resistencia a los biocidas y otros efectos dañinos, la retención de agua, la sorción de compuestos orgánicos exógenos para la acumulación de nutrientes del medio ambiente, y la acumulación de actividades enzimáticas, tales como la digestión de macromoléculas exógenas para la adquisición de nutrientes.
Cinética de formación
Hasta la fecha, existe una gran controversia en cuanto a la producción de las SPE enlazadas. Por un lado, existen autores que han reportado una menor producción de SPE cuando se produce un rápido consumo de sustrato y crecimiento de los microorganismos, mientras que otro grupo de autores ha reportado el comportamiento opuesto, lo que indica que aparentemente la relación de la producción de SPE y la velocidad de crecimiento de la biomasa dependen del tipo de microorganismos involucrados y de las condiciones del sistema (Laspidou & Rittmann, 2002). Hasta ahora, han sido muchos los intentos de describir el proceso de producción de estas sustancias, pero no es menos cierto que no se ha podido establecer un modelo estándar que se adecue a cada sistema. Por su parte, Characklis y Marshall (1990) presentaron un modelo que describía la velocidad de formación de las SPE (rEPS; mgDQOXEPS L-1 s-1), empleando un cultivo de Pseudomonas aeruginosa donde la cinética de formación de SPE obedecía a la ecuación de Leudeking-Piret:
(1)
donde: µ (d-1) es la velocidad específica de crecimiento de los microorganismos, XBio es la concentración de la biomasa (mg L-1), k1 el coeficiente de formación de las SPE relacionado con el crecimiento de los microorganismos (gDQOXEPS (gDQOXBio)-1), k2 el coeficiente de formación de SPE no relacionado con el crecimiento de los microorganismos (gDQOXEPS (gDQOXBio)-1 d-1) y XBio es la concentración de la biomasa activa (mgDQO L-1).
Si en la ecuación anterior se sustituye la expresión de Monod, que describe la velocidad de crecimiento de la biomasa: µ=ûS/(KS+S), donde û corresponde a la velocidad máxima específica de crecimiento de los microorganismos, S es la concentración de sustrato y KS es el coeficiente de saturación media, entonces la ecuación de Leudeking-Piretz se puede expresar de la siguiente manera:
(2)
El primer término de la ecuación describe la formación de las SPE asociadas al crecimiento y el segundo asociado a la lisis celular endógena. Sin embargo, la ecuación de Leudeking-Piret no parece ser adecuada para la descripción de la cinética de las SPE, ya que no tiene en cuenta la pérdida de SPE como resultado de su hidrólisis/ disolución (Laspidou & Rittmann, 2002).
Una expresión alternativa para describir la cinética de las SPE se publicó por Hsieh et al. (1994), quienes desarrollaron un modelo mecanístico para describir la cinética de formación de las SPE, verificado con datos experimentales, para lo cual emplearon dos categorías de biomasa: suspendida y adherida, y donde para cada categoría asociaron las SPE enlazadas y solubles. La ecuación 3 muestra la expresión que describe la cinética de formación de las SPE:
(3)
donde: µP es la velocidad máxima específica de formación de las SPE enlazadas (d-1), fXP es la fracción de XBio que se convierte en XEPS (gDQOXEPS (gDQOXBio)-1), kd es el coeficiente de lisis celular (d-1), µPdiss es la velocidad máxima específica de degradaci ón de las SPE enlazadas (por hidrólisis o disolución), KPdiss constituye el coeficiente de saturación media para la relación XEPS/XBio (gDQOXEPS (gDQOXBio)-1) y S el sustrato empleado.
El primer término de la ecuación describe la formación de las SPE asociadas al crecimiento y el segundo asociado a la lisis celular endógena; mientras que el tercer término representa la pérdida de las SPE como resultado de la hidrólisis o de la disolución. Laspidou y Rittmann (2002) estudiaron el proceso de formación de las SPE en un reactor de flujo continuo, para lo cual realizaron un balance de masa de las SPE formadas, llegando a establecer que la velocidad de formación de las SPE se describía a partir de la ecuación 4.
(4)
donde: kEPS es el coeficiente de formación de las SPE enlazadas relacionado con el crecimiento de los microorganismos (gDQOXEPS (gDQOXBio)-1); rS es la velocidad de utilización del sustrato (gDQOS (gDQOXBio)-1 d-1) y kEPS,hyd es la velocidad de la hidrólisis de las SPE enlazadas (d-1). El primer término de la ecuación 4 establece que la velocidad de formación de las SPE es directamente proporcional a la utilización del sustrato y la biomasa, mientras que el segundo término define la pérdida de las SPE como resultado de la hidrólisis/disolución. No obstante, la teoría de Laspidou y Rittmann (2002) ha sido criticada en dos puntos fundamentales (Fenu et al., 2010a):
Según esta teoría, la formación de las SPE es directamente proporcional a la utilización de sustrato, por lo que, en condiciones transitorias, altas cargas orgánicas implicarían altas concentraciones de las SPE. Aquino y Stuckey (2008) no observaron esto y propusieron un modelo de formación de las SPE cuyos términos están relacionados a procesos no asociados al crecimiento, donde la velocidad de formación de SPE solo puede ser alta a altas concentraciones de biomasa.
(5)
La velocidad de hidrólisis/disolución de las SPE fue de 0.17 d-1 en Laspidou y Rittmann (2002), mientras que se redujo a 0.02-0.03 d-1 por Jang et al. (2006) y Aquino y Stuckey (2008). Al respecto, se ha propuesto una hipótesis importante de que una alta concentración de los productos de la hidrólisis podría reducir la velocidad del proceso de hidrólisis de las SPE.
De acuerdo a lo anterior, resulta claro que, con el aumento de la concentración de biomasa, se necesitaría una mayor cantidad de SPE para la formación del flóculo. Pero, el hecho de haber encontrado sistemas donde se observa el incremento de las SPE con el aumento de la velocidad de consumo de sustrato y el crecimiento de la biomasa no indica, obligatoriamente, que exista tal relación directa, pues puede darse el caso de sistemas donde no se haya alcanzado el equilibrio y la biomasa se encuentre en pleno proceso de crecimiento, mientras que existen sistemas donde ya se ha alcanzado la estabilidad (donde aproximadamente la misma cantidad de microorganismos que nacen, mueren), y la concentración de biomasa activa no varía significativamente. Por eso, el aumento de la velocidad de consumo de sustrato no debería influir significativamente en la concentración de la biomasa y de las SPE. Luego, de acuerdo a la segunda hipótesis y, teniendo en cuenta que la velocidad del proceso de hidrólisis será directamente proporcional a la proporción SPE enlazadas/microorganismos, el segundo término de la expresión de velocidad de formación de las SPE enlazadas de Aquino y Stuckey (2008) puede expresarse por la ecuación 6.
(6)
donde: KEPS,hyd es el coeficiente de saturación de la hidrólisis, KSB_OHO es el coeficiente de saturación para SB (mgDQO L-1) y KBAP_OHO es el coeficiente de saturación para SBAP (mgDQO L-1).
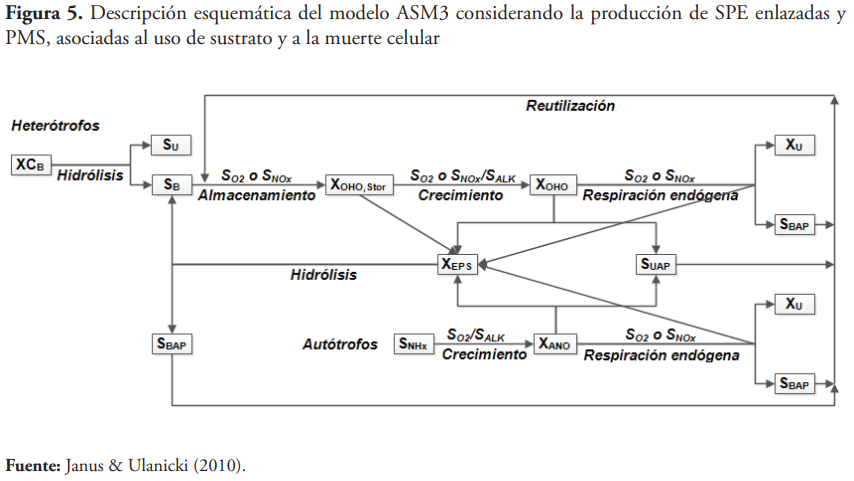
Es importante destacar que la diferencia principal entre las teorías de formación de las SPE propuestas por Laspidou y Rittmann (2002) y Aquino y Stuckey (2008) radica en que los primeros lo asociaron al crecimiento de los microorganismos, y que las SPE se hidrolizaban para dar origen a PAB, mientras que los segundos lo asociaron al proceso de lisis celular, y las SPE se hidrolizaban para dar lugar a la formación de PAB y de sustrato fácilmente biodegradable. A pesar de esto, Janus y Ulanicki (2010) trabajaron con una versión extendida del modelo ASM3 que tiene en cuenta no solo la producción de PMS, sino también la formación y la hidrólisis de SPE, dando lugar a la formación de SB y SBAP, a partir de una integración de las teorías propuestas por Laspidou y Rittmann (2002) y Aquino y Stuckey (2008). En la Figura 5 se muestra la descripción esquemática de ese modelo.
Janus y Ulanicki (2010) incluyeron correctamente en su modelo los procesos relacionados con la formación de PAB, que en este caso está relacionada fundamentalmente con el proceso de lisis celular y el proceso de hidrólisis de XEPS (Aquino & Stuckey, 2008):
(7)
donde: b es el coeficiente de lisis celular (d-1), γBAP el coeficiente estequiométrico de formación de BAP asociado a la lisis celular (gDQOSBAP (gDQOXBio)-1) y fSB_EPS,hyd es la fracción de SB generada durante la hidrólisis de XEPS.
La formación de SPE en el modelo de Janus y Ulanicki (2010) se describe a partir de la ecuación de Leudeking-Piret con un término adicional que tiene en cuenta el proceso de hidrólisis/disolución:
(8)
donde: γEPS,g es el coeficiente estequiométrico de formación de SPE asociado al crecimiento de la biomasa (gDQOXEPS (gDQOXBio)-1), bd es el coeficiente de lisis celular (d-1), γEPS,d el coeficiente estequiométrico de formación de SPE asociado a la lisis celular (gDQOXEPS (gDQOXBio)-1).
La ecuación anterior constituye una resultante de la unificación de las teorías de Laspidou y Rittmann (2002) y Aquino y Stuckey (2008). De acuerdo con Laspidou y Rittmann (2002), el proceso de formación de SPE está asociado únicamente al crecimiento de los microorganismos, y las SPE se hidrolizan formando PAB y sustrato fácilmente biodegradable. Mientras que, de acuerdo con Aquino y Stuckey (2008), el proceso de formación se describe solamente con los dos últimos términos de la ecuación anterior, o sea, su producción a partir de los procesos no asociados al crecimiento; en este caso, la lisis celular y el proceso de hidrólisis/disolución de XEPS. La evaluación del modelo de Janus y Ulanicki (2010) con datos experimentales procedentes de otros trabajos, bajo diferentes condiciones de operación, evidenciaron una buena predicción del comportamiento de las SPE enlazadas y los PMS. Estos resultados no están en correspondencia con la teoría propuesta por Aquino y Stuckey (2008).
3.1.3.2. Sustancias poliméricas solubles
Otros productos relacionados con el metabolismo de los microorganismos lo constituyen los PMS o las denominadas SPE solubles, que se definen como componentes celulares solubles liberados durante la lisis celular, difundidos a través de la membrana celular, que se pierden durante la síntesis o se excretan por algún propósito. Estos compuestos poseen un peso molecular moderado y son biodegradables. Los PMS se pueden dividir en dos categorías: productos asociados al uso, que son producidos directamente durante el metabolismo del sustrato, y productos asociados a la biomasa, formados a partir de la biomasa, presumiblemente como parte de la muerte celular (Namkung & Rittmann, 1986).
Cinética de formación
Cuando se analiza la bibliografía, parece existir una convergencia de criterios en cuanto a la formación y los mecanismos de degradación de los PAU. La mayoría de los autores plantea que la formación de estas sustancias es directamente proporcional a la velocidad de consumo de sustrato y a la concentración de la biomasa (Laspidou & Rittmann, 2002; Lu et al., 2001; Namkung & Rittmann, 1986). Rittmann y McCarty (2000) presentaron la cinética de formación a partir de la ecuación 9.
(9)
donde: kUAP es el coeficiente de formación de PAU (gDQOSUAP (gDQOXBio)-1) y q es la velocidad específica de utilización del sustrato (gDQO (gDQOXBio)-1 d-1).
Contrario a Laspidou y Rittmann (2002), Lu et al. (2001) diferenciaron la formación de PAU por los microorganismos heterótrofos y autótrofos, donde estos últimos solamente podían producirlos y no degradarlos. Por su parte, Jiang et al. (2008), de acuerdo a sus estudios experimentales combinados con la modelación, plantearon dos hipótesis en cuanto a la formación de PAU: los que se producen durante el proceso de almacenamiento de sustrato tienen menor peso molecular y son biodegradables, mientras que los que se producen durante el proceso de degradación del material almacenado presentan un mayor peso molecular, siendo más difíciles de degradar.
Por otro lado, no existe consenso en cuanto a la formación y los mecanismos de degradación de los PAB (Fenu et al., 2010a). Laspidou y Rittmann (2002) sugirieron que los PAB se forman únicamente a partir de la hidrólisis de las SPE, pero otros estudios han demostrado que estos productos se forman también a partir de la lisis celular (Aquino & Stuckey, 2008).
3.1.4. Influencia de las sustancias poliméricas extracelulares en el proceso de colmatación de la membrana
Las sustancias poliméricas extracelulares constituyen uno de los componentes principales de los lodos activados, y uno de los más importantes factores en el proceso de colmatación de la membrana (Cho & Fane, 2002; Judd, 2004; Nagaoka & Akoh, 2008; Yigit et al., 2008). Estas sustancias se pueden encontrar de dos maneras diferentes: enlazadas al flóculo o disueltas, dependiendo de su localización o del papel que juegan en el metabolismo microbiano (Comte et al., 2006). Las SPE enlazadas al flóculo están constituidas por polisacáridos, ácidos nucleicos, lípidos, ácidos húmicos, etc., los cuales se localizan en el exterior de la superficie de la célula (Meng et al., 2009). Las SPE solubles o PMS se definen como componentes celulares solubles que son liberados durante la lisis celular, difundida a través de la membrana celular, consumidas durante la síntesis o simplemente se excretan para algún propósito (Laspidou & Rittmann, 2002). Una característica que tienen en común es que ambos constituyen material orgánico de origen microbiano que contienen electrones y carbono, pero no son células activas (Laspidou & Rittmann, 2002). Al principio se creía que la biomasa era la principal responsable de la formación de la torta de lodo. Más tarde, se consideró que las SPE enlazadas al flóculo son las principales responsables de la formación de la torta de lodo y de la resistencia específica a la filtración. Pese a esto, en los últimos años se ha prestado mucha más atención a los PMS y otras sustancias orgánicas solubles por el efecto que causan, llegando a considerarse cruciales en el proceso de colmatación de la mem brana (Lin et al., 2014).
3.1.4.1. Efectos de las sustancias poliméricas extracelulares enlazadas al flóculo
Las SPE enlazadas no solo se reportan como el principal componente responsable de mantener el flóculo en una matriz tridimensional, sino también como el factor clave en el proceso de colmatación de la membrana. Cho et al. (2005) encontraron una relación entre las SPE enlazadas y la resistencia específica de la torta a la filtración, estableciendo una ecuación funcional en la cual la resistencia específica a la filtración (αc) es directamente proporcional a la concentración de las SPE enlazadas. La expresión desarrollada por Cho et al. (2005) se obtuvo mediante un análisis dimensional y el ajuste de un modelo no lineal, empleando datos experimentales, seleccionando para eso la curva de parámetros Chapman-4 (ecuación 10).
(10)
En la expresión anterior a, b, c y d constituyen constantes empíricas, que se obtienen a través de un proceso de calibración descrito por los autores, µs es la viscosidad del lodo (Pa s), SSMP es la concentración de PMS (mgDQO L-1) y XTSS es la concentración de SST (g L-1). Por su parte, Ahmed et al. (2007) también observaron el incremento de la resistencia específica a la filtración como resultado del incremento de la concentración de polisacáridos, lo que trajo consigo un aumento de la presión transmembranal (PTM). Janus (2014) determinó la resistencia específica a la filtración mediante una modificación de la expresión propuesta por Ahmed et al. (2007). Ji y Zhou (2006) indicaron que tanto la composición como la cantidad de SPE adherida a la superficie de la membrana influyen en el proceso de colmatación de aquella, y que el contenido total de biopolímeros en la suspensión de lodo juega un papel más importante que las SPE enlazadas que se reflejan en la extensión del proceso de colmatación de la membrana. Aunque no existe información disponible en la literatura, se cree que las macromoléculas, como las SPE enlazadas, contribuyen a fortalecer la adhesión de las partículas, así como también su relación con la compresibilidad de la torta de lodo formada sobre la superficie de la membrana (Lin et al., 2014). Patsios y Karabelas (2011) demostraron el efecto crítico de la materia orgánica disuelta y las SPE enlazadas en la colmatación de la membrana.
A pesar de que son muchos los estudios que demuestran la influencia de estas sustancias en el proceso de colmatación de la membrana, existen otros que reportan una pequeña correlación de estas sustancias con el proceso de colmatación de esta. Rosenberger y Kraume (2003) no observaron una influencia significativa de las SPE enlazadas en la filtrabilidad del lodo, a diferencia de las SPE solubles, que resultaron ser las de mayor impacto. Esto fue confirmado por Yamato et al. (2006), quienes no encontraron una relación clara de estas sustancias con el proceso de colmatación de la membrana, reportando concentraciones de SPE enlazadas inferiores a 10 mg g-1 de sólidos suspendidos. Pan et al. (2010) no encontraron una influencia significativa de las SPE enlazadas en la colmatación de la membrana.
Todas estas investigaciones muestran, en general, la gran influencia o el impacto que tienen las características del lodo en el proceso de colmatación de la membrana, y que las SPE enlazadas no pueden considerarse como las únicas sustancias que influyen en ese proceso. Independientemente de las investigaciones y las diferentes discrepancias de los resultados obtenidos por muchos autores, es claro que estas sustancias están muy relacionadas con las características del lodo, tales como: el índice de volumen del lodo, la floculación, la hidrofobicidad, la carga de la superficie y la viscosidad del lodo, directamente relacionadas con el proceso de colmatación de la membrana (Meng et al., 2009). Al mismo tiempo, es importante tener en cuenta que no existe un procedimiento estándar de extracción de estas sustancias (Drews et al., 2006; Judd, 2010; Liu & Fang, 2002), lo que puede ser la causa de las principales discrepancias reportadas por los diferentes autores en el transcurso de los años. No obstante, su influencia directa o indirecta en el proceso de colmatación de la membrana debe incluirse en la modelación de este fenómeno.
3.1.4.2. Efectos de las sustancias poliméricas extracelulares solubles
Recientemente, la influencia de las SPE solubles o PMS ha atraído la atención de los investigadores (Drews et al., 2008; Geng & Hall, 2007; Jeong et al., 2007; Jiang et al., 2010; Kim & Nakhla, 2009; Marín et al., 2017; Paul & Hartung, 2008; Rosenberger et al., 2005; Rosenberger et al., 2006; Wang et al., 2009; Wu et al., 2008; Yao et al., 2011). Geng y Hall (2007) observaron que la distribución de la talla de los flóculos y la cantidad de SPE solubles o PMS en la mezcla de licor fueron los elementos más importantes que influyeron en el proceso de colmatación de la membrana. Las SPE enlazadas no mostraron influencia significativa en la colmatación de la membrana. Rosenberger et al. (2006) encontraron que los PMS contenidos en el lodo (materiales solubles y coloidales) tenían un mayor impacto en la colmatación de la membrana y que podían provocar diferencias en el funcionamiento de las membranas entre dos BM idénticos. Yao et al. (2011) obtuvieron que la colmatación irreversible era directamente proporcional a la concentración de PMS. Pan et al. (2010) observaron que los solutos como los PMS contenidos en la mezcla de licor son responsables de la colmatación de la membrana, lo que no se puede prevenir mediante el incremento de la intensidad de aireación. Kim y Nakhla (2009) reportaron que las mayores velocidades de colmatación se favorecieron preferiblemente por los PMS que por las SPE enlazadas. De igual manera, Wang et al. (2009) y Marín et al. (2017) observaron una correlación mucho más acentuada de los PMS con la colmatación de la membrana que con las SPE enlazadas. La mayoría de las sustancias orgánicas solubles, incluyendo los PMS, pueden entrar en los poros de las membranas de micro y ultrafiltración, las cuales por el tamaño de sus moléculas y sus propiedades adherentes pueden acumularse parcialmente en el interior de los poros de la membrana, ocasionando la obstrucción de estos (Lin et al., 2014). Jiang et al. (2010) reportaron que un mayor porcentaje de moléculas de bajo peso molecular de PAU causaron un bloqueo de poros de la membrana mucho más severo que los PAB. Wu et al. (2008) encontraron que los PMS constituyen las sustancias solubles con mayor influencia en el bloqueo u obstrucción de los poros.
Quizás el componente más corriente y más mencionado con relación al proceso de colmatación de la membrana lo constituye el grupo de los productos microbianos solubles (Drews, 2010; Meng et al., 2009). Dependiendo de la preparación de la muestra y la técnica analítica, estos grupos contienen biopolímeros solubles y coloidales, mayormente polisacáridos (PS) o carbohidratos, y proteínas. Principalmente, los PS se han considerado responsables de causar la colmatación de la membrana (Jarusutthirak et al., 2002; Kimura et al., 2019; Rosenberger et al., 2005); algunas veces los PS causan mayor colmatación que los coloides orgánicos (Wu & Huang, 2009). Kayaalp et al. (2014) encontraron una fuerte relación entre las SPE totales y las resistencias a la filtración, donde la resistencia de la torta resultó ser la más significativa. Los análisis realizados revelaron una mayor acumulación de proteínas que de carbohidratos debido a que las proteínas eran más pegajosas.
3.2. Modelación del proceso de colmatación de la membrana
Hasta el momento, se han analizado los principales aspectos relacionados con la modelación del sistema biológico y la importancia de estos en la predicción del comportamiento de la PTM, teniendo en cuenta la influencia de los SST y las SPE en el proceso de colmatación de la membrana. La predicción del comportamiento de la PTM dependerá considerablemente de la calidad de las predicciones de las concentraciones de las sustancias producidas por los microorganismos más influyentes en el proceso de colmatación de la membrana. A continuación, se describen una serie de modelos correspondientes al proceso de colmatación de la membrana, para sistemas que trabajan a caudal constante de filtración.
3.2.1. Modelo de Li y Wang (2006)
Entre los modelos más empleados para la descripción del proceso de colmatación de la membrana se encuentra el modelo propuesto por Li y Wang (2006) para sistemas de filtración a caudal constante. El modelo permite determinar la masa suspendida que se adhiere sobre la superficie de la membrana y, de esta manera, calcular las resistencias a la filtración que ejerce la torta de lodo que se forma sobre la superficie de la membrana. La predicción de la PTM en el modelo se realizaba a partir del cálculo de la resistencia total, como la suma de la resistencia intrínseca de la membrana, la resistencia de la torta de lodo y la resistencia de los poros, para lo que se dividió la membrana en 128 secciones y se asumió que eran atravesadas por un flujo de igual magnitud y sentido, lo que realmente no es cierto, por lo que constituye una deficiencia del modelo.
3.2.2. Modelo de Liang et al. (2006)
Liang et al. (2006) desarrollaron un modelo matemático para la descripción del proceso de colmatación de la membrana que permitió la cuantificación de la colmatación reversible e irreversible de la membrana. Los autores en su modelo destacan el papel de los sólidos suspendidos totales en la colmatación reversible de la membrana, y el de las sustancias solubles y coloidales en la colmatación irreversible de la membrana. El modelo fue exitosamente calibrado y validado con datos experimentales, obteniéndose una buena correspondencia entre la salida del modelo y los datos experimentales.
3.2.3. Modelo de Wu et al. (2012)
Wu et al. (2012), partiendo del modelo de Li y Wang (2006), desarrollaron un modelo más fenomenológico que tuvo en cuenta el efecto del tamaño de las partículas en el proceso de colmatación de la membrana, incluyendo en su modelo la determinación de las partículas coloidales entrampadas en la torta de lodo formada y las partículas solubles adheridas a las paredes de los poros de la membrana.
3.2.4. Modelo de Wu et al. (2013)
Igualmente, se han publicado algunos trabajos interesantes sobre la modelación relacionada con la descripción del proceso de colmatación de la membrana, que tienen en cuenta los efectos negativos y positivos del proceso de colmatación de la membrana.
Wu et al. (2013) desarrollaron un modelo que combina los procesos de degradación biológica con los de separación física, que tuvo en cuenta la remoción de la DQO soluble durante el paso del fluido a través de la membrana durante el proceso de filtración. Para el desarrollo de este modelo se partió de la base de que parte de la DQO soluble es adsorbida por la torta y la membrana, mientras que una porción se transporta de regreso al sistema como resultado de la aireación y otra parte es degradada por la biomasa que habita dentro de la torta de lodo durante el paso del fluido a través del sistema torta-membrana.
3.2.5. Modelo de Wang y Li (2014)
Por su parte, Wang y Li (2014) modelaron la deposición de partículas individuales sobre la superficie de una membrana limpia en un sistema de filtración cruzada; para esto, tuvieron en cuenta las fuerzas aleatorias Brownianas y la componente polar de las fuerzas interactivas del sistema partícula-membrana. El modelo desarrollado permite ser expandido para tener en cuenta condiciones de filtración mucho más complejas.
3.2.6. Modelo de Liu et al. (2018)
Liu et al. (2018) desarrollaron un modelo de deposición de partículas coloidales teniendo en cuenta la probabilidad de colisiones de estas sobre la superficie de la membrana, empleando para eso la distribución de Boltzmann, obteniendo una buena correspondencia entre los valores de salida del modelo y los datos experimentales. Sin embargo, este modelo no tuvo en cuenta la naturaleza de las sustancias que colmatan la membrana, como es el caso de las SPE enlazadas y solubles, debido a la viscosidad que presentan.
3.3. Modelos integrados
El primer modelo integrado empleado para la simulación del funcionamiento de un BMS fue desarrollado por Zarragoitia-González (2009), donde por primera vez se enlaza el modelo biológico con el modelo de colmatación de la membrana, teniendo en cuenta de esta manera la influencia de las propiedades del sistema biológico sobre el proceso de colmatación de la membrana, en este caso las concentraciones de SST y de SPE solubles, así como también la viscosidad del lodo. Sin embargo, con este modelo se alcanzó hasta un 30 % de error relativo medio en la estimación de las variables biológicas, y hasta un 13.7 % en la estimación de la PTM, que constituye el principal parámetro de control de estos sistemas.
De manera similar, Di Bella et al. (2008) desarrollaron un modelo matemático compuesto por dos submodelos: uno de degradación biológica y el otro de filtración con membranas. El biológico fue construido a partir de los conceptos de los ASM. Por su parte, el de filtración fue desarrollado considerando la teoría “lecho profundo” que tiene en cuenta, además, el efecto de la torta de lodo. Finalmente, este modelo fue exitosamente validado en una planta piloto en la que mostró una buena correspondencia con los resultados experimentales.
Por su parte, Mannina et al. (2011) emplearon el modelo integrado propuesto por Di Bella et al. (2008), con algunas modificaciones. Un innovador protocolo de calibración fue aplicado para evaluar los valores de los parámetros del modelo. Este protocolo estaba basado en un análisis de sensibilidad global preliminar para reducir el número de parámetros del modelo a ser calibrado hasta obtener los más influyentes. Finalmente, los resultados del modelo mostraron una buena correspondencia con los experimentales de una planta piloto de un BM.
Recientemente, Zuthi et al. (2013) modificó el modelo biológico ASM1-PMS propuesto por Lu et al. (2001). Las modificaciones consistieron en la inclusión de solo cuatro ecuaciones diferenciales lineales en el modelo ASM1-PMS, las cuales permitirían, en integración al modelo de colmatación empleado por Zarragoitia-González (2009) y Mannina et al. (2011), simular mejor la calidad del efluente y la predicción de la colmatación de la membrana. Este nuevo modelo integrado podría ser utilizado en estudios de optimización de los parámetros de operación para lograr un mejor tratamiento y control de la colmatación de la membrana.
En otro sentido, Janus (2014) consideró el efecto de las SPE solubles en el proceso de colmatación de la membrana a partir de la integración de una versión extendida del modelo ASM3 con el modelo de colmatación de la membrana propuesto por Liang et al. (2006). Es importante destacar que en este caso no se tuvo en cuenta la influencia de las SPE enlazadas al flóculo en el proceso de colmatación de la membrana, solo se consideró la influencia de estas en la concentración de las SPE solubles, ya que estas últimas se producen también a partir de la hidrólisis de las SPE enlazadas al flóculo.
Posteriormente, Janus y Ulanicki (2016) emplearon una versión extendida del modelo ASM1, teniendo en cuenta la producción de las SPE solubles y enlazadas al flóculo, y la influencia de estas en el proceso de colmatación de la membrana, a partir de la utilización de una versión modificada del modelo de colmatación de la membrana propuesto por Liang et al. (2006). En este caso, por primera vez se tuvo en cuenta la influencia de las SPE solubles y enlazadas al flóculo en el proceso de colmatación de la membrana. De igual manera, el modelo integrado permitía la predicción de la calidad del efluente teniendo en cuenta la influencia de la torta de lodo.
3.4. Perspectivas de la modelación de biorreactores con membranas
La modelación de estos sistemas constituye una herramienta indiscutible para el estudio de estas instalaciones. Aunque es evidente el avance en la modelación de estos sistemas, todavía no se logra una descripción completamente fenomenológica del sistema biológico enlazado al proceso de colmatación de la membrana. El fenómeno de crecimiento y almacenamiento simultáneo de sustrato constituye un elemento importante a tener en cuenta en los modelos biológicos, así como también la producción de PMS y SPE enlazadas al flóculo, no solo por la influencia de estas en el proceso de colmatación de la membrana, sino también por la relación que guardan entre ellas, considerando la producción de los PMS o SPE solubles asociada directamente al metabolismo de los microorganismos, y también a partir de la hidrólisis de las SPE enlazadas al flóculo.
A partir del estudio realizado, se pudo constatar la importancia del empleo de los modelos integrados para la optimización de los biorreactores con membranas, ya que permiten una descripción más aproximada de la realidad, teniendo en cuenta la influencia de las características del sistema biológico en el proceso de colmatación de la membrana.
No obstante, todavía existe una reserva considerable en cuanto a las variables que relacionan los modelos que describen estos sistemas. En la mayoría de los casos, se consideran de manera individual los efectos de la concentración de los sólidos suspendidos totales y de las sustancias poliméricas extracelulares solubles o enlazadas al flóculo en el proceso de colmatación de la membrana. Sin embargo, en la literatura se demuestra la influencia directa y simultánea de las sustancias poliméricas extracelulares en el proceso de colmatación de la membrana, por lo que se recomienda la consideración simultánea de sus efectos.
3. Conclusiones
En los últimos años, se ha producido un incremento significativo en el empleo de los biorreactores con membranas en el tratamiento de aguas residuales urbanas e industriales. Sin embargo, estas instalaciones no operan al máximo de sus potencialidades, debido a los costos asociados a los procesos de aireación del sistema biológico y al proceso de colmatación de la membrana. La experimentación en este tipo de instalación resulta costosa, ya que implica un gran consumo de recursos, esfuerzos y tiempo. La modelación de estos sistemas constituye una herramienta indiscutible para el estudio de estas instalaciones. Pero, aunque es evidente el avance en la modelación de estos sistemas, todavía no se logra una descripción completamente fenomenológica del sistema biológico enlazado al proceso de colmatación de la membrana. El fenómeno de crecimiento y almacenamiento simultáneo de sustrato constituye un elemento importante a tener en cuenta en los modelos biológicos, así como también la producción de PMS y SPE enlazadas al flóculo, tanto por la influencia de estas en el proceso de colmatación de la membrana, como por la relación que guardan entre ellas, considerando la producción de los PMS o SPE solubles no solo asociada directamente al metabolismo de los microorganismos, sino también a partir de la hidrólisis de las SPE enlazadas al flóculo.
Por otro lado, todavía existe una reserva considerable en cuanto a las variables que relacionan los modelos que describen estos sistemas, donde en mayoría de los casos se consideran de manera individual los efectos de la concentración de sólidos suspendidos totales, las sustancias poliméricas extracelulares solubles o enlazadas al flóculo en el proceso de colmatación de la membrana. Sin embargo, en la literatura se demuestra la influencia directa y simultánea de estas sustancias en el proceso de colmatación de la membrana, por lo que se recomienda la consideración simultánea de los efectos de las sustancias antes mencionadas en dicho proceso.