Ciencia, Ambiente y Clima, Vol. 3, No. 2, juio-diciembre, 2020 • ISSN (impreso): 2636-2317 • ISSN (en línea): 2636-2333, • Sitio web: https://revistas.intec.edu.do/
MONITOREO DE RESIDUOS DE PLAGUICIDAS EN AJÍES DULCES EN MERCADOS SELECTOS DE SAN JOSÉ DE OCOA Y SANTO DOMINGO, REPÚBLICA DOMINICANA
Pesticide residue monitoring in sweet peppers in select markets of San José de Ocoa and Santo Domingo, Dominican Republic
Cómo citar: Vallejo Degaudenzi, A., Pérez, F., Marranzini, C., & Tavárez, J. (2020). Monitoreo de residuos de plaguicidas en ajíes dulces en mercados selectos de San José de Ocoa y Santo Domingo, República Dominicana. Ciencia, Ambiente y Clima, 3(2), 37-48. Doi: https://doi.org/10.22206/cac.2020.v3i2.pp37-48
Introducción
El sector agrícola se encuentra en el corazón de las economías, representa una gran parte del producto interno bruto, emplea una gran proporción de la fuerza laboral, representa una fuente importante de divisas, suministra la mayor parte de los alimentos básicos y proporciona subsistencia y otros ingresos a más de un 50 % de la población de los países en vías de desarrollo (Byerlee, De Janvry, Sadoulet, Townsend, & Klytchnikova, 2008; Lipton, 2005). Los plaguicidas suelen ser utilizados considerablemente en cosechas de productos convencionales, que tienen una alta demanda de consumo, resultándole más conveniente al agricultor utilizar mayor cantidad de plaguicidas, en vez de restringir el tamaño del cultivo o aplicar mejores prácticas de manejo integrado de plagas. Unas de las plantas o productos alimenticios que se encuentran altamente expuestas a este tipo de cosechas son los ajíes (Capsicum annum).
Dado el aumento de la demanda de ajíes a nivel mundial, se ha incrementado la producción nacional, incluso en zonas donde usualmente no se encuentran de forma natural, dando como resultado que los plaguicidas sean utilizados cada vez en mayor cantidad para aumentar el rendimiento de la cosecha. Por lo tanto, es indiscutible la necesidad de controlar de alguna manera el uso de plaguicidas, usando respuestas analíticas rápidas y confiables.
La estimación de los residuos de plaguicidas en matrices alimenticias, como los ajíes, es un desafío complejo. Esto se debe, principalmente, a que las cantidades de analitos son muy pequeñas comparadas con las cantidades de sustancias que interfieren fuertemente al interaccionar con los analitos (Wilkowska y Biziuk, 2011). Se ha utilizado una amplia variedad de técnicas para extraer y purificar plaguicidas de frutas y vegetales, incluida la extracción líquido-líquido (LLE) (Duca, Salquebre, Hardy, & Appenzeller, 2014), extracción en fase sólida (SPE) (Rotich, Zhang y Li, 2003), extracción acelerada por solvente (ASE) (Adou, Bontoyan y Sweeney, 2001; Leyva-Morales, Valdez-Torres, Bastidas-Bastidas, y Betancourt-Lozano, 2015), cromatografía de permeación en gel (GPC) (Lu et al., 2012; Luzardo et al., 2013), extracción asistida por microondas (MAE) (Satpathy, Tyagi, y Gupta, 2011; Barriada-Pereira et al., 2005), matriz en dispersión en fase sólida (MSPD) (Dagnac, Garcia-Chao, Pulleiro, Garcia-Jares, y Llompart, 2009; Satpathy et al., 2011) y extracción con fluido supercrítico (SFE) (Valverde García, Fernández Alba, Contreras, & Aguera, 1996).
Anastassiades, Lehotay, Štajnbaher y Schenck (2003) introdujeron la técnica QuEChERS (rápida, fácil, económica, robusta, segura por sus siglas en inglés) de preparación de muestras en el 2003, superando las limitaciones y desventajas de algunas técnicas de extracción tradicionales para residuos de plaguicidas. Debido a esto, el método ha sido ampliamente utilizado en la determinación de residuos de plaguicidas en varias matrices (Concha-Meyer et al., 2019; Da Costa Morais, Collins, y Jardim, 2018; Montiel-León et al., 2019; Wang, Duan, Ma, Zhang, & Zhang, 2019). Además, la aplicación de este método, que incluye el constructor de acetato (Lehotay, Maštovská, & Lightfield, 2005) y la versión de buffer de citrato (Anastassiades et al., 2007) permiten la extracción de compuestos ácidos, básicos y neutros, obteniendo resultados exactos y precisos debido a las altas recuperaciones de los analitos. Los procesos de extracción genéricos como el método QuEChERS y los sistemas de cromatografía de gases acoplados al detector selectivo de masas (GC-MS) proporcionan una excelente forma de pico, buena resolución y nos permite detectar un espectro muy amplio de compuestos que pertenecen a diferentes clases de plaguicidas (Schreiber, & Pace, 2010). El principal método recomendado para la identificación y confirmación de residuos de plaguicidas en los alimentos por las guías internacionales vigentes del Codex Alimentarius, la Comisión de Regulación Europea y la Secretaría del Convenio de Estocolmo es la de GC/MS. (Codex Committee on Pesticide Residues (CCPR), 2017; European Comission, 2017; Weber, 2017). En adición, se recomienda para el control de calidad, una validación con una muestra fortificada con los plaguicidas para medir el rendimiento de la extracción (McRitchie et al., 2018).
Con el fin de garantizar la seguridad alimentaria de los consumidores y proteger la salud humana, muchas organizaciones y países han establecido límites máximos de residuos (LMR) de plaguicidas en productos alimenticios (Codex Alimentarius FAO/WHO, 2020; European Commission, 2020; United States Department of Agriculture Foreign Agricultural Service, 2020). El LMR es el nivel máximo de un residuo de plaguicida (expresado en mg·kg−1) que está legalmente permitido en alimentos o piensos (Codex Alimentarius FAO/WHO, 2020). De igual forma, los gobiernos también establecen mecanismos de reglamentación y aplicación para supervisar el cumplimiento de los LMR en los distintos productos alimenticios.
Los plaguicidas que pueden causar riesgos laborales y ambientales en América Central están ampliamente documentados (Allsopp, & Erry, 2000). El uso de plaguicidas tóxicos en el Caribe estuvo en crecimiento en las décadas pasadas y se estima que seguirá aumentando en los tiempos actuales. Los altos niveles de exposición y la ineficacia del equipo de protección personal evidencian las dos dificultades para la reducción del riesgo laboral para la aplicación de plaguicidas (Wesseling et al., 2001).
En República Dominicana, el Ministerio de Agricultura, a través del Departamento de Inocuidad Agroalimentaria (DIA), elaboró el “Plan de Monitoreo y Vigilancia de Residuos e Higiene de los Alimentos (MOVIREHA)” y ejecutó su primer plan nacional a través del proyecto de Monitoreo de Residuos de Plaguicidas en Frutas y Vegetales en el 2011. Según los resultados de este proyecto, los datos de los planes anuales de los Programas de “Monitoreo y Control de Residuos de Plaguicidas en Frutas y Vegetales Producidos en la República Dominicana”, realizados entre los años 2011 y 2015, y las notificaciones de rechazos de productos exportados por las autoridades reglamentarias de la Unión Europea y de los Estados Unidos, han permitido concluir que los productos que tuvieron mayores niveles de plaguicidas fueron los ajíes dulces y picantes, seguidos por el brócoli. Estos resultados corroboran las conclusiones del análisis de 574 muestras de un programa anual de monitoreo de residuos de plaguicidas realizado durante el 2016 en República Dominicana, a cargo del DIA del Ministerio de Agricultura.
Existe un consumo generalizado de los ajíes como parte de los alimentos de la población dominicana y su cultivo constituye una fuente de sustento para muchos agricultores. La mayoría de los agricultores utilizan plaguicidas sintéticos para controlar las plagas en los vegetales y aumentar el rendimiento de los cultivos. Frente a esta situación, los agricultores tienden a abusar de estos productos para obtener una mayor productividad y comodidad, lo cual lleva al uso indebido de plaguicidas en términos de concentración y frecuencia de aplicación (Jiménez-Quintero, Pantoja-Estrada, y Ferney Leonel, 2016; Rahman et al., 2018). La principal preocupación es cómo los altos niveles de residuos de plaguicidas en los cultivos tienden a tener efectos adversos sobre la salud humana. Los hallazgos de este estudio permitirán estimar la presencia y cantidad de residuos de plaguicidas en ajíes comercializados en las zonas de Santo Domingo y San José de Ocoa, con la finalidad de impactar las políticas públicas en materia de seguridad alimentaria.
Materiales y Métodos
Reactivos y Equipos
Los reactivos utilizados en este experimento fueron aquellos integrados en los kits de QuEChERS de extracción, que contienen: sulfato de magnesio anhídrido (MgSO4) y acetato de sodio anhidro (C2H3CO2Na). El kit de dispersión de QuEChERS contiene: sulfato de magnesio anhídrido (MgSO4), amina primaria y secundaria (PSA) y carbón activado grafitado (GCB). Para la extracción de los analitos se utilizaron como reactivos: acetonitrilo (CH3CN) con 1 % (v/v) de ácido acético (CH3COOH) y para la reconstitución del extracto se utilizó una solución de acetona (C3H6O) y hexano (C6H14) (1:1) de grado óptima. Para el análisis del extracto se utilizaron los equipos de cromatografía de gases, modelo Clarus 680, acoplado a un espectrómetro de masa, modelo SQ 8C, ambos de la marca Perkin Elmer.
Recolección de la muestra
Se realizaron diversos muestreos de ajíes Morrón y Cubanela en mercados de la provincia de San José de Ocoa y del Gran Santo Domingo durante los meses de enero del año 2018 hasta junio del año 2019, de conformidad con la Directiva No.2002/63/CE de la Comisión Europea. Tomando en consideración la densidad poblacional de ambas zonas e implicando un consumo mayor según su densidad poblacional, se tomó una mayor cantidad de muestras en el Gran Santo Domingo, resultando en 63 y limitando a 54 las muestras tomadas de San José de Ocoa. En este estudio se consideró incluir a la provincia de San José de Ocoa debido a que allí se encuentra la mayor producción de ajíes dulces de la República Dominicana. Cada muestra representativa de ajíes era una combinación de 5 submuestras del mismo producto, recolectadas mediante un muestreo aleatorio. En cada mercado se colectaron 1 kg de muestra en bolsas plásticas estériles correctamente identificadas. Posteriormente, estas fueron colocadas en neveras portátiles con hielo y transportadas al laboratorio para su procesamiento. A su vez, estas fueron etiquetadas y transportadas al laboratorio, donde se refrigeraron a una temperatura de 4 °C hasta empezar a realizar la extracción.
Preparación de la muestra
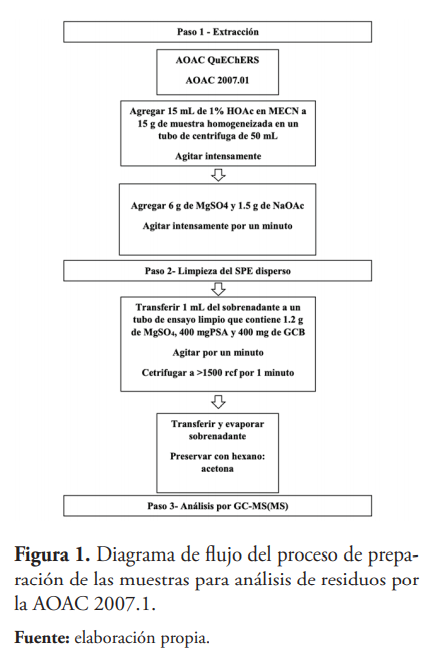
La muestra fue extraída y analizada siguiendo el método oficial de la Association of Official Agricultural Chemists (AOAC), tal como fue descrito por Anastassiades en el 2003 (Anastassiades et al., 2003), el cual consiste en la técnica de análisis de plaguicidas de residuos múltiples, basado en el método QuECHERS.
La preparación se inició homogeneizando 1 kg de cada muestra de ajíes completos en una licuadora eléctrica hasta formar una pasta espesa. Posteriormente, se tomó 15 g por cada muestra previamente homogeneizada en un mortero y se agregó a un tubo Falcon© de 50 ml junto con 15 ml de una solución de acetonitrilo y 1 % (v /v) de ácido acético. Esta mezcla se agitó vigorosamente durante un minuto y luego se transfirió a un tubo de extracción de 50 ml, que contenía 6.0 g de sulfato de magnesio anhidro (MgSO4) y 1.5 g de acetato de sodio anhidro (C2H3CO2Na), para el secado de la muestra y el taponamiento.
Después, el tubo de extracción se agitó vigorosamente por dos minutos asegurándose de que la sal no estuviese en el fondo del tubo. Inmediatamente se centrifugó durante cuatro minutos a 3,500 rpm para separar los materiales sólidos. El sobrenadante resultante del centrifugado de la etapa anterior de separación de fases se transfirió a un tubo Falcon© de 15 ml, que contiene 1,200 mg de MgSO4, 400 mg de material de intercambio de aminas primarias (PSA), y 400 mg de carbono de grafito (GCB), y se agitó usando un mezclador vortex durante un minuto. El extracto nuevamente se centrifugó durante cuatro minutos a 3,500 rpm.
Después de esta etapa de centrifugación, el sobrenadante se transfirió a un tubo estéril de 5 ml y se utilizó un evaporador de nitrógeno para secar la muestra. Seguidamente, se transfirió 1 ml del sobrenadante a un tubo de 5 ml y se utilizó el evaporador de nitrógeno para secar la muestra hasta aproximadamente 50 µl. Por último, se completó hasta 1 ml con el solvente Acetona: Hexano (1:1), utilizando una jeringa unida a un filtro de membrana de politetrafluoroetileno (PTFE) y se depositó en un vial de 1.5 ml para ser analizado en el GC/MS.
Soluciones y estándares
Se prepararon soluciones madre de mezclas de plaguicidas de estándares certificados a una concentración de 1000 ppm en el solvente Acetona: Hexano (1:1) para el análisis por GC-MS. A partir de estas, fueron preparadas soluciones de trabajo de residuos múltiples que contenían una concentración de 5 ppm por cada plaguicida. Además, se usó una solución de Trifenil Fosfato (TPP) al 2 % en el solvente acetonitrilo con 1 % (v/v) de ácido acético como estándar de control de calidad (QC). También, fue preparada una solución de 5 ppm de etoprofós en el solvente Acetona: Hexano (1:1) para que sirviera como estándar interno (IS) para la posterior determinación por GC/MS.
Análisis de la muestra
Luego del procedimiento descrito anteriormente, se procedió a analizar los compuestos químicos presentes en cada muestra. Todos los compuestos se determinaron con la ayuda de un GC/MS, un muestreador automático y un inyector de división. El capilar utilizado fue el DB-5MS UI de 30m x 0.25μm i.d. El espesor de la película de 0,25 μm se recubrió́ con fenildimetil polisiloxano reticulado al 5 %. El gas portador fue Helio (99.99 % de pureza) a un caudal de 1.0 ml/ min. La temperatura del horno se mantuvo inicialmente a 60 ºC durante 1 minuto, aumentó a 40 ºC/min hasta 170 ºC, luego a 10 ºC/min hasta 310 ºC. El volumen de inyección fue de 1.2 ml/min, inyectado en modo indivisible. El espectrómetro de masas funcionó en modo de ionización por impacto electrónico (EI), la temperatura de la fuente de iones fue de 300 ºC y la corriente de emisión fue de 70 eV. Luego, se compararon las interpretaciones de cromatogramas y espectros de masas de los plaguicidas identificados con la librería NIST MS Search del cromatógrafo.
Control de calidad
Las curvas de calibración de cada plaguicida de interés se realizaron de acuerdo con las directrices de la Comisión Europea. Los patrones de calibración se prepararon en extractos de acetonitrilo en blanco de ajíes utilizando las soluciones de trabajo multirresiduo para alcanzar una concentración de 0.01 a 10 ppm, y se añadió el IS (etoprofós en el solvente Acetona: Hexano (1:1)). El área bajo la curva frente a las concentraciones se ajustó mediante regresión lineal para obtener la ecuación para las curvas estándar por cada uno de los plaguicidas probados. Se logró una buena linealidad y reproducibilidad de las curvas de calibración (r2 > 0.94). El rendimiento del método QuEChERS fue evaluado mediante estudios de recuperación. La tasa de recuperación y la precisión del método se midieron mediante el análisis de muestras replicadas, que se fortificaron a una concentración de 0.05 ppm por cada plaguicida.
La tasa de recuperación y la precisión del método (expresada como desviación estándar relativa) se midieron analizando muestras repetidas libres de pesticidas de los dos tipos de ajíes, que fueron fortificadas a una concentración de 0.01 a 0.05 ppm para cada pesticida. La sensibilidad se evaluó determinando el límite de detección (LOD) y el límite de cuantificación (LOQ), utilizando la relación señal-ruido de 10:1 y 3:1, respectivamente.
Resultados
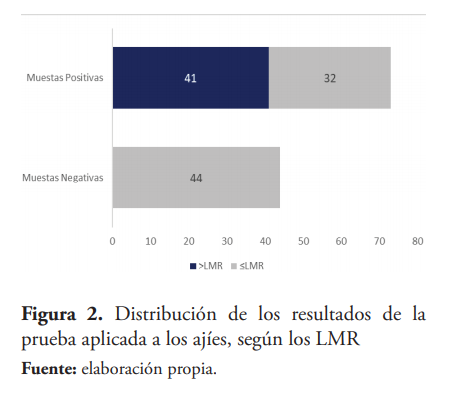
Fueron identificados 19 tipos de plaguicidas en las muestras de ajíes. Se determinó la concentración de residuos de plaguicidas en 117 muestras de ajíes, tanto Morron (65) como Cubanela (52). Se detectó un menor porcentaje de muestras con residuos de plaguicidas en los ajíes Cubanela (48 %), mientras que en los ajíes Morrón se detectó un mayor porcentaje de muestras con residuos de plaguicidas (73 %). En ambas zonas consideradas, hubo un total de 41 muestras (35 %) que contenían residuos de plaguicidas por encima de los LMR, mientras que 32 muestras (27 %) contenían residuos de plaguicidas en o por debajo de los LMR establecidos por el Codex y la Unión Europea. (Figura 2)
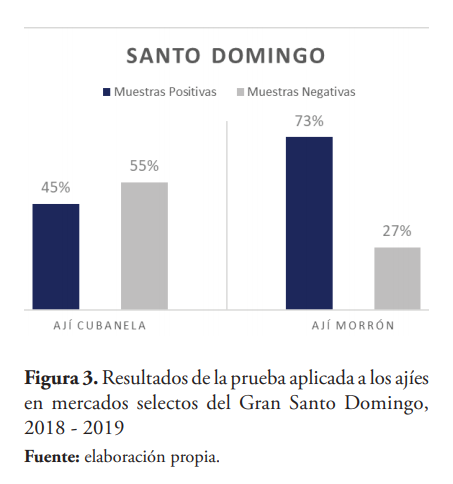
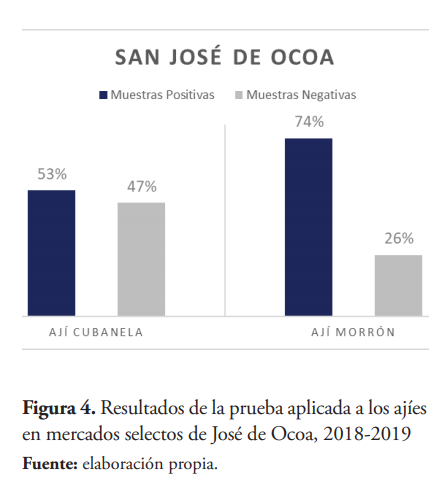
El porcentaje de muestras contaminadas fue alto para ambas zonas, Santo Domingo con 37 muestras (59 %) y San José de Ocoa con 36 muestras (64 %). Santo Domingo registró el mayor porcentaje de muestras que excedieron los LMR con 21 muestras (33 %). En cada zona, tanto las muestras positivas como las negativas se distribuyen entre los ajíes Morrón y Cubanela de la manera demostrada en las figuras 3 y 4.
Excedencias de LMR y frecuencias de detección de plaguicidas en muestras analizadas
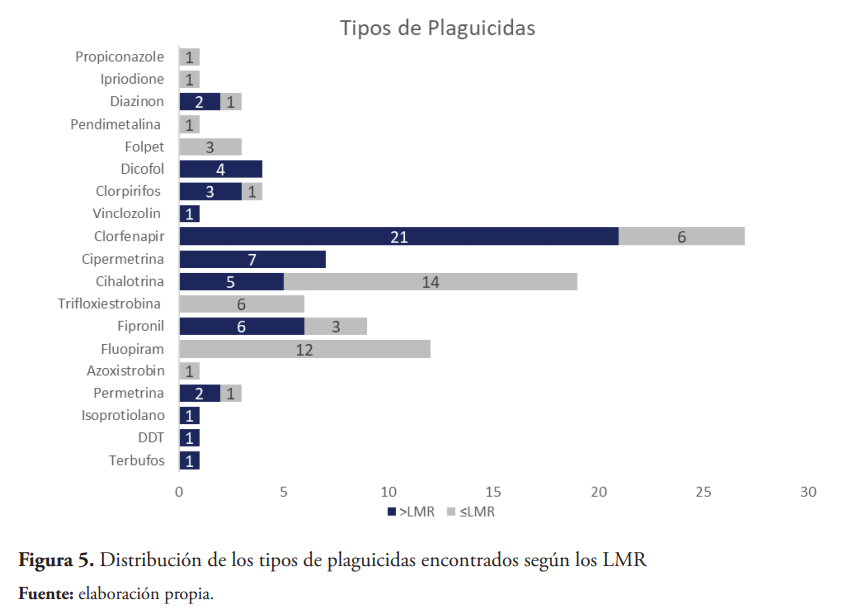
De los 70 plaguicidas estudiados se detectaron 19 tipos de plaguicidas en las muestras de ajíes. Los plaguicidas más comúnmente detectados fueron clorfenapir (27 muestras) y lambda-cihalotrina (19 muestras). Dentro de las muestras de ají Morrón hubo 13 casos donde los residuos de clorfenapir superaron los LMR, y en caso del ajíes Cubanela hubo 8 casos de excedencia. También, se detectó excedencias de LMR para terbufos, isoprotiolano, lambda-cihalotrina, 2- permetrina, cipermetrina y azoxistrobin y fipronil. De igual manera, se detectaron dicofol y DDT, en cinco muestras analizadas provenientes de ambas zonas, dos plaguicidas organoclorados de uso no permitido en ajíes en la República Dominicana. Los 19 tipos de plaguicidas pueden verse detallados en la figura 5.
Control de calidad
El rendimiento del método QuEChERS fue evaluado mediante estudios de recuperación y la precisión del método se midió mediante el análisis de muestras replicadas. Los valores de recuperación del método QuEChERS oscilaron entre 80 % y 120 % para la concentración 0.05 ppm. Las recuperaciones y la reproducibilidad se consideraron aceptables, lo que indica una precisión satisfactoria del método propuesto para la determinación de los plaguicidas en ajíes.
Además, para la curva de calibración, los valores de recuperación variaron entre 85 % y 106 % (rango de precisión, 1.34 % a 6.8 %) para la concentración de 0.01 ppm y 79 % a 100 % (rango de precesión, 2.04 % a 10.18 %) para 0.05 ppm. En adición, se determinó que el LOD para los plaguicidas osciló entre 0.0007 y 0.214 ppm y el LOQ osciló entre 0.0029 y 0.4521 ppm. Todos los valores LOD y LOQ de los plaguicidas fueron inferiores a los LMR establecidos por el Codex para las frutas y hortalizas muestreadas.
Discusión
Los hallazgos de este estudio evidencian la presencia de residuos de plaguicidas en ajíes Cubanela y Morrón en mercados selectos dentro de la zona de producción más grande de ajíes y la zona de mayor densidad poblacional del país. Mas del 35 % de las muestras analizadas contenían residuos de plaguicidas por encima del LMR.
El plaguicida más comúnmente detectado fue el clorfenapir, un insecticida no aprobado por la Unión Europea y en República Dominicana está prohibido su uso en ajíes desde el año 2011 (Resolución No. 61, 2011). Aunque el clorfenapir está clasificado como moderadamente peligroso según la Pesticide Properties DataBase (PPDB), este pesticida se ha asociado con la neurotoxicidad humana (Baek et al., 2016). Según la PPDB, los plaguicidas clasificados como altamente peligrosos dicofol, DDT y diazinon también se detectaron en algunas de las muestras. Entre los plaguicidas organoclorados estudiados, se detectó dicofol en tres muestras de ajíes Morrón y en una muestra de ajíes Cubanela. Debido a sus efectos nocivos en la salud humana y su persistencia de largo plazo en el medio ambiente, los plaguicidas organoclorados están prohibidos o restringidos en la mayoría de los países. Sin embargo, estos plaguicidas todavía están siendo utilizados de forma clandestina en algunos países en vías de desarrollo (Jayaraj, Megha, y Sreedev, 2016). Se ha demostrado que el consumo continuo de productos alimenticios, incluso con una contaminación moderada por plaguicidas organoclorados, puede tener consecuencias graves para la salud humana a largo plazo, ya que tienden a acumularse en los tejidos al no ser fácilmente solubles (Adeleye, Sosan, y Oyekunle, 2019).
A partir de estos hallazgos, podemos afirmar que los agricultores no siguen las precauciones adecuadas con respecto al uso de plaguicidas permitidos, dosis apropiadas y los intervalos estándares de pre-cosecha. En consecuencia, una gran cantidad de los ajíes analizados fueron contaminadas con plaguicidas. Los altos niveles de plaguicidas en algunas de las muestras sugieren que estos plaguicidas se han utilizado de manera indiscriminada, lo que podría ocasionar problemas de salud, no solo para los agricultores, sino también para los consumidores. Lo que indica que probablemente exista un desconocimiento por parte de los productores sobre el uso racional de plaguicidas para el control de plagas.
Conclusiones
Los resultados mostraron una contaminación con residuos de plaguicidas para más de la mitad de las muestras de ajíes. Asimismo, muchas de estas presentaron concentraciones por encima de los LMR. Se detectó la presencia de 19 plaguicidas distintos y los resultados revelaron un porcentaje preocupante de muestras con presencia de plaguicidas organoclorados ilegales. Desde una perspectiva de salud pública, los niveles observados de residuos de plaguicidas representan un riesgo alarmante para la salud de los consumidores. Además, este estudio proporciona información nueva e importante sobre los residuos de plaguicidas en ajíes dulces comercializados en los principales mercados de San José de Ocoa y el Gran Santo Domingo.
Recomendaciones
Con el propósito de reducir el riesgo contra la salud que implican los altos niveles de residuos de plaguicidas observados se recomienda la sensibilización de los agricultores a mejores prácticas agrícolas. Igualmente es recomendable continuar con monitoreos de residuos de plaguicidas constantes, donde los informes anuales sobre los programas de control de plaguicidas ayuden en primera instancia a revisar el registro y el uso de los plaguicidas. Por otra parte, desde una perspectiva económica de comercio internacional, llevar a cabo un control constante de los residuos de plaguicidas garantizaría el cumplimiento de regulaciones de inocuidad alimentaria para la exportación.
Referencias
Adeleye, A. O., Sosan, M. B., & Oyekunle, J. (2019). Dietary exposure assessment of organochlorine pesticides in two commonly grown leafy vegetables in South-western Nigeria. Heliyon, 5(6), e01895. Doi: https://doi.org/10.1016/j.heliyon.2019.e01895
Adou, K., Bontoyan, W. R., & Sweeney, P. J. (2001). Multiresidue method for the analysis of pesticide residues in fruits and vegetables by accelerated solvent extraction and capillary gas chromatography. Journal of Agricultural and Food Chemistry, 49, 4153– 4160
Allsopp, M., & Erry, B. (2000). POPs IN LATIN AMERICA A review of persistent organic pollutant levels in Latin America. Recuperado de https://www.researchgate.net/profile/Michelle_Allsopp/publication/252353401_POPs_IN_LATIN_AMERICA/links/53f3425f0cf256ab87b084a5/POPs-IN-LATIN-AMERICA.pdf
Anastassiades, M., Mack, D., Sigalova, I., Tasdelen, B., Oliva, J., & Barba, A. (2007). Analysis of pesticide residues using the quick easy cheap effective rugged and Safe (QuEChERS) pesticide multiresidue method in combination with gas and liquid chromatography and tandem mass spectrometric detection. Analytical and Bioanalytical Chemistry, 389: 1697–1714. Doi: https://doi.org/10.1007/s00216-007-1610-7
Anastassiades, M., Lehotay, S. J., Štajnbaher, D., & Schenck, F.J. (2003). Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solidphase extraction” for the determination of pesticide residues in produce. Journal of AOAC international 86(2), 412-431.
Baek, B. H., Kim, S. K., Yoon, W., Heo, T. W., Lee, Y. Y., & Kang, H. K. (2016). Chlorfenapyr-Induced Toxic Leukoencephalopathy with Radiologic Reversibility: A Case Report and Literature Review. Korean journal of radiology, 17(2), 277–280. Doi: https://doi.org/10.3348/kjr.2016.17.2.277
Barriada-Pereira, M., González-Castro, M. J., Muniategui-Lorenzo, S., López-Mahia, P., Prada-Rodríguez, D., & Fernández-Fernández, E. (2005). Determination of organochlorine pesticides in horticultural samples by microwave assisted extraction followed by GC-ECD. International Journal of Environmental Analytical Chemistry, 85, 325–333.
Byerlee, D., De Janvry, A., Sadoulet, E., Townsend, R., & Klytchnikova, I. (2008). World development report 2008: agriculture for development (English). World Development Report; no. 30 Washington, D.C.: World Bank Group. Recuperado de http://documents.worldbank.org/curated/en/587251468175472382/World-development-report-2008-agriculture-for-development
Codex Alimentarius FAO/WHO. (2020). Maximum Residue Limit (MRL). Recuperado de http://www.fao.org/fao-who-codexalimentarius/codex-texts/dbs/pestres/glossary/en/ [Consultado el 16 de abril, 2019].
Codex Committee on Pesticide Residues (CCPR). (2017). Guidelines on Performance Criteria for Methods of Analysis for the Determination of Pesticide Residues in Food and Feed CXG 90-2017. Recuperado de http://www.fao.org/fao-who-codexalimentarius/shproxy/en/?lnk=1&url=https%253A%252F%252Fworkspace.fao.org%252Fsites%252Fcodex%252FStandards%252FCXG%2B90-2017%252FCXG_090s.pdf
Concha-Meyer, A., Grandon, S., Sepúlveda, G., Díaz, R., Yuri, J. A., & Torres, C. (2019). Pesticide residues quantification in frozen fruit and vegetables in Chilean domestic market using QuEChERS extraction with ultra-high-performance liquid chromatography electrospray ionization Orbitrap mass spectrometry. Food Chemistry, 295, 64–71. Doi: https://doi.org/10.1016/J.FOODCHEM.2019.05.046
Costa Morais, E. H., Collins, C. H., & Jardim, I. C. S. F. (2018). Pesticide determination in sweet peppers using QuEChERS and LC–MS/MS. Food Chemistry, 249, 77–83. Doi: https://doi.org/10.1016/J.FOODCHEM.2017.12.092
Dagnac, T., Garcia-Chao, M., Pulleiro, P., Garcia-Jares, C., & Llompart, M. (2009). Dispersive solid-phase extraction followed by liquid chromatography–tandem mass spectrometry for the multi-residue analysis of pesticides in raw bovine milk. Journal of Chromatography A, 1216(18), 3702–3709. Doi: https://doi.org/10.1016/J.CHROMA.2009.02.048
Duca, R. C., Salquebre, G., Hardy, E., & Appenzeller, B. M. (2014). Comparison of solid phase- and liquid/liquid-extraction for the purification of hair extract prior to multi-class pesticides analysis. Journal of chromatography. B, Analytical technologies in the biomedical and life sciences, 955-956, 98–107. Doi: https://doi.org/10.1016/j.jchromb.2014.02.035
European Comission. (2017). Commission Regulation (EU) 2017/644 of 5 April 2017 laying down methods of sampling and analysis for the control of levels of dioxins, dioxin-like PCBs and non-dioxin-like PCBs in certain foodstuffs and repealing Regulation (EU) No 589/2014. Recuperado de https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32017R0644&from=GA
European Commission. Health and Food Safety, Regulation. Recuperado de http://ec.europa.eu/food/plant/pesticides/max_residue_levels/eu_rules/index_en.htm [Consultado el 10 de mayo 2020].
Jayaraj, R., Megha, P., & Sreedev, P. (2016). Organochlorine pesticides, their toxic effects on living organisms and their fate in the environment. Interdisciplinary toxicology, 9(3-4), 90–100. Doi: https://doi.org/10.1515/intox-2016-0012
Jiménez-Quintero, C. A, Pantoja-Estrada, A., & Ferney Leonel, H. (2016). Health risks of farmers for using and handling pesticides in the watershed “La Pila.” Rev Univ. Salud, 18(3), 417–431. Doi: https://doi.org/10.22267/rus.161803.48
Lehotay, S. J., Maštovská, K., & Lightfield, A. R. (2005). Use of buffering and other means to improve results of problematic pesticides in a fast and easy method for residue analysis of fruits and vegetables. Journal of AOAC International, 88, 615–629.
Leyva-Morales, J. B., Valdez-Torres, J. B., Bastidas-Bastidas, P. J., & Betancourt-Lozano, M. (2015). Validation and Application of a Multi-residue Method, Using Accelerated Solvent Extraction Followed by Gas Chromatography, for Pesticides Quantification in Soil. Journal of Chromatographic Science, 53(10), 1623–1630. Doi: https://doi.org/10.1093/chromsci/bmv063
Lipton, M. (2005). The family farm in a globalizing world: The role of crop science in alleviating poverty. 2020 Discussion Paper No. 40. Washington, D.C: International Food Policy Research Institute.
Lu, D., Qiu, X., Feng, C., Jin, Y., Lin, Y., Xiong, L., & Wang, G. (2012). Simultaneous determination of 45 pesticides in fruit and vegetable using an improved QuEChERS method and on-line gel permeation chromatography-gas chromatography/mass spectrometer. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 895–896, 17–24. Doi: https://doi.org/10.1016/j.jchromb.2012.03.006
Luke, M., Forberg, J. E., & Masumoto, H. T. (1975). Extraction and cleanup of organochlorine, organophosphate, organonitrogen, and hydrocarbon pesticides in produce for determination by gas–liquid- chromatography. Journal of the Association of Official Analytical Chemists, 58, 1020–1026.
Luzardo, O. P., Ruiz-Suárez, N., Almeida-González, M., Henríquez-Hernández, L. A., Zumbado, M., & Boada, L. D. (2013). Multi-residue method for the determination of 57 Persistent Organic Pollutants in human milk and colostrum using a QuEChERS-based extraction procedure. Analytical and Bioanalytical Chemistry, 405(29), 9523–9536. Doi: https://doi.org/10.1007/s00216-013-7377-0
McRitchie, T., Blais, D. R., Moulins, J. R., Blais, M., Snider, N., Tully, J. Montsion, K. (2018). Multiresidue Method of Analysis of Pesticides in Medical Cannabis. Journal of AOAC International, 101(6), 1948–1960. Doi: https://doi.org/10.5740/jaoacint.17-0495
Montiel-León, J. M., Duy, S. V., Munoz, G., Verner, M.-A., Hendawi, M. Y., Moya, H., Sauvé, S. (2019). Occurrence of pesticides in fruits and vegetables from organic and conventional agriculture by QuEChERS extraction liquid chromatography tandem mass spectrometry. Food Control, 104, 74–82. Doi: https://doi.org/10.1016/J.FOODCONT.2019.04.027
Rahaman, M. M., Islam, K. S., & Jahan, M. (2018). Rice Farmers’ Knowledge of the Risks of Pesticide Use in Bangladesh. Journal of health & pollution, 8(20), 181203. Doi: https://doi.org/10.5696/2156-9614-8.20.181203
Rahman, M. M., Lee, H. S., Abd El-Aty, A. M., Kabir, M. H., Chung, H. S., Park, J.-H., … Shim, J.-H. (2018). Determination of endrin and δ-keto endrin in five food products of animal origin using GC-μECD: A modified QuEChERS approach to traditional detection. Food Chemistry, 263, 59–66. Doi: https://doi.org/10.1016/J.FOODCHEM.2018.04.099
Resolución No. 61-2011. Ley No. 311, que regula la fabricación, elaboración, envases almacenamiento, importación, expendio y comercio en cualquier forma de insecticidas, zoocidas, fitocidas, pesticidas, herbicidas y productos similares. Ministerio de Agricultura, Ciudad de Santo Domingo de Guzmán, Distrito Nacional, Capital de la República Dominicana, a los ocho (8) días del mes de diciembre del año dos mil once (2011).
Rotich, H. K., Zhang, Z. Y., & Li, J. C. (2003). Optimization of high- performance liquid chromatography and solid-phase extraction for determination of organophosphorus pesticide residues in environmental samples. International Journal of Environmental Analytical Chemistry, 83.
Satpathy, G., Tyagi, Y. K., & Gupta, R. K. (2011). A novel optimized and validated method for analysis of multi-residues of pesticides in fruits and vegetables by microwave-assisted extraction (MAE)-dispersive solid-phase extraction (d-SPE)-retention time locked (RTL)-gas chromatography-mass spectrometry with Deconvolution reporting software (DRS). Food Chemistry, 127(3), 1300–1308. Doi: https://doi.org/10.1016/j.foodchem.2011.01.087
Schreiber, A. & Pace, N. (2010) Intelligent use of retention time during multiple reaction monitoring for faster and extended compound screening with higher sensitivity and better reproducibility. Application Note AB SCIEX:1282310-01. Recuperado de http://63www.absciex-korea.com/Documents/Downloads/Literature/mass-spectrometryMultipleReaction-1282310.pdf
United States Department of Agriculture. Foreign Agricultural Service. (2020). Maximum Residue Limits (MRL) Database. Recuperado de https://www.fas.usda.gov/maximum-residue-limits-mrl-database [Consultado 31 de agosto, 2020].
Valverde García, A., Fernández Alba, A. R., Contreras, M., & Aguera, A. (1996). Supercritical fluid extraction of pesticides from vegetables using anhydrous magnesium sulfate for sample preparation. Journal of Agricultural and Food Chemistry, 44, 1780– 1784.
Wang, J., Duan, H.-L., Ma, S.-Y., Zhang, J., & Zhang, Z.-Q. (2019). Solidification of a Switchable Solvent-Based QuEChERS Method for Detection of 16 Pesticides in Some Fruits and Vegetables. Journal of Agricultural and Food Chemistry, 67(28), 8045–8052. Doi: https://doi.org/10.1021/acs.jafc.9b00686
Weber, R. (2017). Draft guidance on sampling, screening and analysis of persistent organic pollutants in products and articles. Recuperado de http://chm.pops.int/Implementation/NIPs/Guidance/guidanceonsampling,screeningetcofPOPs/tabid/5333/Default.aspx
Wesseling, C., Aragón, A., Castillo, L., Corriols, M., Chaverri, F., De La Cruz, E., & Van Wendel De Joode, B. (2001). Hazardous pesticides in Central America. International Journal of Occupational and Environmental Health, 7(4), 287–294. Doi: https://doi.org/10.1179/oeh.2001.7.4.287
Wilkowska, A. & Biziuk, M., (2011). Determination of pesticide residues in food matrices using the QuEChERS methodology. Food Chemistry, 125(3), 803-812. Doi: https://doi.org/10.1016/j.foodchem.09.094 (2010).

