Ciencia, Ambiente y Clima, Vol. 3, No. 1, enero-junio, 2020 • ISSN (impreso): 2636-2317 • ISSN (en línea): 2636-2333 • Sitio web: https://revistas.intec.edu.do/
OCURRENCIA DE FLORACIONES NOCIVAS DE MICROALGAS EN LAS COSTAS DEL ESTADO MIRANDA, VENEZUELA
Occurrence of harmful microalgae blooms in Miranda state coast, Venezuela
Cómo citar: Pereira, C. J. (2020). Ocurrencia de floraciones nocivas de microalgas en las costas del estado Miranda, Venezuela. Ciencia, Ambiente y Clima, 3(1), 55-71. Doi: https://doi.org/10.22206/cac.2020.v3i1.pp55-71
1. Introducción
En Chirimena y otras comunidades costeras de la zona continental central de Venezuela, han ocurrido intoxicaciones que incluyen mortandad masiva de peces y otros organismos, con incidencia sobre la salud de las personas. Este tipo de eventos ha sido reportado en varias oportunidades entre los meses de agosto y octubre, pero con diferentes niveles de afectación (Ministerio del Ambiente y de los Recursos Naturales, 2004, p. 6). Como factores que influyen en la ocurrencia de esta mortandad de peces, se han propuesto algunas causas: el descenso de los niveles de oxígeno en el agua, cambios bruscos de temperatura o salinidad y la presencia de agentes tóxicos de origen químico o biológico (Gómez, 2014, p. 96; Rogers-Bennett, Kashiwada, Taniguchi, Kawana & Catton, 2019, p. 485).
En las intoxicaciones masivas de origen biológico, los organismos más representativos son las microalgas, las cuales pueden obtener a partir de una célula entre 6000 y 8000 células en una semana y generar efectos nocivos sobre la salud humana, pérdida de recursos marinos y afectación de actividades turísticas y recreacionales (Daranas, Norte & Fernández, 2001, p. 1101; Spatharis, Dolapsakis, Economou-Amilli, Tsirtsis & Danielidis, 2009, p. 737). Por ello, la Comisión Oceanográfica Intergubernamental de la UNESCO acuñó el término “floraciones algales nocivas” a este fenómeno y aunque se considera un proceso natural que ocurre en muchas aguas costeras de diferentes partes del mundo, se ha observado un incremento en frecuencia, intensidad y distribución geográfica en las dos últimas décadas, por lo que la comunidad científica se ha interesado de manera especial en su estudio (Reguera, 2002, p. 21).
Para que el fenómeno ocurra es necesaria una combinación especial de factores biológicos y fisicoquímicos, que incluyen: luz, temperatura, nutrientes y estabilidad horizontal y vertical en la columna de agua (Horner, Garrison & Plumley, 1997, p. 1078; Zingone & Wyatt, 2004, p. 874). Como consecuencia, ocurre la floración de microalgas y el agua se tiñe de color, dependiendo de los pigmentos dominantes de la especie en florecimiento y de su densidad (Prakash, 1967, p. 1590). Sin embargo, algunas microalgas no producen coloración del agua, pero sí llegan a producir la toxina y sus efectos sobre la biota y las personas, por lo que se requiere estudiar a tiempo la composición y abundancia del fitoplancton y tomar medidas adecuadas para evitar daños mayores (Organización de las Naciones Unidas para la Alimentación y la Agricultura, 2005, p. 1).
Este fenómeno ha sido reportado en las costas del oriente venezolano, incluyendo la isla de Margarita (Reyes-Vásquez, Ferraz-Reyes & Vásquez, 1979, p. 191; La Barbera Sánchez, Soler, Rojas & Chang-Yen, 2004, p. 1). Sin embargo, no había sido confirmado en la región central del país, por lo que en este trabajo se analiza la estructura comunitaria del fitoplancton durante tres eventos de intoxicación, que fueron reseñados en la prensa local y requirieron la aplicación de medidas de desalojo de las playas debido a que pobladores y turistas presentaron síntomas de intoxicación con afectación de las vías respiratorias, náuseas, vómito e irritación de la piel y las mucosas. Para ello, se analizaron muestras de agua tomadas por pobladores de las comunidades de Chirimena y Puerto Francés el 29 de agosto de 2010 y el 7 de octubre de 2014 y por trabajadores de la Planta de Distribución de Combustibles de Petróleos de Venezuela, S.A., el 31 de octubre de 2015.
2. Materiales y métodos
2.1 Área de estudio
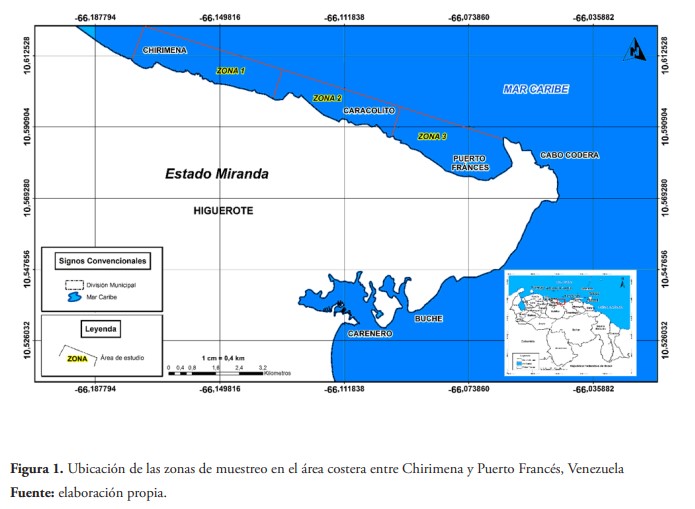
La zona marina y costera donde se han reportado los eventos, se encuentra en la región continental centro-norte de Venezuela y pertenece al municipio Brión del estado Miranda, localizada al oeste del Cabo Codera, un accidente topográfico en las estribaciones finales de la cordillera de la Costa (figura 1). Posee una franja costera de más de 12 km e incluye un conjunto de playas turísticas (Chirimena, Majagua, Caracolito y Puerto Francés). Se considera un área heterogénea con costas profundas y someras con la influencia de quebradas y ríos, tales como el Tuy y la laguna costera de Tacarigua. Presenta una diversidad de formaciones vegetales, que incluye: bosques tropicales siempre verdes, matorrales, espinares, herbazales, palmares y manglares con vientos predominantes en dirección NE-SO y una temperatura media del agua de 26 °C (Solé & Vera, 1997, p. 181).
2.2 Captación y análisis de muestras
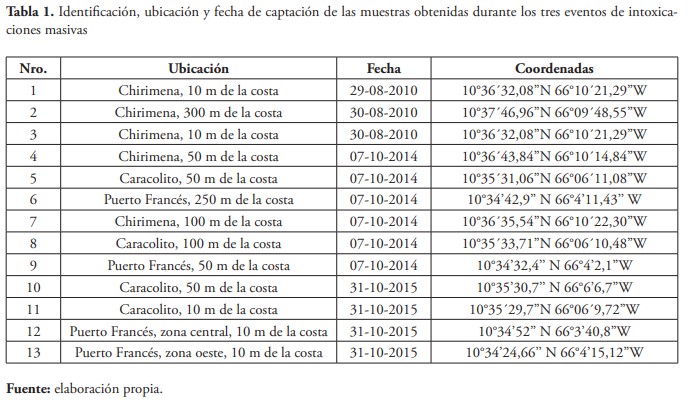
Las muestras de microfitoplancton fueron tomadas en el estrato superficial de la columna de agua, usando botellas de plástico de 1 litro y fueron fijadas con lugol y formalina neutralizada al 5 % v/v. Mientras que, para los nutrientes, se tomaron muestras de agua y se refrigeraron hasta su posterior análisis. En la tabla 1 se indican algunas especificaciones de las muestras.
Adicionalmente, se estimó la densidad total del microfitoplancton, de los dinoflagelados y del género Ostreopsis a partir de 12 muestras tomadas aleatoriamente por mes, entre junio de 2014 y marzo de 2015 en la zona costera entre Chirimena y Puerto Francés. Las muestras se obtuvieron con arrastres horizontales de 10 minutos en el estrato superficial de la columna de agua usando una red de fitoplancton con 60 µm de apertura de malla. Las muestras fueron fijadas con lugol y formalina neutralizada al 5 % v/v. Para la aleatorización de las estaciones de muestreo se establecieron dos criterios, el primero fue la elaboración de una rejilla con 5 filas y 5 columnas en cada zona; cada celda contó con una dimensión de 50 m de largo en dirección hacia el mar y 870 m a lo largo de la costa. El segundo criterio fue el establecimiento de tres bloques horarios (mañana: 8:00-11:00, mediodía: 11:00-14:00 y tarde: 14:00-18:00). Usando estos criterios, se seleccionaron al azar cuatro muestras en cada zona de muestreo y se incluyeron cuatro muestras en cada bloque horario para toda el área de estudio.
Durante los muestreos en 2010 y 2014, se estimaron las variables fisicoquímicas en el agua de mar: temperatura, salinidad, oxígeno disuelto, pH y nutrientes (amonio, nitritos, nitratos y fosfatos) usando sondas multiparamétricas y espectrofotómetro UV-visible (Strickland y Parsons 1972, p. 11; APHA, AWWA, WEF, 1998). En el laboratorio, se estimó la abundancia microalgal por el método de sedimentación de Utermölh. La identificación de las especies se realizó utilizando trabajos especializados.
2.3 Análisis de datos
Se presentan los datos de riqueza y densidad por grupos taxonómicos de la comunidad microfitoplanctónica en cada muestreo, mediante el uso de técnicas de estadística descriptiva, haciendo énfasis en aquellas especies que generan floraciones algales nocivas. Se estimó la proporción de estas microalgas con respecto a la densidad de dinoflagelados y se realizaron pruebas de hipótesis a partir de un modelo bifactorial (evento y zona) sin interacciones, usando los datos de densidad de especie con una transformación logarítmica, mediante un análisis PERMANOVA con un nivel de significancia de 0,05. Adicionalmente, se aplicó la prueba SIMPER para conocer el porcentaje de similitud entre grupos de muestras de acuerdo a los dos factores mencionados con anterioridad y se aplicaron análisis de ordenación de escalamiento multidimensional no paramétricos (NMDS) para conocer la distribución de las muestras (Clarke, Gorley, Somerfield & Warwick, 2014, pp. 5-13).
Con la densidad del género Ostreopsis estimada a partir de las muestras obtenidas entre junio 2014 y marzo 2015, y la relación de este género con la densidad de dinoflagelados, se realizaron pruebas de hipótesis a partir de un modelo bifactorial (mes y zona) sin interacciones, mediante un análisis de similitud (ANOSIM). En los casos donde se hallaron diferencias significativas con un error de tipo I (α) = 0,05, se aplicaron las pruebas a posteriori de diferencias menos significativas (DMS). Igualmente, se aplicó la prueba SIMPER y se hicieron gráficas de caja y bigote. Los análisis estadísticos se realizaron en el programa PAST versión 4.01 (Hammer, Harper & Ryan, 2001, p. 1).
3. Resultados
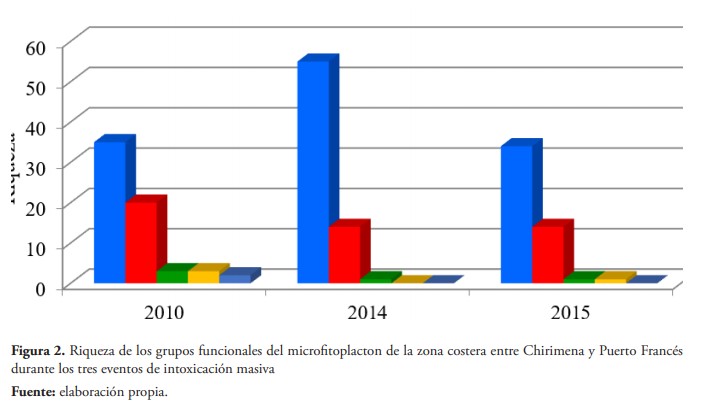
En las muestras obtenidas, durante los tres eventos, se identificaron 138 especies, distribuidas en 87 diatomeas (63 %), 43 dinoflagelados (31,2 %), 3 cianobacterias (2,2 %), 3 euglenofitas (2,2 %) y 2 flagelados (1,4 %), de las cuales coincidieron las diatomeas: Bellerochea malleus, Diploneis sp., Lauderia annulata, Navicula sp., Nitzschia acicularis, N. longissima, N. sigma, Thalassiosira eccentrica y Trieres mobiliensis, los dinoflagelados: Ostreopsis siamensis y Tripos furca y la cianobacteria Trichodesmium thiebautii. Sin embargo, además de las anteriores, coinciden las especies: Chaetoceros affinis, C. gracilis, Licmophora abbreviata, Neocalyptrella robusta, Nitzschia angularis, N. reversa, N. rostrata, Pleurosigma formosum y Thalassionema nitzschioides en las intoxicaciones ocurridas en los años 2010 y 2014, mientras que los eventos de 2010 y 2015, coinciden las diatomeas: Amphora sp., Asterionellopsis glacialis, Coscinodiscus perforatus, C. wailesii y Cylindrotheca closterium y los dinoflagelados: Dynophysis caudata, Gymnodinium sp., y Scrippsiella acuminata. Finalmente, en los de 2014 y 2015, se observaron las diatomeas: Dactyliosolen fragilissima, Guinardia striata, Isthmia enervis, Leptocylindrus danicus, Licmophora hialina, Paralia sulcata y el dinoflagelado: Ostreopsis ovata.
En cuanto a la riqueza de las muestras obtenidas en cada uno de los eventos, se observa una estructura similar con relación a los grupos funcionales (figura 2). No obstante, en 2014 se identificó mayor número de especies, específicamente del grupo de las diatomeas. Al comparar las muestras de cada evento, en 2010 se obtuvo una riqueza de 46 especies en la estación más cercana a la costa, con una distribución mayoritaria de diatomeas y dinoflagelados. Para el día 30, se observó una riqueza similar en esta estación, pero con una densidad menor. Sin embargo, en la estación más alejada de la costa, se observó una riqueza de 18 especies, con una contribución equivalente entre diatomeas y dinoflagelados. En 2014 se obtuvo una riqueza de 70 especies con una media de 23 ± 6 diatomeas y 7 ± 3 dinoflagelados, mientras que en 2015 la riqueza fue de 50 especies con 18 ± 2 diatomeas y 9 ± 2 dinoflagelados, obteniéndose mayor similitud en la composición de estas muestras.
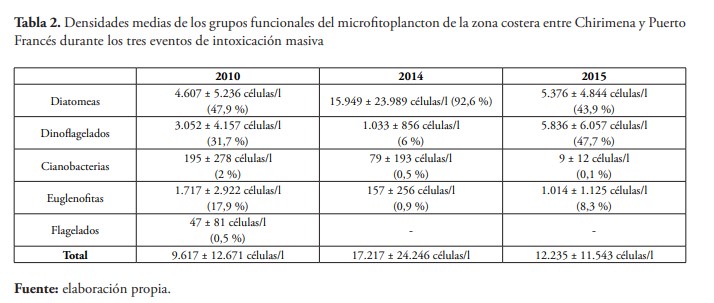
En cuanto a la abundancia, se obtiene mayor similitud entre las densidades obtenidas en 2010 y 2015, pero con mayor proporción de dinoflagelados en el último evento; mientras que en 2014 la densidad total fue mayor que en los demás eventos, con una proporción superior de diatomeas, lo cual, en este caso, se debe al sobrecrecimiento de las especies Rhizosolenia imbricata, que presenta densidades de 26.439 células/l y 54.482 células/l en dos de las muestras y Pleurosigma angulatum con densidad de 4.839 células/l en una de las muestras (tabla 2). En 2010 se observa una variación importante en la densidad celular de microalgas desde el día que se evidenció la intoxicación hasta el día siguiente, que fluctúa desde 24.239 células/l a 2.762 células/l en la estación más cercana a la costa (figura 3).
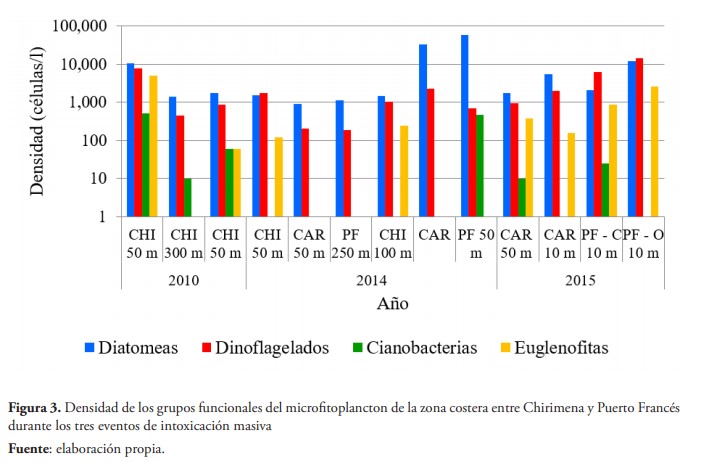
En cuanto a la contribución de las especies durante el primer evento, el día 29 de agosto se reporta una mayor densidad de las especies: Eutreptiella gymnastica con 4.670 células/l, seguida por dinoflagelados de la especie Ostreopsis cf. siamensis con 3.596 células/l, Scrippsiella trochoidea con 1.588 células/l, dos especies del género Navicula con 1.494 y 1.168 células/l y Diploneis con 1.168 células/l. Al día siguiente, estas mismas especies presentaron densidades inferiores. Por ejemplo, O. cf. siamensis presentó 350 células/l mientras que E. gymnastica no se visualizó.
En 2014, además de las especies mencionadas anteriormente, O. cf. siamensis alcanzó densidades de 1.003 y 1.759 células/l en la localidad de Chirimena y valores inferiores en las otras localidades. También se obtuvo una densidad de 1.015 células/l del dinoflagelado Tripos lineatus en la estación más alejada de la costa en playa Caracolito. En 2015, se obtuvo una abundancia total media de 19.115 ± 14.149 células/l en Puerto Francés, con mayor representación de dinoflagelados (10.203 ± 5.766 células/l), seguido por diatomeas (7.143 ± 7.152 células/l) y menor proporción de flagelados y cianobacterias. En cambio, Caracolito presentó una densidad cuatro veces inferior (5.355 ± 3.189 células/l) con mayor proporción de diatomeas (3.610 ± 2.602 células/l) con respecto a los dinoflagelados (1.470 ± 749 células/l). Sin embargo, en ambas playas, O. cf. siamensis fue la especie más representativa de los dinoflagelados, representando cerca del 53 % de la abundancia de dinoflagelados con una densidad media de 760 ± 311 células/l en Caracolito y 81 % en Puerto Francés con 8.353 ± 4.989 células/litro. Otras especies con densidades superiores a los 1.000 célula/l fueron las diatomeas: Navicula sp., Nitzschia acicularis, Tabularia fasciculata y la euglenofita E. gymnastica.
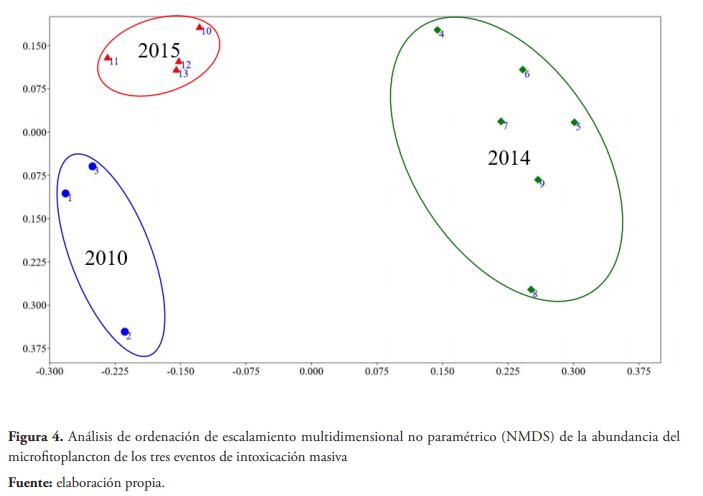
Al comparar las estructuras comunitarias a nivel de especies en cada una de las muestras obtenidas, durante los tres eventos, a partir del Permanova, usando una distancia Bray Curtis y 99.999 permutaciones, se obtuvo diferencias significativas entre los tres eventos (F = 12,78; p < 0,05), pero no entre las zonas (F=0,375; p> 0,05). Estos resultados se pueden visualizar gráficamente en el NMDS (figura 4). Al aplicar la misma prueba, empleando la composición y densidad de los grupos funcionales, desaparecen estas diferencias entre los tres eventos (F = 0,46; p > 0,05). La prueba SIMPER indica que las especies: Eutreptiella gymnastica, Nitzschia acicularis, Rhizosolenia setigera, Navicula sp., y Ostreopsis cf. siamensis, las cuales son las que presentan las densidades mayores, son las especies que contribuyen con más del 10 % de la disimilitud de las muestras evaluadas.
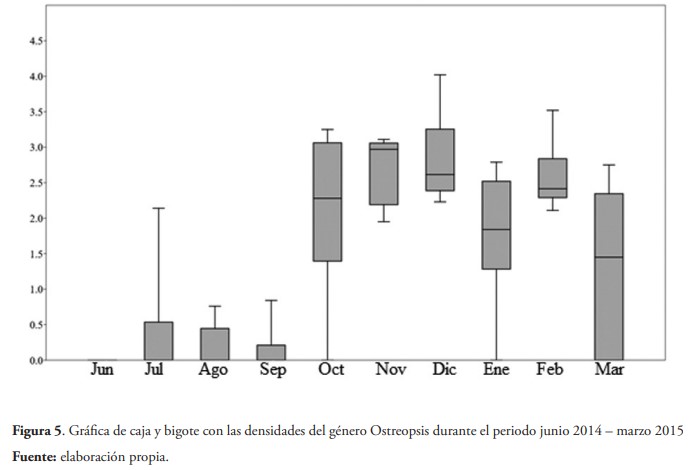
Por otra parte, al evaluar las densidades del género Ostreopsis en las muestras obtenidas durante el periodo junio 2014 y marzo 2015, se obtuvo a partir de la prueba Anosim dos vías, en el que las zonas están anidadas dentro de los meses que no hay diferencias significativas entre las zonas (R = -0,041; p = 70,17 %), pero sí entre los meses (R = 0,28; p = 0,34 %). La prueba a posteriori para comparar cada uno de los meses, indica similitud entre los del periodo julio–septiembre que se diferencia de un segundo bloque que presenta similitud y agrupa el periodo octubre–febrero, indicando que a partir del mes en el que ocurre la intoxicación masiva hay un cambio en la densidad de estos organismos (figura 5).
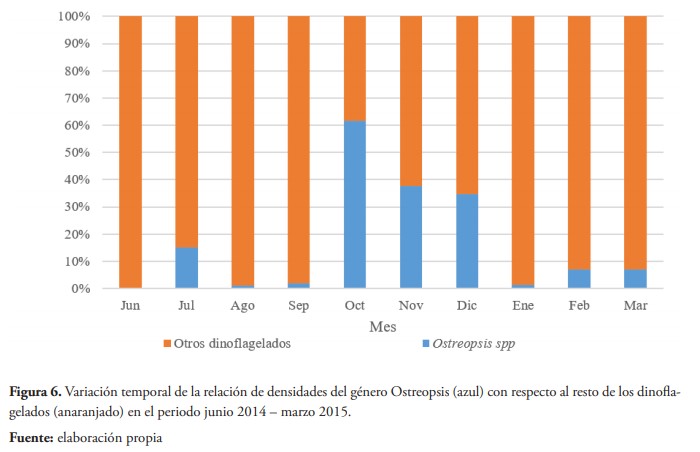
Al evaluar la relación entre la densidad de Ostreopsis con respecto a la de todos los dinoflagelados, la prueba Anosim dos vías mostró que no había diferencias significativas entre las zonas (R = 0,033; p = 67,97 %), pero sí entre los meses (R = 0,35; p = 0,043 %). La prueba a posteriori para comparar cada uno de los meses, indica un patrón similar al encontrado en la prueba con la densidad de Ostreopsis. Sin embargo, la proporción de este dinoflagelado sobre el resto, solo supera el 50 % durante el mes en el que ocurrió la intoxicación masiva (figura 6).
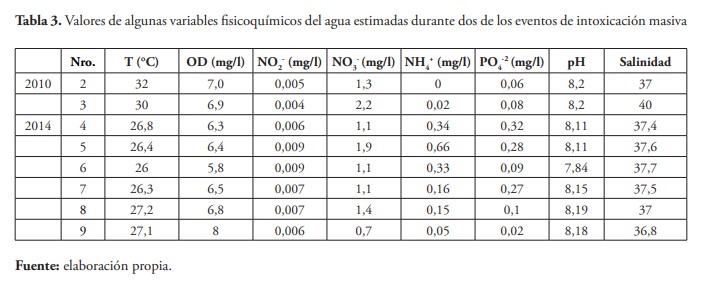
Finalmente, se presentan las condiciones ambientales durante los eventos de intoxicaciones masivas ocurridos en 2010 y 2014 (tabla 3), observándose temperaturas que fluctúan entre 26 y 32 °C, con concentraciones de oxígeno disuelto que demuestran condiciones de mezcla, salinidades entre 36,8 y 40 y concentraciones de nutrientes características de aguas mesotróficas (Wetzel, 2001, p. 241; Beiras, 2018, p. 34), aunque abundancias de microfitoplancton inferiores a 106 células/l, como las obtenidas en este estudio, son características de aguas oligotróficas (Ogawa & Ichimura, 1984, p. 175).
4. Discusión
Tanto las especies del género Eutreptiella como las de Ostrepsis son conocidas en el mundo por su capacidad de generar intoxicaciones masivas en las zonas costeras (Santos et al., 2019, p. 21). Eutreptiella gymnastica es una euglenofita marina fusiforme y ligeramente robusta con cloroplastos grandes y alargados distribuidos en toda la célula, que tienen como pigmentos mayoritarios la clorofila a, b, β-caroteno, diadinoxantina, zeaxantina, neoxantina y anteraxantina. Su tamaño oscila entre 15 y 30 µm de largo y presenta movimientos rápidos de contracción y distensión (Bravo-Sierra, 2004, p. 8).
Por lo general, se distribuyen en ambientes costeros y ha sido asociada a altas concentraciones de contaminantes de origen orgánico (Triemer & Zakrys, 2015, p. 472). Aún no se conoce la toxina que producen estas microalgas, pero sí sus efectos sobre los organismos marinos (Olli, Heiskanen & Seppala, 1996, p. 1588). Su presencia se ha reportado en diferentes partes del mundo, pero floraciones nocivas solo en las costas de Japón (Stonik, 2007, p. 85), en el golfo de Finlandia (Olli et al., 1996, p. 1587), Rusia y otros países asiáticos (Stonik, 2007, p. 81).
Esta especie se caracteriza por formar floraciones en conjunto con otras especies, incluyendo dinoflagelados tóxicos como Ostreopsis, tal como se observó en los tres eventos evaluados (Olli et al., 1996, p. 1588). La ecología y adaptaciones ambientales de las floraciones de euglenofitas en ambientes costeros son poco conocidas (Olli et al., 1996, p. 1588). Sin embargo, algunos investigadores han explicado que la ocurrencia de surgencia costera, seguida por una estratificación de la columna de agua produce un fenómeno de sucesión, en la que se forma una estructura comunitaria diferente a la original. Si las condiciones ambientales son apropiadas, estas especies con alto potencial de crecimiento se ven favorecidas y obtienen ventaja competitiva sobre el resto, produciendo floraciones (Anderson, 1994, p. 63). E. gymnastica posee muchas adaptaciones evolutivas características de las especies oportunistas que generan floraciones, las cuales le permiten dominar la comunidad fitoplanctónica en ciertas ocasiones, sobre todo bajo condiciones eutróficas (Olli et al., 1996, p. 1592).
Al respecto, a pesar que las concentraciones de nutrientes y materia orgánica pueden incrementarse en la zona central de Venezuela por influencia de los ríos Tuy, Capaya, la Laguna de Tacarigua y varias quebradas durante la época de precipitaciones máximas, así como por efecto de la surgencia costera, esta área no deja de considerarse oligotrófica a mesotrófica debido a una plataforma continental estrecha, y eso lo demuestran sus densidades de plancton (Herrera Febres & Andrés, 1980, p. 98; Ogawa & Ichimura, 1984, p. 175; Castellanos, Varela & Muller-Karger, 2002 p. 69; Pereira, 2019, p. 104).
En cuanto a Ostreopsis siamensis, es una microalga bentónica cosmopolita perteneciente al grupo de los dinoflagelados (Faust, Morton & Quod, 1996, p. 1053). Este género se caracteriza por tener células ovoides a oblongas con múltiples cloroplastos, un diámetro dorsoventral entre 45 y 65 µm, transversal entre 28 y 50 µm y anteroposterior entre 14 y 26 µm. Tienen placas de espesor y orientación variables y son comprimidas anterioposteriormente con forma de lágrima (Aligizaki & Nikolaidis, 2006, p. 719; Monti, Minocci, Beran & Ivesa, 2007, p. 599). Están asociadas a una variedad de sustratos, incluyendo macroalgas, invertebrados, rocas, conchas de moluscos y sedimentos blandos (Vila, Garcés & Masó, 2001, p. 51; Rossi et al., 2010, p. 1381). Pueden permanecer en el fondo durante muchos años en forma de quistes, pero cuando las condiciones ambientales son favorables, pueden pasar de la fase de latencia a formar células nadadoras que se reproducen rápidamente hasta alcanzar densidades superiores a las 1.000 células/l. De hecho, Gilabert et al., (2008, p. 57) consideran que densidades superiores a 1.200 células/l de un alga tóxica como Ostreopsis o Eutreptiella, pueden ser suficientes para generar daños a las personas, tal como se evidenció en estos tres eventos.
Ostreopsis libera una toxina, incluida en la familia de las palitoxinas que es transportada por el viento a las comunidades costeras (Vila et al., 2001, p. 53; Zingone & Wyatt, 2004, p. 879). Son compuestos estructuralmente complejos, solubles en agua, que ocasionan intoxicaciones con síntomas similares a los que produce la ciguatera, aunque con mayor gravedad y alto índice de mortalidad (Guerrini et al., 2010, p. 212). En los últimos años, se ha registrado un mayor número de intoxicaciones masivas en las zonas costeras de diferentes partes del mundo, producto del florecimiento de estas especies causando problemas de salud pública que incluyen la muerte de personas y animales (Ciminiello et al., 2014, p. 3532). No obstante, sus floraciones suelen ser estacionales y ocurren en muy pocos días, incluso horas (Pistocchi et al., 2011, p. 422), lo cual explica que su densidad haya disminuido considerablemente para el segundo día de muestreo en el caso del evento del año 2010 (figura 3).
La mayoría de las diatomeas identificadas y que presentan densidades altas, se han catalogado como especies iniciadoras de la sucesión ecológica en ambientes marinos y costeros, debido a su capacidad de multiplicarse rápidamente (Margalef, 1972, p. 259). Cabe destacar que, a pesar de las diferencias encontradas en las densidades durante los tres eventos, todas se mantienen en el mismo orden de magnitud. Adicionalmente, otros eventos de florecimientos algales nocivos del género Ostreopsis, indican la presencia de un consorcio de diatomeas pennadas y otros dinoflagelados con densidades variables, lo cual manifiesta, que a pesar que Ostreopsis aumenta sus densidades hasta alcanzar aquellas consideradas peligrosas, se puede observar una diversidad alta en la comunidad fitoplanctónica (Santos et al., 2019, p 24).
En cuanto a la diatomea R. setigera, la cual alcanzó densidades superiores a 40.000 células/l en el año 2014, no se había reportado eventos de mareas rojas en Venezuela por proliferaciones de esta diatomea. Sin embargo, especies pertenecientes a este género han sido reportadas como responsables de generar eventos nocivos no toxígenos, con mortalidad masiva de peces e invertebrados, por agotamiento de oxígeno, afectación de la migración de peces por producción de compuestos ricos en proteínas, daño mecánico en las branquias de peces y perjuicios a las actividades turísticas y recreativas en áreas costeras por formación de espumas, sustancias aceitosas, manchas u olores en la costa oeste de los Estados Unidos de Norteamérica (Horner et al., 1997, p. 1077), el Golfo San Matías en Argentina (Sunesen, Bárcena & Sar, 2009, p. 68), la estación fija en el seno Aysén en Chile (Cassis, Muñoz & Avaria, 2002, p. 62) y la costa de Campeche en México (Poot, 2016, p. 92).
Algunos factores que condicionan la ocurrencia e intensidad de las floraciones de dinoflagelados son las necesidades nutricionales específicas de cada especie, la temperatura del agua, radiación solar, fenómenos meteorológicos que conducen a los movimientos de masas de agua, mezcla por la acción de las corrientes ascendentes y desarrollo de termoclima (Prakash, 1967, p. 1859, Gilabert et al., 2008, p. 55; Pistocchi et al., 2011, p. 422). En el caso del evento reportado en 2010, se observaron valores similares de temperatura y oxígeno disuelto en la estación costera y más alejada de ella, con un gradiente de salinidad de la costa hacia el Norte, debido a la influencia de la descarga de agua dulce de la quebrada de Chirimena. Sin embargo, la carga de nutrientes inorgánicos nitrogenados y de ortofosfato es mayor en la estación más alejada de la costa, lo cual sugiere un ascenso de aguas del fondo. De hecho, un estudio realizado en el mar Adriático indica que el fósforo parece ser el nutriente más importante que condiciona la ocurrencia del afloramiento de dinoflagelados del género Ostreopsis (Accoroni et al., 2015, p. 22).
El surgimiento de las aguas de fondo explicaría la presencia de algas bentónicas en la columna de agua. La mayoría de las floraciones de dinoflagelados ocurren a partir del desarrollo de quistes bentónicos que germinan rápidamente (Daranas et al., 2001, p. 1101). Una vez que varían las condiciones ambientales, la tasa de crecimiento de estas especies oportunistas se reduce de forma gradual y comienza la formación de gametos, los cuales se unen para formar un cigoto y posteriormente un quiste, que se sedimenta en el fondo hasta su germinación bajo condiciones ambientales que lo permitan (Anderson, Fukuyo & Mutsuoka, 2004, p. 166). Este fenómeno pudiera explicar la caída en la densidad poblacional de Ostreopsis cf. siamensis en un solo día y por qué, en eventos anteriores, no se había podido determinar la causa de las intoxicaciones masivas en la zona.
En cuanto a las condiciones ambientales en las cuales se presentó la proliferación del año 2014, en octubre la temperatura descendió 2 °C con respecto a la estimada en el mes anterior, la salinidad tuvo un descenso cercano a 1 ups y se apreció un aumento considerable en la concentración de nitrógeno (Pereira, 2019, p. 22). Por lo que se presume que los eventos de intoxicaciones masivas en la costa barloventeña del estado Miranda estén relacionados a estas variables durante la época de precipitaciones máximas.
Al respecto, Smayda & Reynolds (2001, p. 458) plantean que existe un grado alto de imprevisibilidad o estocasticidad durante las floraciones algales, en la que las especies son seleccionadas como resultado de estar presentes en el momento adecuado y en las densidades iniciales necesarias para producir una floración. Un enfoque en el que las propiedades de las formas de vida, preferencias de hábitats y selección estocástica de las especies que generen la floración parece ser más viable y realista que los enfoques actuales de las investigaciones ecológicas. Sin embargo, es bien conocido que para que ocurra una floración algal nociva debe haber una condición específica en la que interactúa un conjunto de variables meteorológicas y oceanográficas, lo cual hace impredecible la ocurrencia de estos eventos (Daranas et al., 2001, p. 1101; Zingone & Wyatt 2004, p. 879; Pistocchi et al., 2011, p. 427).
Por otra parte, estudios relacionados a floraciones de Ostreopsis en los arrecifes del Norte de Nueva Zelanda y las costas de los mares Tirreno, Egeo y Adriático demostraron que la temperatura y la salinidad son factores determinantes para una proliferación excesiva y suelen ocurrir en los periodos de lluvia (Aligizaki & Nikolaidis, 2006, p. 728; Totti, Accoroni, Cerino, Cucchiari & Romagnoli, 2010, p. 237, Pistocchi et al., 2011, p. 422). Mientras que las floraciones en la zona de arrecifes de Veracruz en el Golfo de México, no muestran ninguna correlación con estas variables (Okolodkov et al., 2007, p. 233). En este sentido, Pereira (2019, p. 30) encontró disponibilidad de quistes y células activas de Ostreopsis spp., en el fondo, tanto arenoso como rocoso, a una densidad promedio de 6.473 células/m3 en toda la zona marina y costera entre Chirimena y Cabo Codera durante todo el año, por lo que en el momento que se establezcan las condiciones ambientales que favorezcan su proliferación, se podrá manifestar este fenómeno.
Es importante mencionar que muchas de las especies de dinoflagelados epífitos encontradas en este trabajo han sido reportadas, aunque en densidades inferiores a 1.000 células/l, en el Archipiélago de Los Roques (Pérez-Castresana, Villamizar, Varela & Fuentes, 2014, p. 296), la isla de Margarita (Marchan-Álvarez, Valerio-González, Troccoli-Ghinaglia & López, 2017, p. 159), el golfo de Cariaco (Navarro-Vargas, Díaz-Ramos, Troccoli & Subero, 2014, p. 164) e incluso en isla de Aves (Pereira, Quiñones & Hernández, 2018, p. 48), por lo que la ocurrencia de estos fenómenos no solo dependen de su presencia, sino de las condiciones ambientales que favorezcan su proliferación.
5. Conclusiones
Se evidencia la ocurrencia de intoxicaciones masivas en la zona marina y costera entre Chirimena y Puerto Francés, en la costa central de Venezuela, por afloramientos de microalgas bentónicas de las especies Ostreopsis cf. siamensis, Rhizosolenia setigera y Eutreptiella gymnastica. Se observa que, aunque con ciertas variaciones, la estructura comunitaria durante las floraciones algales nocivas coincidió en los tres eventos estudiados, por lo que se deben estudiar las condiciones ambientales locales que facilitan el sobrecrecimiento de las especies mencionadas.
Agradecimientos
Este estudio fue financiado por Petróleos de Venezuela, S.A. Las muestras fueron analizadas en el laboratorio de Ecología de Sistemas Acuáticos del Instituto de Zoología y Ecología Tropical de la Universidad Central de Venezuela y el laboratorio de Ecotoxicología de la Gerencia de Ambiente de PDVSA Intevep.
Referencias
Accoroni, S., Glibert, P., Pichierri, S., Romagnoli, T., Marini, M. & Totti, C. (2015). A conceptual model of annual Ostreopsis cf. ovata blooms in the northern Adriatic Sea based on the synergic effects of hydrodynamics, temperature, and the N:P ratio of water column nutrients. Harmful Algae, 45, 14–25. Doi: 10.1016/j. hal.2015.04.002.
Aligizaki, K. & Nikolaidis, G. (2006). The presence of the potentially toxic genera Ostreopsis and Coolia (Dinophyceae) in the North Aegean Sea, Greece. Harmful Algae, 5, 717-730. Doi: 10.1016/j.hal.2006.02.005.
Anderson, D. (1994). Red tides. Scientific American, 271(2), 62-68. Doi: 10.1038/scientificamerican0894-62.
Anderson, D., Fukuyo, Y. & Mutsuoka, K. (2004). Cyst methodologies. En: Hallegraeff, G., Anderson, D. & Cembella, A. (Eds). Manual on harmful marine microalgae. IOC Manuals and Guides Nro. 33. París: UNESCO.
APHA, AWWA, WEF. (1998). Standard methods for the examination of water and wastewater. Washington, D.C: American Public Health Association.
Beiras, R. (2018). Nonpersistent inorganic pollution. En: R. Beiras (Ed). Marine pollution. España: Elsevier. Doi:10.1016/b978-0-12- 813736-9.00003-9.
Bravo-Sierra, E. (2004). Fitoflagelados potencialmente tóxicos y nocivos de costas del Pacífico mexicano. Revista de Biología Tropical, 52(1), 5-16. Doi: 10.15517/rbt.v52i1.
Cassis, D., Muñoz, P. & Avaria, S. (2002). Variación temporal del fitoplancton entre 1993 y 1998 en una estación fija del seno Aysén, Chile (45º26′S 73º00′W). Revista de Biología Marina y Oceanografía, 37(1), 43-65. Doi: 10.4067/ s0718-19572002000100007.
Castellanos, P., Varela, R. & Muller-Karger, F. (2002). Descripción de las áreas de surgencia al sur del mar Caribe examinadas con el sensor infrarrojo AVHRR. Memoria de la Fundación La Salle de Ciencias Naturales 154, 55-76. Recuperado de http://www.fundacionlasalle.org.ve/userfiles/9-Memoria%20154%2055-76.pdf.
Ciminiello, P., Dell’Aversano, C., Iacovo, E., Fattorusso, E., Forino, M., Tartaglione, L., Benedettini, G., Onorari, M., Serena, F., Battocchi, C., Casabianca, S. & Penn, A. (2014). First finding of Ostreopsis cf. ovata toxins in marine aerosols. Environmental Science & Technology, 48, 3532-3540. Doi: 10.1021/es405617d.
Clarke, K., Gorley, R., Somerfield, P. & Warwick, R. (2014). Change in marine communities: An approach to statistical analysis and interpretation. United Kingdom: PRIMER-E: Plymouth Marine Laboratory
Daranas, A., Norte, M. & Fernández, J. (2001). Review: toxic marine microalgae. Toxicon, 39, 1101-1132. Doi: 10.1016/s0041-0101(00) 00255-5.
Organización de las Naciones Unidas para la Alimentación y la Agricultura. (2005). Biotoxinas marinas. Food and Nutrition Paper (80). Roma.
Faust, M., Morton, S. & Quod, J. (1996). Further SEM study of marine dinoflagellates: the genus Ostreopsis (Dinophyceae). Journal of Phycology, 32(6), 1053-1065. Doi: 10.1111/ j.0022-3646.1996.01053.x.
Gilabert, J., Gómez, E., Hernández, A., Herrera, M., Tudela, J., García; M. & Gutiérrez, C. (2008). Seguimiento y plan de vigilancia de fitoplancton tóxico en las costas de Águilas (Murcia) en verano de 2006. En: Gilabert (Ed). Avances y tendencias en fitoplancton tóxico y biotoxinas. Acta de la IX reunión Ibérica sobre Fitoplancton Tóxico y Biotoxinas, Cartagena, Colombia.
Gómez, S. (2014). Análisis de las mortandades masivas de peces en el siglo 20, Argentina, Sud América. Bioikos, Campinas 28(2), 95-102. Doi: 10915/47699.
Guerrini, F., Pezzolesi, L., Feller, A., Riccardi, M., Ciminiello, P., Dell’Aversano, C., Tartaglione, L., Delloiacovo, E., Fattorusso, E., Forino, M. & Pistocchi, R. (2010). Comparative growth and toxin profile of cultured Ostreopsis ovata from the Tyrrhenian and Adriatic Seas. Toxicon, 55, 211-220. Doi: 10.1016/j.toxicon.2009.07.019.
Hammer, O., Harper, D. & Ryan, P. (2001). PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 4(1), 1-9. Recuperado de http://palaeo-electronica.org/2001_1/past/issue1_01.htm.
Herrera, L., Febres, G. & Andrés, J. (1980). Distribución de las masas de agua y sus vinculaciones dinámicas en el sector centro-occidental venezolano, Mar Caribe. Boletín del Instituto Oceanográfico de Venezuela, 19(1-2), 93-118. Recuperado de http://www.ojs.udo.edu.ve/index.php/boletiniov/article/view/1136.
Horner, R., Garrison, D. & Plumley, F. (1997). Harmful algal blooms and red tide problems on the U.S. west coast. Limnology and Oceanography, 42, 1076-1088. Doi: 10.4319/ lo.1997.42.5_part_2.1076.
La Barbera-Sánchez, A., Soler, J., Rojas, L. & ChangYen, I. (2004). Paralytic shellfish poisoning (PSP) in Margarita Island, Venezuela. Revista de Biología Tropical, 52(1). Recuperado de https://www.scielo.sa.cr/scielo.php?script=sci_arttext&pid=S0034-77442004000500012.
Marchan-Álvarez, J., Valerio-González, L., Troccoli-Ghinaglia, L. & López, F. (2017). Dinoflagelados bentónicos nocivos, asociados con el sedimento arenoso en dos playas de la isla de Margarita, Venezuela. Revista de Biodiversidad Neotropical, 7(3), 156-68. Doi: 10.18636/ bioneotropical.v7i3.539.
Margalef, R. (1972). Las algas inferiores. En: J. Castelvi, F. Cervigón, M. Díaz-Piferrer, F. Fraga, J. Fukuoka, M. Gómez, R. Margalef, W. Petzall, G. Rodríguez, C. Virgili & F. Vives (Eds). Ecología marina. Fundación La Salle de Ciencias Naturales. Editorial Dosat S.A., Caracas, Venezuela.
Ministerio del Ambiente y de los Recursos Naturales (MARN). (2004). Informe técnico sobre las intoxicaciones y posible contaminación en playas del estado Miranda, Chirimena, Puerto Francés, Caracolito y los Corrales, en el mes de octubre de 2004. (Informe Técnico). Ministerio del Ambiente y de los Recursos Naturales. Caracas, Venezuela.
Monti, M., Minocci, M., Beran, A. & Ivesa, L. (2007). First record of Ostreopsis cfr. ovata on macroalgae in the Northern Adriatic Sea. Marine Pollution Bulletin, 54, 598-601. Doi: 10.1016/j.marpolbul.2007.01.013.
Navarro-Vargas, G., Díaz-Ramos, J., Troccoli, L. & Subero, S. (2014). Dinoflagelados epibentónicos presentes en diferentes sustratos en la bahía Turpialito, Golfo de Cariaco, Venezuela. Boletín del Instituto Oceanográfico de Venezuela, 53(2), 161-170. Recuperado de http://www.ojs.udo.edu.ve/index.php/boletiniov/article/view/1595/1134.
Ogawa, Y. & Ichimura, S. (1984). Phytoplankton diversity in Inland waters of different trophic status Yoshio. Japanese Journal of Limnology, 45(3), 173–177. Doi: 10.3739/rikusui.45.173.
Okolodkov, Y., Campos-Bautista, G., Garate-Lizarraga, I., Gonzales, J., Hoppenrath, M. & Arenas, V. (2007). Seasonal changes of benthic and epiphytic dinoflagellates in the Veracruz reef zone, Gulf of Mexico. Aquatic Microbial Ecology, 47, 223-227. Doi: 10.3354/ ame047223.
Olli, K., Heiskanen, A. & Seppala, J. (1996). Development and fate of Eutreptiella gymnastica bloom in nutrient-enriched enclosures in the coastal Baltic Sea. Journal of Plankton Research, 18(9), 1587-1604. Doi:10.1093/ plankt/18.9.1587.
Pereira, C., Quiñones, R. & Hernández, V. (2018). Fitoplancton del Refugio de Fauna Silvestre Isla de Aves: el territorio venezolano más septentrional. Ciencia, Ambiente y Clima, 1(1), 63-77. Doi: 10.22206/cac.2018.v1i1. pp45-59.
Pereira, C. (2019). Dinámica del microfitobentos y su relación ecológica con el plancton de la zona costera central de Venezuela. (Tesis de doctorado). Universidad Central de Venezuela, Caracas, Venezuela.
Pérez-Castresana, G., Villamizar, E., Varela, R. & Fuentes, Y. (2014). Descripción preliminar del fitoplancton en seis arrecifes coralinos del Parque Nacional Archipiélago de Los Roques. Acta Biológica de Venezuela, 34(2), 293-309. Recuperado de http://saber.ucv.ve/ojs/index.php/revista_abv/article/view/9356.
Pistocchi, R., Pezzolesi, L., Guerrini, F., Vanucci, S., Dell’Aversano, C. & Fattorusso, E. (2011). A review on the effects of environmental conditions on growth and toxin production of Ostreopsis ovata. Toxicon, 57, 421-428. doi:10.1016/j.toxicon.2010.09.013.
Poot, C. (2016). Florecimientos algales nocivos en las costas de Campeche, Golfo de México. Investigación y Ciencia, 24(68), 91-96. Doi: 10.33064/iycuaa2016682264.
Prakash, A. (1967). Growth and toxicity of a marine dinoflagellate, Gonyaulax tamarensis. Journal of the Fisheries Research Board of Canada, 24(7), 1589-1606. Doi: 10.1139/f67-131.
Reguera, B. (2002). Establecimiento de un programa de seguimiento de microalgas toxicas. En: E. Sar, M. Ferrario, y B. Reguera, (Eds). Floraciones algales nocivas en el cono sur americano. Madrid: Instituto Español de Oceanografía.
Reyes-Vásquez, E., Ferraz-Reyes, E. & Vásquez, E. (1979). Toxic dinoflagellate blooms in north eastern Venezuela during 1977. En: D. Taylor, y H. Seliger (Eds). Toxic dinoflagellate blooms. New York, EE. UU.: Elsevier.
Rogers-Bennett, L., Kashiwada, J., Taniguchi, I., Kawana, S. & Catton, C. (2019). Using density-based fishery management strategies to respond to mass mortality events. Journal of Shellfish Research, 38(2), 485-495. Doi: 10.2983/035.038.0232.
Rossi, R., Castellano, V., Scalco, E., Serpe, L., Zingone, A. & Soprano, V. (2010). New palytoxin-like molecules in Mediterranean Ostreopsis cf. ovata (dinoflagellates) and in Palythoa tuberculosa detected by liquid chromatography-electrospray ionization time-of-flight mass spectrometry. Toxicon, 56, 1381-1387. Doi:10.1016/j. toxicon.2010.08.003.
Santos, M., Oliveira, P., Moita, M., David, H., Caeiro, M., Zingone, A., Amorim, A. & Silva, A., (2019). Ocurrence of Ostreopsis in two temperate coastal bays (SW Iberia): Insights from the plankton. Harmful Algae, 86, 20-36. Doi: 10.1016/j.hal.2019.03.003.
Smayda, T. & Reynolds, C. (2001). Community assembly in marine phytoplankton: application of recent models to harmful dinoflagellate blooms. Journal of Plankton Research, 23(5), 447-461. Doi:10.1093/plankt/23.5.447.
Solé, M. & Vera, B. (1997). Caracterización de las macroalgas marinas bénticas en la región Chirimena-Punta Caimán, Edo. Miranda, Venezuela. Caribbean Journal of Science 33(3-4): 180-190. Recuperado de http://www.ciens.ucv.ve/ficofloravenezuela//documentos/Sole&Vera1997.pdf.
Spatharis, S., Dolapsakis, N., Economou-Amilli, A., Tsirtsis, G. & Danielidis, D. (2009). Dynamics of potentially harmful microalgae in a confined Mediterranean Gulf. Assessing the risk of bloom formation. Harmful Algae, 8, 736-743. Doi:10.1016/j.hal.2009.03.002.
Stonik, I. (2007). Species of the genus Eutreptiella (Euglenophyceae) from Russian waters of East/Japan Sea. Ocean Science Journal, 42, 81-88. Doi: 10.1007/BF03020876.
Strickland, J. & Parsons, T. (1972). A practical handbook of seawater analysis. Bulletin of Fisheries Research Board of Canada Ottawa, 167, 1-310. Recuperado de https://epic.awi.de/id/eprint/39262/1/Strickland-Parsons_1972.pdf
Sunesen, I., Bárcena, A. & Sar, E. (2009). Diatomeas potencialmente nocivas del Golfo San Matías (Argentina). Revista de Biología Marina y Oceanografía, 44(1), 67-88. Doi: 10.4067/ S0718-19572009000100007.
Totti, C., Accoroni, E., Cerino, F., Cucchiari, E. & Romagnoli, T. (2010). Ostreopsis ovata bloom along the Conero Riviera (northern Adriatic Sea): Relationships with environmental conditions and substrata. Harmful Algae, 9, 233-239. Doi:10.1016/j.hal.2009.10.006.
Triemer, R. & Zakryś, B. (2015). Photosynthetic euglenoids. En: J. Wehr, R. Sheath, y P. Kociolek, (Eds). Freshwater algae of North America: ecology and classification. (2nd. Ed.). EE. UU.: Academic Press.
Vila, M., Garcés, E. & Masó, M. (2001). Potentially toxic epiphytic dinoflagellate assemblages on macroalgae in NW Mediterranean. Aquatic Microbial Ecology, 26, 51-60. Doi: 10.3354/ ame026051.
Wetzel, R. (2001). The phosphorus cycle. En: R. Wetzel, (Ed). Limnology. California, EE. UU.: Elsevier, Doi:10.1016/b978-0-08-057439-4. 50017-4.
Zingone, A. & Wyatt, T. (2004). Harmful algal blooms: keys to the understandings of the phytoplankton ecology. En: A. Robinson, J. McCarthy, y B. Rothschild, (Eds.). The Sea. Harvard: Harvard University Press.

