Introducción
Illicium es un género que presenta el típico patrón de distribución disjunta entre el este de Asia, la parte este de América del Norte y el Caribe (Heywood, 1978; Li, 1952; Qi, 1995). Patrón disjunto es aquel en que la distribución geográfica de la planta no es continua en un territorio determinado. Estas plantas tienen dispersión balística (Robert & Haynes, 1983; Thien, White & Yatsu, 1983) en la cual, las pequeñas semillas son expelidas sólo a unos pocos metros de la planta madre. Así, es más probable que el patrón de distribución de Illicium sea el resultado de eventos de vicarianza y no de dispersión a larga distancia. Las especies de Illicium en el Nuevo Mundo forman la sección Cymbostemon, donde se distinguen dos clados: Illicium mexicanum A.C.Sm. e Illicium floridanum J. Ellis, ambas especies con tépalos ligulados e Illicium parviflorum Michx. ex Vent., Illicium cubense A.C. Sm., Illicium guajaibonense (Imkhan.) Judd & J.R. Abbott, Illicium ekmanii A.C. Sm. e Illicium hottense Ang. Guerrero, Judd & A.B. Morris con tépalos aovados (Guerrero, 1997; Guerrero, Judd & Morris, 2004; Morris et al., 2007).
Constreñimientos filogenéticos relativos a la biología reproductiva
Hay concenso, tanto acerca de la naturaleza basal, como de la condición relicta de Illicium (Bell, Soltis & Soltis, 2005; Friis, Raunsgaard Penderson & Crane, 2000; Poole et al., 2000; Qiu et al., 2005; Tiffney & Barghoorn, 1979). Este grupo de plantas se pensaba que tenía un síndrome de polinización antiguo y poco eficaz porque sus polinizadores son principalmente dípteros pequeños, comúnmente llamados mimes, los cuales tienen un alcance limitado de vuelo (Thien et al., 1983; White & Thien, 1985), y un restringido método de dispersión balística (Robert & Haynes, 1983). Además, aunque las flores de Illicium, en su mayoría, no se autofecundan, si ocurre y cierto grado de depresión endogámica ha sido demostrado (Buckley, 2012; Thien et al., 2009).
La combinación de una extensa reproducción vegetativa en forma de grandes agregados llamados clones, lo cual fue confirmado por Newell y Morris (2010) en poblaciones de I. parviflorum en Florida, y de polinizadores de vuelos típicamente cortos, resulta en una muy baja producción de frutos que es característica del grupo. Así, la mayoría de los vuelos interflorales se dan entre las flores de su mismo agregado, lo que equivale a decir dentro de un mismo individuo (White &Thien, 1985).
Robert y Haynes (1983) demostraron que lo más lejos que una semilla de Illicium puede ser disparada al ser expelida fuera del folículo es 3.5 m. La dispersión de semillas por aves es de baja probabilidad porque ha sido documentado que muchas especies de este grupo acumulan compuestos venenosos (sesquiterpenos lactonas) en el pericarpio de fruto y en las semillas, y en algunos casos se usan para matar peces (Fukuyama et al., 1992; Smith, 1947).
Las semillas de I. floridanum e I. parviflorum al parecer no son venenosas ya que son consumidas por roedores lo que a menudo afecta la germinación de estas (Thien et al., 1983; White & Thien, 1985). Es posible que las semillas de algunas especies del Nuevo Mundo sean dispersadas por murciélagos, ya que los frutos presentan los cambios de coloración típicos y los aceites esenciales de las plantas que son dispersadas por murciélagos frugívoros (Hodgkison, Balding, Zubaid & Kunz., 2003; Preciado-Benítez, Gómez y Gómez, Navarrete-Gutiérrez & Horyáth, 2015).
Distribución de Illicium en el pasado
Tiffney y Barghoon (1979) revisaron la evidencia fósil de Illicium. Los fósiles de Illicium son bastante raros y, aunque éstos no son abundantes, bastan para apoyar la ocurrencia del género en localidades tales como Alemania durante los períodos del Eoceno, Oligoceno y Mioceno; en Estados Unidos, en los estados de Washington y Alaska, en el Pacífico, y Vermont, en el Atlántico, durante el Eoceno; y en Japón en el Pleistoceno y Plioceno.
Tiffney y Barghoon (1979) sugieren que esta distribución en el pasado sigue el modelo propuesto por Wolfe (1975), es decir, la existencia de un bosque boreotropical en Europa y América del Norte, y se refiere a estos como los bosques de flora tropical que una vez se extendieron en el hemisferio norte durante el Cretácico tardío. Es decir, un mosaico de vegetación mesofítica latifoliada (bosques de hojas anchas no aciculares, y con requerimientos intermedios de humedad). Poole et al., (2000) sugieren que la Antártida tenía una latitud y un clima más ecuatorial, en base a la presencia de Illicioxylum spp. (afinidad con la Illiciaceae) del Cretácico temprano.
En la actualidad, componentes de esta flora boreotropical sobreviven en la región Indomalaya, África, América del Sur e incluso el Caribe (Graham, 1973; Wolfe, 1975). La ocurrencia de esta flora en las Antillas Mayores no es rara, dado que varias montañas de estas islas emergieron en el Cretácico temprano (La Desirade en Guadalupe, Sierra Bermeja en Puerto Rico y la Formación Duarte en La Española) (Montgomery, Pessagno & Pindell, 1994) y en Cuba y La Española se han confirmado sedimentos del Jurásico (Pérez-Estaún et al., 2007). Los cambios climáticos provocados por la deriva continental determinarían la extensión de los tipos de vegetación dentro de este cinturón boreotropical, que con el tiempo se volvió más húmedo y limitado a latitudes bajas y en las montañas tropicales (Graham, 2003; IturraldeVinent, 2004).
La explicación de Wang (1961) sobre el origen de los bosques mesofíticos de China, ya reconocía lo relativo a distribución, composición, y presunciones generales de la hipótesis de la flora boreotropical de Wolfe (1975). Illicium tiene una mayor diversidad y distribución en China y el sureste asiático (Heywood, 1978; Li, 1952; Oh, Denk & Friis., 2003; Saunders, 1995; Smith, 1947). Thien et al., (1983) sugirieron que las especies de Illicium, es su conjunto se encuentran en declive debido a su antigüedad y basalidad. Una reducción de la distribución pasada ciertamente ha ocurrido debido a los cambios climáticos adversos ocurridos durante el Terciario, así como a los eventos de tectónica de placas (Bowin, 1975; Graham, 2003; Iturralde-Vinent, 2004; James, 2005). En otras palabras, los relictos de este bosque sobreviven en las latitudes donde aparecen los hábitats que muestran las condiciones ecológicas óptimas para su adaptación.
Los resultados de Azuma, García Franco, Rico-Gray y Thien (2001) confirman que el clado antillano de las magnolias divergió hace 36 millones de años en el Eoceno tardío, basado en análisis de reloj molecular con modificaciones (matK) usando magnolias de Puerto Rico. Graham (2003) también reseña estos eventos de divergencia y los correlaciona con el enfriamiento de las temperaturas en el Eoceno medio al tardío que originaron este patrón disjunto.
Distribución de Illicium en el presente
El género Illicium aparece en una amplia gama de climas tropicales, como el templado cálido cercano al ecuador (como en Malasia y Sumatra) (Saunders, 1995), hasta Japón (a los 36°N 00’W) en el Viejo Mundo, y entre La Española (18°N 00’W), los Estados Unidos de América (32°N 00’W) y México (24ºN 00’W) en el Nuevo Mundo (Acevedo-Rodríguez & Strong, 2008; Carlquist, 1982; Heywood, 1978; Morris et al., 2007; Smith, 1947). Por otro lado, la mayor parte de sus especies, sobre todo las del Nuevo Mundo, tienen distribuciones geográficas muy discretas (Borhidi, 1991; Guerrero, 1997; Guerrero et al., 2004; Judd et al., 2008; Morris et al., 2007; Smith, 1947). Solo ocho especies de unas 35 que se conocen, aparecen en el Nuevo Mundo; el resto se encuentra en China, India, Japón, Corea, Birmania, Vietnam, Camboya y Malasia.
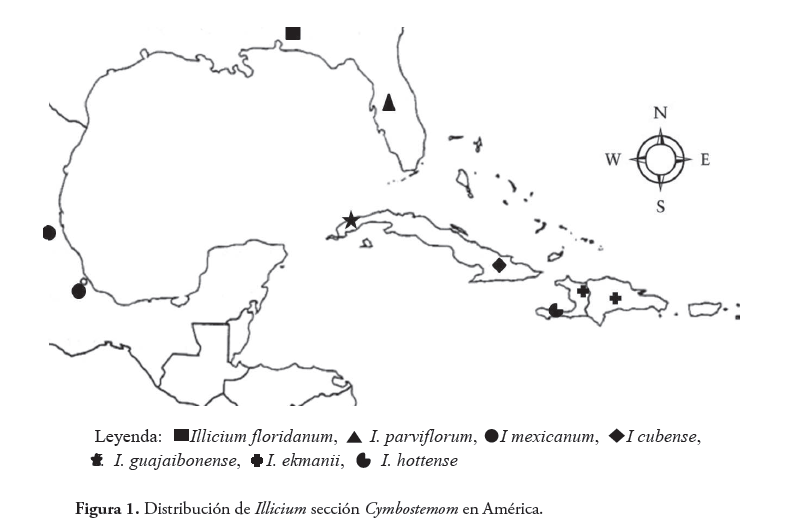
Las especies de América del Norte y el Caribe están restringidas geográficamente a áreas discretas y en forma alopátrica, es decir, las poblaciones presentan patrones de distribución geográfica que no son continuos. Del mismo modo, las especies en La Española y Cuba aparecen de manera disjunta, en paleoislas diferentes (Figura No. 1). En La Española, I. ekmanii aparece en la peleoisla del norte en la Cordillera Central, Massif du Nord y la Cordillera Septentrional, y al parecer, con dos razas químicas distintas, una en cada cordillera. Illicium hottense aparece en la peleoisla sur, en el Massif de la Hotte (Guerrero, 1997; Guerrero et al., 2004).
Cuando Smith (1947) describió I. ekmanii a partir de especímenes de una población del Massif du Nord, el género era solo conocido para Haití, pero Liogier (1971) reportó I. ekmanii en las Cordilleras Central y Septentrional. Un solo espécimen diferente de Illicium (posiblemente relacionado con I. hottense) ha sido colectado en el Massif de la Selle clasificado por Imkanitzkaya (1993) como I. ekmanii subs. selleanum. Dos de las cuatro especies de Illicium subsección Parviflora, aparecen en La Española (Guerrero et al., 2004).
Illicium floridanum en el noroeste de Florida e I. parviflorum, en el sureste, también presentan una distribución disjunta. La primera aparece más al oeste, en Alabama, la región Appalachiocola, y en las llanuras inundables del norte de la Florida, alcanzando así latitudes más templadas que
I. parviflorum, esta última, con un rango más oriental, en la región cálido-templada del centro de la península de Florida. Illicium floridanum e I. parviflorum aparecen en hábitats húmedos e inundables como ambientes ribereños, humedales y bordes de pantanos. Illicium parviflorum se extiende desde la cuenca alta del río St. Johns hasta los pantanos del Condado de Polk; se encuentra restringida a Florida (Guerrero, 1997; Guerrero et al., 2004; Morris et al., 2007).
Illicium cubense, endémica de Cuba, también muestra una distribución disjunta en las dos principales regiones montañosas de esa isla, en la Sierra de Órganos, en la parte oriental, y en el sistema Sierra Maestra-Sierra de Baracoa en el extremo nororiental del sureste de la isla (Borhidi, 1991). Illicium guajaibonense, en el oeste de la isla, fue elevada al rango de especie por Judd et al., (2008) ya que había sido descrita como subespecie por Imkanitzkaya (1993).
Geología caribeña y patrones disjuntos
Bowin (1975) ofrece un buen resumen del origen y geología de La Española. Maurrasse (1982) concluye que el Caribe actual es el resultado de complejos procesos de tectónica de placas superpuestas y que un sólo modelo (petrológico o geoquímico) no puede explicar totalmente la evolución de la geología caribeña. Ambos autores apoyan la teoría de que La Española se compone de dos paleoislas. La porción del norte, que se originó alrededor del sistema Massif du Nord-Cordillera Central, y la parte del sur alrededor del sistema Massif de la Hotte-Massif de la Selle-Sierra de Bahoruco. En las dos paleoislas han sido fechadas localidades del Cretácico temprano. Pérez-Estaún et al., (2007) indican que es el resultado de un proceso de convergencia oblicua de la placa de Norteamérica que colisionó con el arco Cretácico Caribeño.
Graham (2003) revisó los modelos propuestos para la evolución del arco de islas caribeñas y como explica la distribución de la Biota actual. James (2005) también hace una síntesis apretada de la geología caribeña. La variedad de hábitats en el complejo paisaje caribeño resultado de este rompecabezas geológico es una biota muy distintiva, no tan exuberante como la de la selva ecuatorial, pero taxonómicamente diversa y con muchos endemismos (Fritsch & McDowel, 2003). En el pasado, los puentes de tierra fueron el mecanismo propuesto para explicar la relación compleja entre geología y la flora y la fauna de las islas (Liebherr, 1988; Liogier, 1976). Luego, los modelos de vicarianza fueron más populares (Donnelly, 1989; Rosen, 1985), sobre todo cuando se apoyan en la cladística para encontrar puntos de consenso entre varias hipótesis geológicas y geográficas.
Graham (1973) analizó las relaciones de larga distancia y patrones de distribución disjunta de la flora caribeña. Señaló que la flora antillana tiene elementos que están relacionados con Asia, África, América del Sur y Centroamérica. Sobre todo, muchos grupos tienen una distribución disjunta dentro de las islas, principalmente cuando están en cordilleras diferentes (Hager & Zanoni, 1993; Howard, 1948; Judd, 1981; Judd & Skean, 1990; Lavine, 1993; Skean, 1993; Ruiz Vargas, Ortiz Rojas & Guerrero, 2015), o islas diferentes (Graham, 1973; Salzman & Judd, 1995).
No obstante, Graham (1973) no hace referencia a los numerosos grupos que ocupan los bosques nublados y que también presentan este patrón disjunto, tales como los géneros: Alsophila, Cyathea, Podocarpus, Magnolia, Illicium, Persea, Ocotea, Lyonia, Mecranium, Miconia, y la familia Bromeliaceae. La distribución de Magnolia es muy ilustrativa del patrón disjunto ya que el género está presente en todas las islas de las Antillas Mayores con varias especies endémicas en cada isla excepto en Jamaica (Azuma et al., 2001; Graham, 2003; Iturralde-Vinent, 2004).
La relación florística entre Sierra Maestra, en el suroeste de Cuba, y el Massif de la Hotte, en la Península Tiburón de Haití es conocida hace mucho tiempo (Ekman, 1928; Graham, 2003; Judd, 1987). La presencia de Chleroleucon guantanamense (Fabaceae, Mimosaceae) en el suroeste de La Española (Mejía, García & Jiménez, 1994) apoya e incluso extiende esta relación fitogeográfica.
La misma coincide con los cladogramas de áreas basados en varias afinidades propuestas por Rosen (1985) y Donnelly (1988).
Especulaciones biogeográficas
La evidencia fósil sugiere que Illicium no ha cambiado mucho a través del tiempo, como sugieren Tiffney y Barghoorn (1979) y Poole, Gotwald y Francis (2000). El mismo fenómeno, conocido como estancamiento morfogenético, se ha observado también en algunos grupos relacionados, tal como Magnoliaceae (Leppik, 1975). Por consiguiente, se puede postular que la biología reproductiva y forma de dispersión de Illicium tampoco han cambiado mucho. El género Illicium se extendía en los bosques boreotropicales durante el Eoceno, pero no era necesariamente abundante, como su distribución presente y la evidencia fósil sugiere (Azuma et al., 2001; Tiffney y Barghoorn, 1979; Wang, 1961; Wolfe, 1975).
La evidencia geológica dice que el fechado de las rocas volcánicas e intrusivas de las Antillas Mayores: Cuba, La Española y Puerto Rico, son del Cretácico temprano (Albian) y Cretácico tardío (Maestrichtian y Campanian superior) (Bowin, 1975; Pérez-Estaún, 2007). Es difícil decir que porción de esos terrenos estaban a nivel del mar en esa época, pero los movimientos de levantamiento de las costas ocurren aún en el presente y han estado activos desde hace mucho tiempo (Graham, 2003; Iturralde-Vinent, 2004; Maurrase, 1982). Graham (2003) resume y puntualiza muy bien las distancias que han recorrido las placas y los arcos de islas hasta la actualidad.
En cambio, la evidencia estratigráfica sugiere que parte de La Española sur y Jamaica estaban completamente bajo agua durante una parte del Oligoceno (Donnelly, 1989; Graham, 2003; Iturralde-Vinent, 2004; Liebherr, 1988), pero quizás las elevaciones más altas de La Española sur estaban expuestas. Donnelly (1989) argumentó que en la mayor parte de las Antillas Mayores hay un registro suficiente de sedimentos jóvenes que sugieren que una llanura costera rodeaba las islas emergentes durante la mayor parte del Cenozoico medio y tardío, hipótesis de Gaarlandia de Iturralde-Vinent (2004).
Conclusiones
La distribución actual sugiere un patrón continental extendido que coincide con la hipótesis del bosque boreotropical propuesta por Wolfe (1975), confirmada por Azuma et al., (2001) en las magnolias. Así, Illicium pudo haber estado presente en la mayoría de las tierras proto-antillanas y la porción extrema del sur de América del Norte para el Eoceno (Iturralde-Vinent, 2004).
La distribución disjunta de Illicium subsección Parviflora en La Española, al sureste de los Estados Unidos y Cuba, por consiguiente, es consistente con eventos de vicarianza en la evolución geológica temprana de las Antillas (Graham, 2003; IturraldeVinent, 2004). Su ausencia de Jamaica puede ser explicada por la emersión de la isla durante el Oligoceno (Graham, 2003; Iturralde-Vinent, 2004).
La característica de dispersión balística de Illicium hace que eventos de dispersión de larga distancia sean poco probables. La distribución actual de Illicium en Florida refleja probablemente un patrón post-glaciar. El género debe haberse movido hacia la península durante el Oligoceno, ya que esta emergió en ese período (Webb, 1990), pero por su dispersión limitada no pudo alcanzar Jamaica.
Las especies caribeñas, sobre todo I. ekmanii, muestran caracteres ancestrales. Esto puede ser debido al efecto más ligero de las glaciaciones en el Caribe y quizás a la antigüedad de los taxa nativos de las Antillas Mayores. Grimaldi (1988) encontró en el género Mayagüeza, endémico de Puerto Rico (Drosophiliidae, un grupo de moscas de la fruta), del grupo de los polinizadores de Illicium, un patrón de distribución disjunto, similar al de Illicium.
Rosen (1985) plantea que los modelos vicariantes no excluyen la ocurrencia de dispersión. Donnelly (1989) coincide en este aspecto y propuso que el protoarco antillano, durante algunos períodos geológicos específicos, pudo haber facilitado la dispersión cuando el grupo de islas antillanas estuvieron más cercanas entre sí de lo que lo están hoy día (Iturralde-Vinent, 2004).
Debido a la distribución restringida y a las características de su biología reproductiva, todas las poblaciones de Illicium existentes son frágiles y están amenazadas de extinción como lo plantearon Thien et al., (1983). El género probablemente ha sido extirpado en varias localidades en Cuba y La Española, y en Florida, I. parviflorum está en la lista de especie en peligro (Ward, Austin & Coile, 2003) debido a la destrucción de los bosques tropicales en el Caribe y la urbanización desmedida (Guerrero, 1997).
Literatura citada
Acevedo-Rodríguez, P. & Strong, M. T. (2008). Floristic richness and affinities in the West Indies. Bot. Rev. 74: 5-36
Azuma, H., García Franco, J. G., Rico-Gray. V. & Thien, L. B.(2001). Molecular phylogeny of the Magnoliaceae: The biogeography of tropical and temperate disjunctions. Amer J. Bot. 88(12): 2275-2285.
Bell, C. D., Soltis, D. E. & Soltis, P. S. (2005). The age of the Angiosperms: A Molecular Timescale without a Clock. Evolution. 59(6): 1245-1258.
Borhidi, A. (1991). Phytogeography and vegetation. Ecology of Cuba. AkadémiaiKiadó. Budapest.
Bowin, C. (1975). The geology of Hispaniola. EncNairm, A.E.M. & Stehli, F. G. (Ed.), The
Gulf of Mexico and the Caribbean (pp. 501-552). Nueva York: Springer.
Buckley, N. E. (2012). Mating System Biology of the Florida Native Plant: Illicium parviflorum. (Tesis de maestría). University of Tennessee. Estados Unidos.
Carlquist, S. (1982). Wood Anatomy of Illicium (Illiciaceae). Phylogenetic, Ecological, and functional interpretations. Amer. J. Bot. 69: 1587-1598.
Donnelly, T. W. (1988). Geologic constrains on Caribbean Biogeography. En Liebherr, J. K. (Ed.), Zoogeography of Caribbean insects (pp. 14-37). Ithaca: Cornell University Press.
Ekman, E. L. (1928). A botanical excursion in La Hotte, Haiti. Svensk. Bot. Tidskr. 22: 200-219.
Friis, E. M., Raunsgaard Pederson, K. & Crane,
P. R. (2000). Fossil floral structures of a basal angiosperm with monocolpate, reticulateacollumelate pollen from the early cretaceous of Portugal. Grana 39(5): 226-239. Fritsch, P. W. & McDowel, T. D. (2003). Biogeography and phylogeny of Caribbean plants - Introduction. Syst. Bot 28(2): 376-377.
Fukuyama, Y., Shida, N., Kodama, M., Kido, M., Nagasawa, M., & Sugawara, M. (1993). Illicinolides A and B, novel sesquiteperne lactones from the wood of Illicium tashiroi. Tetrahedron 48: 5847-5854.
Graham, A. (1973). History of arborescent temperate element in northern Latin American Biota. En Graham, A. (Ed.), Vegetation and vegetational history in northern Latin America (pp. 301-312). Indiana: Elsevier Scientific Publishing Company.
Graham, A. (2003). Geohistory models and Cenozoic paleoenviroments of the Caribbean region. Syst. Bot. 28(2): 378-386.
Grimaldi, D. (1988). Relicts in the Drosophilidae (Diptera). En Liebherr, J. K. (Ed.), Zoogeography of Caribbean insects (pp. 183–213). Ithaca: Cornell University Press.
Guerrero, A. (1997). A revision of subsection Parviflora (Illiciaceae). (Tesis de maestría). University of Florida at Gainesville. Estados Unidos.
Guerrero, A., Judd, W. & Morris, A. (2004). A New Species of Illicium Subsection Parviflora (Illiciaceae) from the Massif de la Hotte, Haiti. Brittonia. 56(4): 346-352.
Hager, J. & Zanoni, T. A. (1993). La vegetación natural en la República Dominicana. Una nueva clasificación. Moscosoa 7: 39-81.
Heywood, V. H. (Ed.). (1978). Flowering plants of the world. Nueva York: Mayflowers Books.
Hodgkinson, R., Balding, S. T., Zubaid, A. & Kunz, T. H. (2003). Fruit Bats (Chiroptera: Pteropodidae) as Seed Dispersers and Pollinators in a Lowland Malaysian Rain Forests. Biotropica 35(4): 491–502.
Inkanitzakaya, N. (1993). The genus Illicium (Illiciaceae) in the flora of the Antilles. Bot. Zhur. St. Peterburg 78: 1-15.
Iturralde-Vinent, M. (2004). La Paleogeografía del Caribe y sus implicaciones para la biogeografía histórica. Revista del Jardín Botánico Nacional de Cuba. 25-26: 49-78.
James, K. H. (2005). A simple synthesis of Caribbean geology. Caribbean Journal of Earth Science, 39: 69-82.
Judd, W. & Skean Jr, D. J. (1990). Flora of Pick Macaya in Haiti. Aaditions. Moscosoa 6: 124-133.
Judd, W. (1981). A monograph of Lyonia (Ericaceae). J. Arnold Arbor. 62: 63-128.
Lavine, M. (1993). Biogeography and systematics of Poitea (Leguminosae): Inferences from morphological and molecular data. Syst. Bot. Monogr. 37: 1-87.
Leppik, E. E. (1975). Morphogenetic stagnations in the evolution of Magnolia flowers. Phytomorphology 25: 451-464.
Li, H. L. (1952). Floristic relationships between Eastern Asia and Easters North America. Amer. Phill. Soc. 52: 371-408.
Liebherr, J. K. (1988). The Caribbean: fertil ground for zoogeography. En Liebherr, J. K. (Ed.), Zoogeography of Caribbean insects (pp. 1-44). Ithaca: Cornell University Press.
Liogier, A. H. (1976). La flora de La Española: Análisis y origen probable. Anales de la Academia de Ciencias de la República Dominicana. 2: 17-46.
Liogier, A. H. (2000). Diccionario Botánico de Nombres Vulgares de plantas de La Española. Jardín Botánico Dr. Rafael Ma. Moscoso. Santo Domingo.
Maurrasse, F. (1982). Survey of the geology of Haiti. Miami Geological Society. Miami.
Mejía, M., García, R., & Jiménez, F. (1994). Notas sobre la flora de La Española IV. Moscosoa 8: 33-44.
Montgomery, H., Pessagno, E. A. & Pindell, J. L., (1994). Paleogeography of Jurassic fragments in the Caribbean. Tectonics 13(3): 725-732.
Morris, A., Bell, C. D., Clayton, J. W., Judd, W. S., Soltis, D. E., & Soltis, P.S. (2007). Phylogeny and divergence time estimation in Illicium with implications for New World Biogeography. Syst. Bot. 32(2): 236-249.
Newell, D. L. & Morris, A. B. (2010). Clonal structure of wild populations and origins of horticultural stock of Illicium parviflorum (Illiciaceae). Amer. J. Bot. 97(9): 1574-1578.
Oh, I.-C., Denk, T. & Friis, E. M. (2003). Evolution of Illicium (Illiciaceae): mapping morphological characters on the molecular tree. Plant Systematics and Evolution 240: 175-209.
Pérez-Estaún, A., Hernaiz Huerta, P. P., Lopera, E., Joubert, M. & Grupo SISMYN (J. Escuder Viruete, A. Díaz de Neira, J. Monthel, J. García-Senz, P. Ubrien,
F. Contreras, E. Bernárdez, G. Stein, I. Deschamps, J. L. García-Lobón, C. Ayala). (2007). Geología de la República Dominicana: de la construcción de arcoisla a la colisión arco-continente. Boletín Geológico y Minero, 118 (2): 157-174. Poole, I., Gotwald, H. & Francis, J. E. (2000). Illicioxylon, an Element of Gondwanan Polar Forests? Late Cretaceous and Early Tertiary Woods of Antarctica. Annals of Botany 86: 421-432.
Preciado-Benítez, O., Gómez y Gómez, B., Navarrete-Gutiérrez, D. A. & Horváth, A. (2015). The use of commercial fruits as attraction agents may increase the seed dispersal by bats to degraded areas in Southern Mexico. Tropical Conservation 8(2): 301-317.
Qi, L. (1995). The Geographical Distribution of the Family Illiciaceae. J. of Trop. Subtrop. Bot. 3: 1-11.
Qiu, Y. L, Dombrovska, O., Lee, J., Li, L., Whitlock, B. A., Bernasconi-Quadroni, F., Rest, J. S., Davis, C. C., Borsch, T., Hilu, K. W., Renner, S. S., Soltis, D. E., Soltis, P. S., Zanis, M. J., Cannone, J. J. & Gutell, R. R. (2005). Phylogenetic analyses of basal angiosperms based on nine plastid, mitochondrial, and nuclear genes. Int. J. Plant Sci. 166(5): 815–842.
Roberts, M. L. & Haynes, R. (1983). Ballistic seed dispersal in Illicium (Illiciaceae). Pl. Sist. Evol. 143: 227-232.
Rosen, D. E. (1985). Geological hierarchies and biogeographic congruence in the Caribbean. Annals Mo. Bot. Gard. 72: 636-659.
Ruiz Vargas, N., Ortiz Rojas, C. & Guerrero, A. (2015). Distribución de la familia Bromeliaceae Juss. En La Española en base a colecciones de herbario. Moscosoa 19: 22-36.
Salzman, V. T. & Judd, W. S.(1995). A revision of the Greater Antillean species of Bactris (Bactrinidae: Arecaceae). Brittonia 47: 345-371.
Saunders, R. M. K. (1995). Systematics of the genus Illicium L. (Illiciaceae) in Malesia. Botanical Journal of the Linnean Society, 117: 333–352.
Smith, A. C. (1947). The families Illiciaceae and Schisandraceae. Sargentia 7: 1-224.
Thien, L. B., White, D. A. & Yatsu, L. Y. (1983). The reproductive biology of a relict-Illicium floridanum Ellis. Amer. J. Bot. 70(5): 719-727.
Thien, L. B., Bernhardt, P., Devall, M. S., Chen, Z. D., Luo, Y. B., Fan, J. H., Yuan, L. C. & Williams, J. H. (2009). Pollination biology of basal angiosperms (ANITA grade). Amer. J. Botany 96(1): 166–182. Tiffney, B. H. & Barghoorn, E. S. (1979). Flora of the Brandon lignite. IV. Illiciaceae. Amer. J. Botany 66: 321-329.
Ward, D. B., Austin, D. F. & Coile, N. C. (2003). Endangered and Threatened Plants of Florida, Ranked in Order of Rarity. Castanea 18(2): 160-174.
Webb, S. D. (1990). Historical biogeography. EnMyers, R. & Ewell, J. (Ed.), Ecosystems of Florida (pp. 70-100). Orlando: University of Central Florida Press.
White, D. A. & Thien, L. B. (1988). The pollination of Illicium parviflorum (Illiciaceae). J. of the Elisha Mitchell Scientific Soc. 10: 15-18.
Wolfe, J. A. (1975). Some aspects of plant geography of the northern hemisphere during the late Cretaceous and Tertiary. Ann. Mo. Bot. Gard. 62: 264-279.
