1. Introducción
El Refugio de Fauna Silvestre Isla de Aves es considerado un bastión geoestratégico de gran importancia para la República Bolivariana de Venezuela, ya que representa la porción de tierra sobre el nivel de mar más septentrional del país, de la cual se derivan más de 130.000 Km2 de mar territorial, plataforma continental y zona económica exclusiva. Está ubicada en el Mar Caribe (15° 40' 23,7” N 63° 36' 59,9” W), a 435 Km al norte de la Blanquilla, 650 Km al noreste del Puerto de La Guaira, 520 Km al Norte de la Isla de Margarita, 200 Km al oeste de Dominica y 350 Km al sureste de Puerto Rico (Hubschmann et al., 1988).
Isla de Aves pertenece a una formación geológica consolidada que se denomina Promontorio de Aves, el cual, cubre un área extensa que se proyecta al norte del territorio insular venezolano. Esta cadena submarina está asociada a la subducción, sobrecorrimiento y desplazamiento de la Placa del Caribe o Caribia, la cual, ha sufrido una evolución histórica a partir de un levantamiento inicial y rápido de la tierra, producido por actividad volcánica, seguido de erosión gradual y subsidencia. A pesar de esto, diversos investigadores afirman que el crecimiento de arrecifes coralinos supera a la subsidencia geológica de la zona, por lo menos en un orden de magnitud (Gruber, 2003).
Debido a su alta diversidad biológica, incluyendo la de aves migratorias, y por ser el sitio de anidación de la tortuga verde (Chelonia mydas) más importante del país, y el segundo en el mar Caribe, luego del Parque Nacional de Tortuguero en Costa Rica (Guada y Solé, 2000, p. 22); en 1972 fue decretada Refugio de Fauna Silvestre. Sin embargo, se han realizado pocos estudios sobre sus comunidades marinas, destacándose el de Yranzo, Villamizar, Romero y Boadas (2014), en el que se identificaron 36 especies de corales pétreos y cuatro de hidrocorales, siendo Porites astreoides, Pseudodiploria strigosa y Siderastrea siderea las especies más abundantes, con una cobertura promedio de coral vivo estimada de 22,30%.
Una de las comunidades que sustenta la alta biodiversidad de este ecosistema marino es el fitoplancton, del cual no se han publicado estudios. Las comunidades fitoplanctónicas incluyen a las microalgas suspendidas en la columna de agua que están a la merced de la dinámica costera. Este grupo de organismos fotosintetizadores constituye la base de la trama alimentaria en la mayor parte de las comunidades marinas, ya que además de utilizar los nutrientes elementales del agua y transformarlos en materia orgánica (Yilmaz, Yardimci, Elhag & Dumitrache, 2018), es responsable en gran proporción de la productividad primaria oceánica (Arrigo et al., 1999; Luz y Barkan, 2000). Asimismo, el fitoplancton es capaz de responder rápidamente ante las fluctuaciones hidrográficas, explicando la mayoría de los procesos oceánicos y es considerado, el principal regulador de oxígeno y dióxido de carbono de la atmósfera (Troccoli, 2001). Son estas las razones por lo que se planteó hacer un inventario de las especies de microalgas que constituyen la comunidad fitoplanctónica del refugio de fauna silvestre Isla de Aves.
2. Materiales y Métodos
2.1 Área de estudio
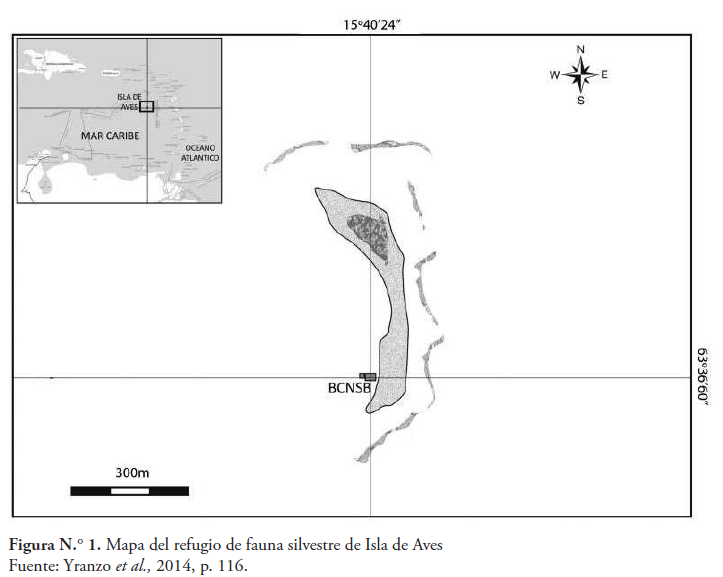
Isla de Aves es una Dependencia Federal Venezolana de forma alargada en sentido norte-sur, con su parte central más angosta. Posee 600 m de longitud en sentido norte-sur y 130 m en sentido este-oeste con una superficie de 42.000 m2 (ver figura 1). Es un área afectada por el paso de tormentas y huracanes, y ha sido considerada de bajo impacto antropogénico, debido a que no tiene presión de pesca y turismo, con un desarrollo de actividades humanas muy bajo, ya que la población residente en la isla es de 15 personas aproximadamente (Yranzo et al., 2014).
2.2 Obtención de datos
Para la captura del fitoplancton, se realizaron 16 arrastres entre 200 y 300 m alrededor de la isla, con una red cónica de plancton con diámetro de malla de 60 µm, en julio de 2011 y en julio de 2012. Cada arrastre tuvo una duración de 10 minutos aproximadamente y mediante el empleo de una embarcación inflable con motor fuera de borda, a una velocidad promedio de 5 km/h. La red se arrastró en la zona superficial de la columna de agua en horas de la mañana. Las muestras fueron recolectadas en envases de 500 ml y fijadas in situ con una solución de lugol y formalina neutralizada al 5% v/v.
En el laboratorio, se estimó la abundancia de las microalgas por el método de Utermölh (1958), mediante el uso de cámaras de sedimentación y un microscopio invertido marca Leica. La identificación taxonómica de las especies de microalgas se realizó utilizando los trabajos de Cupp (1943), Peragallo (1965), Ferguson (1968), Saunders y Glenn (1969), Sournia (1986), Balech (1988), Round, Crawford y Mann (1990), ChretiennotDinet Sournia, Ricard y Billard (1993), Tomas (1996), Yamaji (1996), Berárd-Therriault, Poulin y Bossé (1999), Soler, Pérez y Aguilar (2003), AlYamani y Saburova (2011), Siqueiros-Beltrones, Valenzuela, Hernández, Argumedo & López, (2004), Siqueiros-Beltrones y Hernández (2006), entre otros. La revisión y actualización de los nombres científicos se realizó en la página web de Algaebase.org (Guiry & Guiry, 2018).
Con los resultados obtenidos, se elaboró una matriz de las especies del fitoplancton, en la cual se incluye su abundancia y riqueza. Posteriormente, se elaboró una matriz de similaridad, usando la distancia de Bray Curtis para cuantificar la contribución de cada especie a la disimilaridad temporal de la estructura comunitaria del fitoplancton; y un ANOSIM, para estimar si existen diferencias significativas entre las muestras. Los análisis estadísticos se realizaron con el paquete PAST 3.2 (Hammer, Harper & Ryan, 2001).
3. Resultados
En las muestras analizadas, se identificaron 191 especies distribuidas en 121 diatomeas (63% de la comunidad), 58 dinoflagelados (30%), 6 cianobacterias (3%), 3 euglenofitas (2%) y 3 silicoflagelados (2%). El grupo de las diatomeas se distribuyó en 3 clases, 29 órdenes y 45 familias, mientras que los dinoflagelados en 2 clases, 8 órdenes y 15 familias; las cianobacterias en 1 clase, 3 órdenes y 5 familia; las euglenofitas en 2 clase, 2 órdenes y 3 familias; y los silicoflagelados en 1 clase, 2 órdenes y 3 familias, tal como se indica en la lista de especies. Las especies más frecuentes fueron las diatomeas: Asterionellopsis glacialis, Asteroplanus karianus, Chaetoceros dydimus, Cocconeis ornata, Coscinodiscus perforatus, Haslea wawrikae, Isthmia enervis, Lauderia annulata, Leptocylindrus danicus, Leptocylindrus minimus, Lyrella lyra, Nitzschia sp., Pseudoguinardia recta, Rhizosolenia styliformis, Skeletonema costatum, Thalassiosira nordenskioldii; la cianobacteria: Trichodesmium thiebauthii; los dinoflagelados: Gymnodinium cinctum, Ornithocercus magnificus, Ostreopsis ovata, Ostreopsis siamenses, Tripos spp., y las euglenofitas: Phacus sp. y Eutreptiella gymnastica.
En cuanto a la abundancia, durante los muestreos realizados en el año 2011 se obtiene una media de 1999 células/litro, de las cuales las diatomeas contribuyen con el 68 %, siendo las especies más importantes: Leptocylindrus minimus, Chaetoceros dydimus, Leptocylindrus danicus, Asteroplanus karianus, Nitzschia sp.1, Coscinodiscus perforatus, Licmophora abreviatta, Prosbocia alata, Skeletonema costatum, Haslea wawrikae y Cylindrotheca closterium. El segundo grupo más importante es el de las cianobacterias con un 27 % de la abundancia, siendo Trichodesmium thiebauthii la especie más importante. A pesar que los dinoflagelados sólo representan cerca del 4% de la abundancia, la especie que contribuye en mayor proporción a este porcentaje es Tripos azoricum. En el año 2012, la abundancia fue muy similar al año anterior, obteniéndose una media de 1,546 células/litro, en la que las diatomeas contribuyeron en un 62% con las especies Skeletonema costatum, Pseudoguinardia recta y Leptocylindrus danicus, seguidas por las cianobacterias con un 33% y los dinoflagelados con 4%, siendo las especies más importantes, la cianobacteria: Trichodesmium thiebauthii y los dinoflagelados: Ostreopsis ovata, Gymnodinium cinctum y Scrippsiella acuminata.
Al aplicar una prueba Anosim, para establecer las diferencias de la comunidad fitoplanctónica en los dos años muestreados, se obtuvo que no hay diferencias significativas (R = 0,25; p = 2,1 %). La prueba SIMPER indica una similaridad entre las muestras del año 2011 de 42,5 % en la que Trichodesmium thiebauthii, Asteroplanus karianus, Coscinodiscus perforatus, Skeletonema costatum, Nitzschia sp. 1, Leptocylindrus danicus y Haslea wawrikae contribuyeron con más del 70% a la similaridad encontrada. Mientras que en 2012, la similaridad fue un poco menor (25,6%), siendo las especies que contribuyeron en mayor proporción a esta similaridad
Trichodesmium thiebauthii, Skeletonema costatum, Pseudoguinardia recta, Nostoc sp. y Leptocylindrus danicus. Al comparar ambos años, la similaridad fue del 21% con la contribución mayor de las especies mencionadas anteriormente.
A continuación, se presenta la lista de especies de microalgas identificadas en el refugio de fauna silvestre de Isla de Aves.
Diatomeas
PHYLUM: BACILLARIOPHYTA Karsten 1928
CLASE: BACILLARIOPHYCEAE Haeckel 1878
ORDEN: Bacillariales Hendey 1937 emend. Round et al. 1990
FAMILIA: Bacillariaceae Ehrenberg 1831
Bacillaria paxillifera (O. F. Müller) T. Marsson 1901
Cylindrotheca closterium (Ehrenberg) Reimann & J. C. Lewin 1964
Nitzschia sp. Hassall Nitzschia acicularis (Kützing) W. Smith 1853
Nitzschia angularis W. Smith 1853
Nitzschia fasciculata Grunow en Van Heurck 1881
Nitzschia hyalina Gregory 1857
Nitzschia incurvata var. lorenziana Ross 1986
Nitzschia lanceolata Smith 1853
Nitzschia longissima (Brébisson) Ralfs en Pritchard 1861
Pseudo-nitzschia pungens (Grunow ex Cleve) Hasle 1993
Pseudo-nitzschia seriata (Cleve) H. Peragallo en H. Peragallo & M. Peragallo 1899
ORDEN: Cocconeidales Cox 2015
FAMILIA: Cocconeidaceae Kützing 1844
Cocconeis ornata W. Gregory 1857
Cocconeis scutellum Ehrenberg 1838
ORDEN: Cymbellales Mann en Round, Crawford & Mann 1990
FAMILIA: Gomphonemataceae Kützing 1844
Gomphonema acuminatum Ehrenberg 1832
ORDEN: Eunotiales Silva en Lewin 1962
FAMILIA: Eunotiaceae Kützing 1844
Eunotia sp. Ehrenberg 1837
ORDEN: Fragiliarales Silva 1962 emend. Round
FAMILIA: Fragilariaceae Greville 1833
Asteroplanus karianus (Grunow) C. Gardner & R.M.Crawford en R.M. Crawford & C. Gardner 1997
Fragilaria Lyngbye 1819
Podocystis adriatica (Kützing) Ralfs en Pritchard 1861
ORDEN: Licmophorales Round 1990
FAMILIA: Licmophoraceae Kützing 1844
Licmophora abbreviate C. Agardh 1831
Licmophora gracilis (Ehrenberg) Grunow 1867
Licmophora remulus (Grunow) Grunow 1867
Licmophora tenuis (Kützing) Grunow 1867
FAMILIA: Ulnariaceae E. J. Cox 2015
Tabularia fasciculate (Agardh) Williams & Round 1986
Ulnaria capitata (Ehrenberg) Compère 2001
ORDEN: Lyrellales D. G. Mann 1990
FAMILIA: Lyrellaceae D. G. Mann 1990
Lyrella lyra (Ehrenberg) Karajeva 1978
ORDEN: Mastogloiales Mann 1990
FAMILIA: Achnanthaceae Kützing
1844 Achnanthes longipes Agardh 1824
ORDEN: Naviculales Bessey 1907
FAMILIA: Amphipleuraceae Grunow 1862
Halamphora turgida (Gregory) Levkov 2009
FAMILIA: Diploneidaceae Mann 1990
Diploneis crabro (Ehrenberg) Ehrenberg 1854
FAMILIA: Naviculaceae Kützing 1844
Gyrosigma attenuatum (Kützing) Rabenhorst 1853
Haslea ostrearia (Gaillon) Simonsen 1974
Haslea wawrikae (Husedt) R. Simonsen 1974
Navicula sp. Bory 1822 Navicula arenicola Grunow 1882
Navicula palpebralis Brébisson ex Smith 1853
Pinnunavis yarrensis (Grunow) Okuno 1975
FAMILIA: Pinnulariaceae Mann 1990
Pinnularia Ehrenberg 1843
FAMILIA: Plagiotropidaceae Mann en Round, Crawford & Mann 1990
Plagiotropis lepidoptera (Gregory) Kuntze 1898
FAMILIA: Pleurosigmataceae Mereschowsky 1903
Pleurosigma formosum W. Smith 1852
ORDEN: Rhabdonematales Round & Crawford 1990
FAMILIA: Grammatophoraceae Lobban & Ashworth 2014
Grammatophora marina (Lyngbye) Kützing 1844
Grammatophora oceanica Ehrenberg 1840
FAMILIA: Rhabdonemataceae Round & Crawford 1990
Rhabdonema Kützing 1844
ORDEN: Rhaphoneidales Round in Round et al., 1990
FAMILIA: Asterionellopsidaceae, Medlin 2016
Asterionellopsis glacialis (Castracane) Round in Round, Crawford & Mann 1990
FAMILIA: Psammodiscaceae Round & D. G. Mann 1980
Psammodiscus nitidus (W.Gregory) Round & D.
G. Mann 1980
ORDEN: Rophalodiales Mann 1990
FAMILIA: Rhopalodiaceae (Karsten) Topachevs’kyj & Oksiyuk 1960
Epithemia Kützing 1844
ORDEN: Striatellales Round1990
FAMILIA: Striatellaceae Kützing 1844
Striatella unipunctata (Lyngbye) Agardh 1832
ORDEN: Surirellales D. G. Mann 1990
FAMILIA: AuriculaceaeHendey 1964
Auricula sp. Castracane 1873
FAMILIA: Entomoneidaceae Reimer en Patrick & Reimer 1975
Entomoneis paludosa (Smith) Reimer en Patrick & Reimer 1975
FAMILIA: Surirellaceae Kützing 1844
Campylodiscus neofastuosus Ruck & Nakov en Ruck et al. 2016
Iconella biseriata (Brébisson) Ruck & Nakov en Ruck et al. 2016
Surirella librile (Ehrenberg) Ehrenberg 1845
ORDEN: Tabellariales Round 1990
FAMILIA: Tabellariaceae Kützing 1844
Asterionella formosa Hassall 1850
Meridion circulare (Greville) Agardh 1831
ORDEN: Thalassiophysales Mann 1990
FAMILIA: Catenulaceae Mereschkowsky 1902
Cocconeis costata Gregory 1855
Amphora crassa Gregory 1857
Amphora ocellata Donkin 1861
Amphora proteus Gregory 1857
ORDEN: Thalassionematales Round 1990
FAMILIA: Thalassionemataceae Round 1990
Thalassionema nitzschioides (Grunow) Mereschkowsky 1902
CLASE: COSCINODISCOPHYCEAE (Round & Crawford 1990)
ORDEN: Aulacoseirales Crawford en Round, Crawford & Mann 1990
FAMILIA: Aulacoseiraceae Crawford 1990
Aulacoseira crenulata (Ehrenberg) Thwaites 1848
ORDEN: Coscinodiscales Round & Crawford en Round, Crawford &Mann 1990
FAMILIA: Coscinodiscaceae Kützing 1844
Coscinodiscus perforates Ehrenberg 1844
Coscinodiscus wailesii Gran & Angst 1931
Palmerina hardmaniana Hasle 1996
FAMILIA: Hemidiscaceae Hendey ex Hasle in Hasle & Syvertsen 1996
Pseudoguinardia recta Stosch 1986
ORDEN: Melosirales Crawford in Round, Crawford & Mann 1990
FAMILIA: Melosiraceae Kützing 1844
Melosira nummuloides Agardh 1824
ORDEN: Rhizosoleniales P. C. Silva en R. A. Lewin 1962
FAMILIA: Probosciaceae Nikolaev & Harwood en Nikolaev et al. 2001
Proboscia alata (Brightwell) Sundström 1986
FAMILIA: Rhizosoleniaceae De Toni 1890
Dactyliosolen fragilissimus (Bergon) Hasle en Hasle & Syvertsen 1996|
Guinardia delicatula (Cleve) Hasle en Hasle & Syvertsen 1997
Guinardia fláccida (Castracane) H.Peragallo 1892
Guinardia striata (Stolterfoth) Hasle en Hasle & Syvertsen 1996
Pseudosolenia calcar-avis Schultze Sundström 1986
Rhizosolenia acuminata H. Peragallo en H. Peragallo & M. Peragallo 1907
Rhizosolenia castracanei Peragallo 1888
Rhizosolenia imbricata Brightwell 1858
Rhizosolenia obtusa Hensen 1887
Rhizosolenia setigera Brightwell 1858
Rhizosolenia styliformis Brightwell 1858
ORDEN: Triceratiales Round & Crawford 1990
FAMILIA: Triceratiaceae (Schütt) Lemmermann 1899
Triceratium balearicum Cleve & Grunow en Cleve 1881
Triceratium dubium Brightwell 1859
Triceratium favus Ehrenberg 1839
Triceratium gibbosum Harvey & Bailey 1854
CLASE: MEDIOPHYCEAE (Jousé & ProshkinaLavrenko) Medlin & Kaczmarska 2004
ORDEN: Biddulphiales Krieger 1954
FAMILIA: Bellerocheaceae Crawford 1990
Bellerochea malleus (Brightwell) Van Heurck 1885
FAMILIA: Biddulphiaceae Kützing 1844
Biddulphia sp. Gray 1821
Biddulphia alternans (Bailey) Van Heurck 1885
ORDEN: Chaetocerotales Round & Crawford en Round et al. 1990
FAMILIA: Chaetocerotaceae Ralfs en Pritchard 1861
Chaetoceros affinis Lauder 1864
Chaetoceros atlanticus Cleve 1873
Chaetoceros bacteriastrius G. C. Wallich Chaetoceros coarctatus Lauder 1864
Chaetoceros compressus Lauder 1864
Chaetoceros costatus Pavillard 1911
Chaetoceros curvisetus Cleve 1889
Chaetoceros danicus Cleve 1889
Chaetoceros decipiens Cleve 1873
Chaetoceros dydimus Ehrenberg 1845
Chaetoceros gracilis Pantocsek 1892
Chaetoceros holsaticus F. Schütt 1895
Chaetoceros lorenzianus Grunow 1863
Chaetoceros peruvianus Brightwell 1856
Chaetoceros sociales Lauder 1864
Chaetoceros teres Cleve en Aurivillius 1896
Chaetoceros pseudocurvisetus Mangin 1910
FAMILIA: Leptocylindraceae Lebour 1930
Leptocylindrus danicusCleve 1889
Leptocylindrus minimusGran 1915
ORDEN: Cymatosirales Round & Crawford en Round et al., 1990
FAMILIA: Cymatosiraceae Hasle, Stosch & Syvertsen 1983
Plagiogrammopsis vanheurckii (Grunow) Hasle, Stosch & Syvertsen 1983
ORDEN: Eupodiscales Nikolaev & Harwood en Witkowski & Sieminska 2000
FAMILIA: Eupodiscaceae Ralfs en Pritchard 1861
Odontella aurita (Lyngbye) Agardh 1832
Odontella obtusa Kützing 1844
Trieres regia (M.Schultze) Ashworth & Theriot en Ashworth et al., 2013
ORDEN: Hemiaulales Round & Crawford 1990
FAMILIA: Hemiaulaceae Heiberg 1863
Cerataulina bicornis (Ehrenberg) Hasle Cerataulina pelagica (Cleve) Hendey 1937
Hemiaulus hauckii Grunow ex Van Heurck 1882
Hemialus membranaceus Cleve 1873
Hemialus sinensis Greville 1865
FAMILIA: Isthmiaceae Schütt 1896
Isthmia enervis Ehrenberg 1838
ORDEN: Lithodesmiales Round & Crawford 1990
FAMILIA: Lithodesmiaceae Round 1990
Ditylum brigthwellii (T.West) Grunow en Van Heurck 1885
Lithodesmium undulatum Ehrenberg 1839
ORDEN: Thalassiosirales Glezer & Makarova 1986
FAMILIA: Lauderiaceae (Schütt) Lemmermann 1899
Lauderia annulata Cleve 1873
FAMILIA: Skeletonemataceae Lebour 1930
Detonula pumila (Castracane) Gran 1900
Skeletonema costatum (Greville) Cleve 1873
FAMILIA: Thalassiosiraceae Lebour 1930
Planktoniella sol (Wallich) Schütt 1892
Thalassiosira eccentrica (Ehrenberg) Cleve 1904
Thalassiosira nordenskioeldii Cleve 1873
ORDEN: Toxariales Round 1990
FAMILIA: Climacospheniaceae Round 1990
Climacosphenia elongata Bailey 1854
DINOFLAGELADOS
PHYLUM: MIOZOA Cavalier-Smith 1987
CLASE: DINOPHYCEAE Fritsch en West & Fritsch 1927
ORDEN: Dinophysiales Kofoid 1926
FAMILIA: Amphisoleniaceae Lindemann 1928
Amphisolenia bidentata Schröder 1900
Amphisolenia bifurcata Murray & Whitting 1899
FAMILIA: Dinophysaceae Bütschli 1885
Dinophysis caudata Kent 1881
Ornithocercus magnificusStein 1883
Ornithocercus quadrates Schütt 1900
FAMILIA: Oxyphysiaceae Sournia 1984
Phalacroma doryphorum Stein 1883
Phalacroma favus Kofoid & Michener 1911
Phalacroma mitra Schütt 1895
ORDEN: Gonyaulacales Taylor 1980
FAMILIA: Ceratiaceae Kofoid 1907
Tripos arietinus (Cleve) Gómez 2013
Tripos azoricus (Cleve) Gómez 2013
Tripos brevis (Ostenfeld & Johannes Schmidt) Gómez 2013
Tripos candelabrum (Ehrenberg) Gómez 2013
Tripos dens (Ostenfeld & Johannes Schmidt) Gómez 2013
Tripos furca (Ehrenberg) Gómez 2013
Tripos fusus (Ehrenberg) Gómez 2013
Tripos karstenii (Pavillard) Gómez 2013
Tripos lineatum (Ehrenberg) Gómez 2013
Tripos longinum (Karsten) Gómez 2013
Tripos longipes (Bailey) Gómez 2013
Tripos macroceros (Ehrenberg) Gómez 2013
Tripos massiliensis (Gourret) Gómez 2013
Tripos muelleri Bory en Lamouroux, Bory & Deslongschamps 1827
Tripos pentagonus (Gourret) Gómez 2013
Tripos reticulatus (Pouchet) Gómez 2013
Tripos vultur (Cleve) Gómez 2013
FAMILIA: Gonyaulacaceae Lindemann 1928
Gonyaulax Diesing 1866
FAMILIA: Ostreopsidaceae Lindemann 1928
Coolia monotis Meunier 1919
Ostreopsis lenticularis Fukuyo 1981
Ostreopsis siamensis Johs. Schmidt 1901
FAMILIA: Protoceratiaceae Lindemann 1928
Ceratocorys horrida Stein 1883
ORDEN: Gymnodiniales Apstein 1909
FAMILIA: Gymnodiniaceae Lankester 1885
Amphidinium longum Lohmann 1908
Amphidinium schroederi Schiller 1928
Gymnodinium sp. Stein 1878
Gymnodinium cinctum Kofoid & Swezy 1921
Gymnodinium gracile Bergh 1881
Gymnodinium lohmannii Paulsen 1908
Gyrodinium fusiforme Kofoid & Swezy 1921
Levanderina fissa (Levander) Moestrup et al., 2014
ORDEN: Peridiniales Haeckel 1894
FAMILIA: Kolkwitziellaceae Lindemann, 1928
Diplopsalis lenticula Bergh 1881
FAMILIA: Heterodiniaceae Lindemann, 1928
Heterodinium Kofoid, 1906
FAMILIA: Heterocapsaceae Fensome et al., 1980
Heterocapsa triquetra (Ehrenberg) Stein 1883
FAMILIA: Protoperidiniaceae Balech 1988
Protoperidinium crassipes (Kofoid) Balech 1974
Protoperidinium depressum (Bailey) Balech 1974
Protoperidinium divergens (Ehrenberg) Balech 1974
Protoperidinium laticeps (Grontved & Seidenfaden) Balech 1974
Protoperidinium oceanicum (Vanhöffen) Balech 1974
Protoperidinium ovatum Pouchet 1883
Protoperidinium pentagonum (Gran) Balech 1974
Protoperidinium rectum (Kofoid) Balech 1974
ORDEN: Prorocentrales Lemmermann 1910
FAMILIA: Prorocentraceae Stein 1883
Prorocentrum gracile Schütt 1895
Prorocentrum lima (Ehrenberg) Stein 1878
Prorocentrum micans Ehrenberg 1834
ORDEN: Pyrocystales Apstein 1909
FAMILIA: Pyrocystaceae (Schütt) Lemmermann
Pyrocystis fusiformis Thomson en Murray 1876
Pyrocystis pseudonoctiluca Wyville-Thompson en Murray 1876
ORDEN: Thoracosphaerales Tangen 1982
FAMILIA: Thoracosphaeraceae Schiller 1930
Goniodoma sphaericum Murray & Whitting 1899
Scrippsiella acuminate (Ehrenberg) Kretschmann et al., 2015
CLASE: NOCTILUCOPHYCEAE Fensome et al., 1993
ORDEN: Noctilucales Haeckel 1894
FAMILIA: Noctilucaceae Kent 1881
Noctiluca scintillans (Macartney) Kofoid & Swezy 1921
FAMILIA: Protodiniferaceae Kofoid & Swezy 1921
Pronoctiluca spinifera (Lohmann) Schiller 1932
EUGLENOFITAS PHYLUM: EUGLENOZOA Cavalier-Smith 1981
CLASE: EUGLENOPHYCEAE Schoenichen en Eyferth & Schoenichen 1925
ORDEN: Euglenales Bütschli 1884
FAMILIA: Euglenaceae Dujardin 1841
Euglena sp. Ehrenberg 1830
FAMILIA: Phacaceae Kim, Triemer & Shin 2010 Phacus sp. Dujardin 1841
ORDEN: Eutreptiales Leedale 1967
FAMILIA: Eutreptiaceae Hollande 1942
Eutreptiella gymnastica Throndsen 1969
PHYLUM: OCHROPHYTA Cavalier-Smith en Cavalier-Smiith & Chao 1996
CLASE: DICTYOCHOPHYCEAE Silva 1980
ORDEN: Dictyochales Haeckel 1894
FAMILIA: Dictyochaceae Lemmermann 1901
Dictyocha fibula Ehrenberg 1839
CLASE: RAPHIDOPHYCEAEChadefaud ex Silva 1980
ORDEN: Chattonellales Throndsen 1993
FAMILIA: Chattonellaceae Throndsen 1993
Chattonella marina (Subrahmanyan) Hara & Chihara 1982
FAMILIA: Fibrocapsaceae Cavalier-Smith en Cavalier-Smith & Scoble 2013
Fibrocapsa japonica Toriumi & Takano 1973
CIANOBACTERIAS
PHYLUM: CYANOBACTERIA Stanier ex Cavalier-Smith 2002
CLASE: CYANOPHYCAEA Schaffner 1909
ORDEN: Nostocales Borzì 1914
FAMILIA: Nostocaceae Eichler 1886
Anabaena Bory ex Bornet & Flahault 1886
FAMILIA: Rivulariaceae Bornet & Flahault 1886
Rivularia sp. Agardh ex Bornet & Flahault 1886
ORDEN: Oscillatoriales Schaffner 1922
FAMILIA: Microcoleaceae Strunecky et al., 2013
Trichodesmium thiebautii Gomont ex Gomont 1890
FAMILIA: Oscillatoriaceae Engler 1898
Lyngbya sp. Agardh ex Gomont 1892
Oscillatoria sp. Vaucher ex Gomont 1892
ORDEN: Spirulinales Komárek et al., 2014
FAMILIA: Spirulinaceae (Gomont) Hoffmann, Komárek & Ka en Komárek et al., 2014
Spirulina sp. Turpin ex Gomont 1892
Discusión de resultados
En esta zona del país, no se han realizado estudios sobre la estructura comunitaria del fitoplancton marino, por lo que esta investigación representa un aporte para el conocimiento de su biodiversidad, como parte de un estudio de línea base ambiental. Las microalgas planctónicas constituyen la base de la red trófica, sobre la cual, prosperan los demás elementos que la conforman, debido a que representan la puerta de entrada de la energía solar en el ecosistema pelágico y la base de su mantenimiento. Son fotosintéticos y los principales productores de biomasa y compuestos orgánicos en los océanos (Livingston, 2001).
En cuanto a la estructura comunitaria, la zona en estudio muestra gran heterogeneidad, debido a la presencia de especies oceánicas, tales como la dinofícea: Ornithocercus y bentónicas, como: Diplopsalis, Ostreopisis, Pleurosigma y Odontella, lo cual indica la ocurrencia de procesos de mezcla en la zona (Vila, Garces & Masó, 2001). Por otra parte, la presencia de las cianofitas: Trichodesmium thiebauthii, Lyngbya birgei, Oscillatoria, Rivularia y Spirulina, así comolas euglenofitas: Euglena, Eutreptiella y Phacus, las cuales, son indicadoras de grandes aportes de materia orgánica; evidencia una influencia de aguas de origen doméstico provenientes de las operaciones de la base militar que ahí se encuentra, sin embargo, la dinámica de las corrientes permitiría que estas aguas sean muy diluidas generando muy poco impacto ambiental.
Al comparar con otros estudios realizados en las islas oceánicas del mar Caribe, se consiguen riquezas similares, por ejemplo Pérez-Castresana, Villamizar, Varela y Fuentes, (2014) en su estudio realizado en el Parque Nacional Archipiélago Los Roques, ubicado en la zona central del mar Caribe Venezolano, identificaron 67 especies de 211 morfotipos observados, incluyendo diatomeas de los siguientes géneros: Asterionella, Campylodiscus, Dictyoneis, Ditylum, Guinardia, Haslea, Isthmia, Leptocylindrus, Pseudo-nitzschia, Skeletonema, Striatella, Thalassiosira, Trapidoneis y Triceratium; los dinoflagelados: Ceratocoris, Diplopsalis, Gonyodoma y Scripsiella y las cianobacterias; Lyngbya y Trichodesmium.
Margalef (1969) en su estudio del ecosistema pelágico del NE de Venezuela registró 300 especies fitoplanctónicas, y menciona que con el aporte de otros autores y la información publicada de otras zonas del Caribe, no menos de 450 especies podrían ser encontradas. Actualmente existen trabajos sobre los principales grupos de fitoplancton que citan un mayor número de taxa para el mar Caribe. Para el área del Caribe colombiano se han registrado 523 taxón, identificados en varios estudios a lo largo de la costa, de los cuales 337 taxón corresponden a diatomeas y 186 taxa a dinoflagelados (Lozano-Duque et al., 2010).
Navarro y Hernández-Becerril (1997), con base en una revisión de literatura disponible para el área total del mar Caribe, encontraron 1,083 taxa de diatomeas marinas, 305 taxa pertenecientes a diatomeas centrales y 778 taxa pertenecientes a diatomeas pennales. El número de especies de microalgas planctónicas en el presente estudio es muy bajo en comparación a los citados anteriormente, sin embargo, hay que considerar que Isla de Aves corresponde a una isla coralina alejada de la plataforma continental y que el resto de los estudios incluye zonas productivas por la ocurrencia de surgencia costera y zonas costeras que incluyen ciénagas, lagunas y descargas de ríos al mar.
En general, el fitoplancton estuvo representado por las diatomeas, tanto en número de especies como en abundancia, que en general, suelen ser el grupo más abundante de la comunidad fitoplanctónica, especialmente en áreas costeras, debido a su capacidad de asimilación rápida de nutrientes y su alta tasa reproductiva, lo cual les da el calificativo de especies oportunistas (Triantafyllou et al., 2001; Cetin & Sen, 2004).
Entre las diatomeas más relevantes en el estudio, se encontraron Asteroplanus karianus, Coscinodiscus perforatus, Skeletonema costatum, Leptocylindrus minimus, Nitzschia sp., Leptocylindrus danicus, Asterionella gracilis, Chaetoceros dydimus y Haslea waiwrikae, las cuales, son especies costeras indicadoras de aguas turbulentas (Margalef, 1965). En cuanto a la diatomea Skeletonema costatum, su presencia en la zona este del mar Caribe indica la influencia de aguas del río Amazonas, por lo que S. costatum se asocia a aguas salobres por el aporte de grandes ríos (Ferguson-Wood, 1968). Además de las especies netamente planctónicas, se detectaron especies bentónicas, las cuales sugieren la ocurrencia de fenómenos de mezcla de la columna de agua, que ejercen un intercambio fuerte de especies bentónicas y pelágicas (Lucas, Vidal & Navas, 2001).
En este mismo orden de ideas, Spiniello (1996) señala que el grupo Chrysophyceas a nivel nacional, presenta una riqueza de 385 especies y 25 variedades agrupadas en 99 géneros, de los cuales Coscinodiscus, Chaetoceros, Navicula sp. y Nitzschia sp., reúnen a más del 35% de las especies, tal como se observa en los resultados obtenidos en este estudio. Por su parte, el género Nitzschia crece en ambientes ricos en nutrientes y son capaces de modificar estas condiciones para hacerlo apropiado para el desarrollo de otros representantes del fitoplancton (Barber & Ryther, 1969).
Asimismo, los géneros: Chaetoceros, Leptocylindrus, Nitzschia y Rhizosolenia, son oportunistas y por lo tanto, indicadoras de las primeras etapas de una sucesión ecológica, y el género Asterionellopsis, acompañado de altas densidades de dinoflagelados y cianofitas puede indicar un ambiente con altas concentraciones de nutrientes, pero sin condiciones de eutrofización, característico de aguas afloradas (Margalef, 1969; Bellinger & Sigee, 2010).
Los dinoflagelados constituyen el segundo grupo más representativo en cuanto a riqueza. Estos, representan solo un porcentaje del total del número de organismos donde dominan las diatomeas, a pesar de ser organismos ventajosos respecto a estas, ya que presentan una movilidad que le permite realizar desplazamientos para la búsqueda de nutrientes y áreas con intensidad de luz óptima (Lindenschmidt & Chorus, 1998).
En cuanto a la presencia de la cianobacteria Trichodesmium thiebauthii, este grupo ha sido asociado a fenómenos de eutrofización, debido a su capacidad de sobrevivir en cuerpos de agua con altos niveles de materia orgánica. Aunque esta especie suele ser característica de regiones oligotróficas y un productor primario importante en el océano Atlántico tropical (Staal, Meysman, & Stal, 2003). En general, las cianobacterias han sido usadas como indicadoras de calidad de agua, específicamente de entradas de nutrientes, eutrofización y diferentes formas de contaminación (Paerl & Tuker, 1995). A pesar que la zona presenta poca intervención humana, se considera muy productiva debido a los productos fecales de las aves que ahí habitan, los cuales contribuyen a un incremento en las concentraciones de nutrientes como el fósforo.
En cuanto a la abundancia fitoplanctónica, se obtuvo una densidad más de 40 veces por debajo de los 65,000 células/litro, establecidos para catalogar aguas oligotróficas. De hecho, las densidades estimadas en este estudio están 10 veces por debajo de la obtenida por Pérez-Castresana et al. (2014), en el Parque Nacional Archipiélago Los Roques, y en el mismo orden de magnitud, estimado en la zona de Palanquines en la Isla La Tortuga (RodríguezCenteno, Díaz-Ramos, Charzeddine, Subero-Pino & Troccoli-Ghinaglia, 2010), lo cual establece un indicador local para las islas oceánicas del mar Caribe venezolano, que se caracterizan por presentar aguas oligotróficas, propias de ecosistemas coralinos.
Asimismo, Marshal y Solder (1982) indicaron que a partir de los estudios hechos por el crucero Oregón en el mar Caribe, se obtuvo densidades medias del fitoplancton en las estaciones del este de 13,382 células/ litro, 2,015 cél/l en la zona este central, 1,205 cél/l en la zona oeste central y 1,026 cél/l en las estaciones ubicadas al oeste, lo cual coincide con lo encontrado en este estudio.
En general, la zona marina y costera de Isla de Aves se caracteriza por una comunidad fitoplanctónica diversa, característica de aguas turbulentas, pero para entender mejor estos procesos es necesario el estudio de las condiciones fisicoquímicas del medio y su interrelación con la comunidad planctónica, por lo que se recomienda hacer este tipo de estudios en otras épocas del año, en la que ocurren procesos meteorológicos distintos, tales como tormentas y huracanes, los cuales cambian las condiciones fisicoquímicas del agua y por ende de sus comunidades biológicas.
Agradecimientos
Los autores ofrecen un agradecimiento especial al personal de la Base Científico Naval Simón Bolívar, por toda la colaboración brindada durante la ejecución de las campañas científicas, así como al Servicio de Hidrografía y Navegación (SHN), la Cancillería de la República Bolivariana de Venezuela y el Ministerio del Poder Popular para el Ecosocialismo; por la organización de las campañas científicas y el apoyo logístico para la participación de las universidades e instituciones de investigación del país.
Referencias bibliográficas
Al-Yamani, F. & Saburova, M. (2011). Illustrated guide on the benthic diatoms of Kuwait’s Marine Environment. Kuwait: Kuwait Institute for Scientific Research.
Arrigo, K., Robinson, D., Worthen, D., Dunbar, R., Ditullio, G., Vanwoert, M. & Lizotte, M. (1999). Phytoplankton community structure and the drawndown of nutrients and CO2 in the Southern Ocean. Science, 283: 365 - 367. doi:10.1126/science.283.5400.365.
Balech, E. (1988). Los dinoflagelados del Atlántico Sudoccidental. Publicaciones del Instituto Español de Oceanografí. Madrid: Ministerio de Agricultura, Pesca y Alimentación. Secretaría General Técnica.
Barber, R. & Ryther, J. (1969). Organic chelators: factors affecting primary production in the cromwell current upwelling. Journal of Experimental Marine Biology and Ecology 3: 191 - 199. doi: 10.1016/0022-0981(69)90017-3.
Bellinger, E. & Sigee, D. (2010). Freshwater algae. Oxford: Walley-Blackwell.
Berárd-Therriault, L., Poulin, M. & Bossé, L. (1999). Guide d` identification du phytoplankton marin de lèstuarie et du Golfe de Saint-Laurent. Incluant également certains protozoaries. Otawa: Conseil Nacional de Recherches du Canadá.
Cetin, M. & Sen, M. (2004). Seasonal distribution of phytoplankton in Orduzu Dam Lake (Malatya, Turkey). Turk Journal Botanical 28: 279-285. doi: 10.1.1.685.9868
Chretiennot-Dinet, M., Sournia, A., Ricard, M. & Billard, C. (1993). A classification of the marine phytoplankton of the world from class to genus. Phycologa 32 (3): 159-179. doi: 110.2216/i0031-8884-32-3-159.1
Cupp, E. (1943). Marine plankton diatoms of the West Coast of North America. Bulletin of the Scripps Institution of Oceanography of the University of California. 5(1), 1-238. Recuperado de http://aquaparadox.obs-vlfr.fr/html/PFD/Taxonomic%20Monographs/Cupp1973.pdf
Ferguson, J. (1968). Dinoflagellates of the Caribbean Sea and adjacent areas. University of Miami Press. Florida.
Ferguson-Wood, E. (1968). Studies of phytoplankton ecology in tropical and subtropical environments of the Atlantic Ocean. Part 3. Phytoplankton communities in the Providence channels and the Tongue of the Ocean. Bulletin of Marine Science 18 (2): 481-543.
Gruber, W. (2003). Isla de Aves. (Trabajo de Ascenso). Universidad Central de Venezuela, Venezuela.
Guada, H. & Solé, G. (2000). Plan de Acción para la Recuperación de las Tortugas Marinas de Venezuela. Suárez, A. (ed.). (Informe Técnico del PAC No. 39). UNEP, Caribean EnvirometProgramme, Kingston, Jamaica.
Guiry, M. & Guiry, G. (2018). AlgaeBase. Worldwide electronic publication, National University of Ireland, Galway. Recuperado de http://www.algaebase.org.
Hammer, O., Harper, D. & Ryan, P. (2001). PAST: Paleontological Statistics software package for education and data analysis. Paleantología Electrónica, 4 (1), 9. doi: 10.1.1.459.1289.
Hubschmannat et al., (1988). Isla de Aves, Bastión venezolano en el mar Caribe. Caracas: Dirección de Geografía y Cartografía Militar, Ministerio de la Defensa.
Lindenschmidt, K. & Chorus, I. (1998). The effects of water column mixing on phytoplankton succession, diversity and similarity. Journal of Plankton Research 20(10): 1927-1951. doi: 10.1093/plankt/20.10.1927.
Livingston, R. (2001). Eutrophication processes in coastal systems: origin and succession of plankton blooms and effects on secondary production in Gulf Coast Estuaries. Center for Aquatic Research and Resource Management. Press. Florida: Florida State University, CRC Press.
Lozano-Duque, Y., Vidal, L. & Navas, G. (2010). La comunidad fitoplanctónica en el mar Caribe colombiano. En: INVEMAR (eds.). 2010.
Biodiversidad del margen continental del Caribe colombiano. Santa María: Serie de Publicaciones Especiales, Invemar.
Lucas, C., Banham, C. & Holligan, P. (2001). Benthic-pelagic exchange of microalgae at a tidal flat. 2. Taxonomic analysis. Marine Ecology 212: 39-52. doi: 10.3354/meps212039.
Luz, B. & Barkan, E. (2000). Assessment of Oceanic productivity with the triple-isotope composition of dissolved oxygen. Science 288: 20282031. doi: 10.1126/science.288.5473.2028.
Margalef, R. (1965). Composición y distribución del fitoplancton. Sociedad de Ciencias Naturales La Salle 25 (70-72): 141 - 205.
Margalef, R. (1969). El ecosistema pelágico del mar Caribe. Sociedad de Ciencias Naturales La Salle 29(82): 5 - 36.
Marshall, H. & Solder, J. (1982). Pelagic phytoplankton of the Caribbean Sea. Bulletin of Marine Science 32: 354 - 365.
Navarro, J. & Hernández-Becerril, D. (1997). Listados Florísticos de México. xv . Check-list of Marine Diatoms from the Caribbean Sea. Ciudad de México: UNAM, Instituto de Biología.
Paerl, H. & Tucker, C. (1995). Ecology of bluegreen algae in acuacultura ponds. Journal of the World Aquaculture Society 26(2): 109-131. doi: 10.1111/j.1749-7345.1995.tb00235.x.
Peragallo, M. (1965). Diatomés marines du France. Amsterdam: A Asher Co.
Pérez-Castresana, G., Villamizar, E., Varela, R. & Fuentes, Y. (2014). Descripción preliminar del fitoplancton en seis arrecifes coralinos del parque nacional Archipiélago de Los Roques. Acta Biológica Venezuelica 34(2): 293-309.
Rodríguez-Centeno, M., Díaz-Ramos, J., Charzeddine, L., Subero-Pino, S. & TroccoliGhinaglia, L. (2010). Abundancia del fitoplancton en la isla la Tortuga, Dependencia Federal, Venezuela. Boletin do Instituto Oceanográfico 49 (1): 77-86.
Round, F., Crawford, R. & Mann, D. (1990). The Diatoms, Biology & Morphology of the Genera. Cambridge: Cambridge University Press.
Saunders, R. & Glenn, E. (1969). Diatoms. Memoirs of the Hourglass Cruises. Vol X. Florida: Department of Natural Resources Marine Research Laboratory. St. Petersburg.
Siqueiros, D., Valenzuela, A., Hernández, O., Argumedo, U. & López, F. (2004). Catálogo iconográfico de diatomeas de hábitats rocosos y su incidencia en la dieta de abulones (Haliotis spp.) jóvenes de Baja California Sur, Oceánides 19 (2): 29-103.
Siqueiros, D. & Hernández, O. (2006). Floristics of epiphytic diatoms in a patch of subtropical macroalgae. CICIRMAROceánides 21(1,2): 11-61.
Soler, A., Pérez, M. & Aguilar, E. (2003). Diatomeas de las costas del pacífico en Panamá. Agenda del Centenario. Universidad de Panamá-Vicerectoría de Investigación y Postgrado. Panamá
Sournia, A. (1986). Atlas du phytoplankton marin. Vol 1.París: Centre National de la Recherche Scientifique.
Spiniello, P. (1996). Las diatomeas marino-costeras de Venezuela. Caribbean Journal of Science 32 (4): 331-347.
Staal, M., Meysman, F. & Stal, L. 2003. Temperature excludes N2-fixing heterocystous cyanobacteria in the tropical oceans. Nature 425: 504 507. doi: 10.1038/nature01999. Tomas, C. (1996). Identifying marine diatoms and dinoflagellates. New York: Academic Press.
Triantafyllou, G., Petihakis, G., Dounas, C. & Athanasios, T. (2001). Assessing marine ecosystem response to nutrient imputs. Marine Pollution Bulletin 43(7-12): 175-186. doi: 10.1016/ S0025-326X(01)00071-6.
Troccoli, L. (2001). Cambios estructurales del fitoplancton costero tropical en una zona cárstica: Perspectivas en escala espacial. (Tesis de doctorado). Centro Nacional y de Estudios Avanzados del Instituto Politécnico Nacional Unidad Mérida. Yucatán, México.
Vila, M., Garces, E. & Masó, M. (2001). Potentially toxic epiphytic dinoflagellate assemblages on macroalgae in the NW Mediterranean. Aquatic Microbial Ecology 26: 51-60. doi: 10.3354/ ame026051.
Yamaji, I. (1996).Illustration of the marine plankton of Japan. Osaka: Hoikusha Publishers.
Yilmaz, N., Yardimci, C., Elhag, M. & Dumitrache, C. (2018). Phytoplankton Composition and Water Quality of Kamil Abdu¸s Lagoon (Tuzla Lake), Istanbul-Turkey. Water 10(5), 603doi: 10.3390/ w10050603.
Yranzo, A., Villamizar, E., Romero, M. & Boadas, H. (2014). Estructura de las comunidades de corales y octocorales de Isla de Aves, Venezuela, Caribe Nororiental. Revista de Biología Tropical 62(3): 115-136. doi: 10.15517/rbt.v62i0.15907.
