1. Simplificaciones excesivas y didáctica de las Ciencias Biológicas
En la enseñanza de las ciencias, con frecuencia se recurre a simplificaciones como forma de dar respuesta a cuestiones cuya explicación, sin ser necesariamente compleja, requiere tratar el asunto en mayor profundidad, nivel que puede no estar al alcance de los estudiantes en ese momento preciso del aprendizaje. No obstante, estas explicaciones que pretenden ser una forma conveniente de aproximación al problema, pueden dar lugar a ideas incorrectas que se perpetúan indefinidamente a lo largo del aprendizaje de los alumnos.
Particularmente, en la enseñanza de las Ciencias Biológicas a menudo se justifica la elevada energía de hidrólisis del trifosfato de adenosina (ATP), recurriendo a un supuesto tipo de “enlace ricoenergético” que es capaz de almacenar la energía de un modo extraordinario.
2. Notación del Lipmann, enlaces y grupos fosfato “de alta energía”
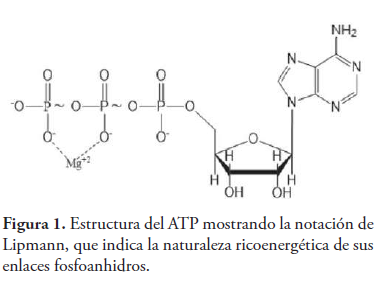
En la actualidad, la notación de Lipmann, en la que se emplea el símbolo ~ (virgulilla) para denotar dicha singularidad bioquímica de los enlaces fosfoanhidros del ATP (Lipmann, 1941) (ver figura 1), se sigue utilizando en los libros de textos universitarios de Biología (Solomon et al., 2007); Bioquímica (Murray et al., 2010; Smith et al., 2006; Bettelheim, Brown, Campbell, Farrell & Torres, 2012; Harvey & Ferrier, 2014); y demás disciplinas relacionadas a las ciencias de la vida (Brock & Madigan, 1993).
En otras ocasiones la elevada energía de hidrólisis del ATP no es atribuida a los enlaces fosfoanhidro, sino a los grupos fosfato, refiriéndose a ellos como “grupos fosfato de alta energía”. Según esta idea, el ATP contiene dos grupos fosfato de alta energía, el ADP sólo uno, y el AMP ninguno, considerándose a este último como un grupo fosfato normal (Murray et al., 2010).Esto induce a creer que existen grupos fosfato normales y grupos fosfato especiales, en cuanto al contenido energético se refiere.
3. La asimilación de conceptos erróneos y sus consecuencias
Este tipo de explicaciones son especialmente frecuentes en libros de educación secundaria (Lauría, 2015; Galindo, Avendaño & Angulo, 2012; García, 2015; Alonso et al., 2004), con lo cual, el error surge y queda asimilado como un concepto básico desde los primeros contactos de los estudiantes con la Biología.
Todo esto puede llevar a pensar a los estudiantes que los enlaces entre los grupos fosfato del ATP son intrínsecamente diferentes a otros enlaces covalentes, dando la impresión de que las leyes de la física y de la química no son válidas para la química de los seres vivos, lo cual sería admitir un enfoque vitalista en la enseñanza de la bioquímica, que es, a nuestro entender, incorrecto.
4. Hacia una explicación más realista de la cuestión
4.1 Repulsión electrostática, resonancia opuesta y energía de deslocalización
Una explicación más rigurosa al hecho de que la hidrólisis del ATP tenga lugar con una variación de energía libre estándar considerable (.G°’= -30.5 kJ/mol (7.3 Kcal/mol)); requiere en realidad un análisis más profundo, y es preciso señalar a priori que no se debe únicamente a los enlaces fosfoanhidros característicos de la molécula, sino que son varios los factores que contribuyen a esta supuesta anomalía.
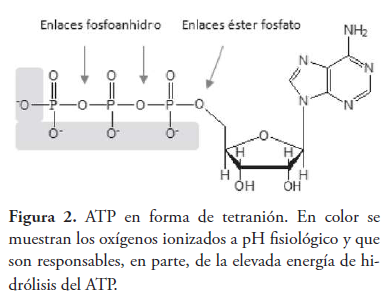
En primer lugar, podríamos citar a la repulsión electrostática entre los oxoaniones, debido a que a pH fisiológico el ATP se encuentra en forma de tetranión (Bohinski, 1991) (ver figura 2), siendo esta la razón por la que el ATP suele representarse asociado a Mg2+, que ayuda a disminuir la repulsión entre los átomos de oxígeno ionizados. Por otra parte, si admitimos que la repulsión de cargas es un factor de inestabilidad en el ATP, parece lógico aceptar que su disminución, tras la hidrólisis de los enlaces fosfoanhidros, será un factor que contribuya a su elevada energía libre de hidrólisis.
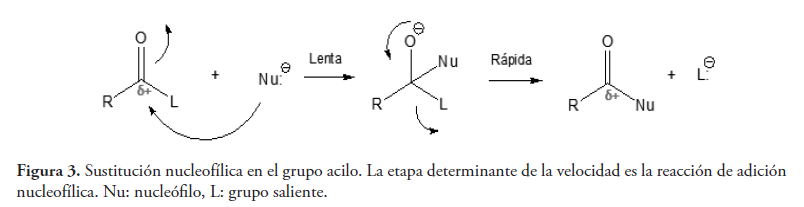
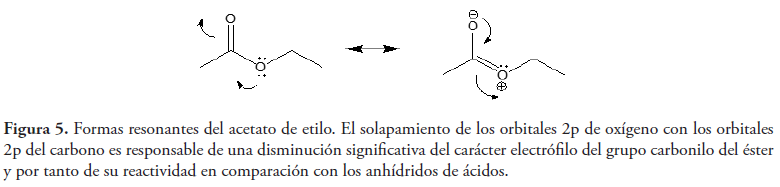
En segundo lugar, tenemos el fenómeno de resonancia opuesta (Bohinski, 1991). Éste es un concepto que frecuentemente se usa en química orgánica para explicar la diferente reactividad existente entre ésteres y anhídridos, en la sustitución nucleofílica en el grupo acilo, reacción característica de los derivados de ácidos carboxílicos (ver figura 3). Ésta es una reacción de adición-eliminación en la que la primera etapa (adición), es la que determina la velocidad (Carey, 2006; McMurry, 2012), como se puede ver en la figura 3, y por tanto, las explicaciones sobre las diferencias de reactividad observadas entre los diferentes derivados de ácidos carboxílicos, deberán circunscribirse principalmente a esta etapa de adición y no a la de eliminación.
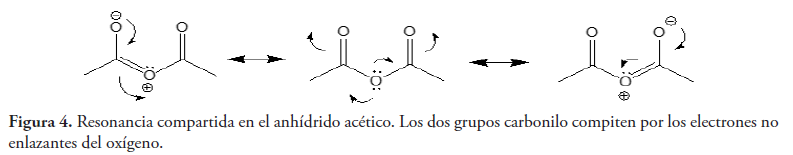
Los anhídridos de ácidos carboxílicos son mucho más reactivos que los ésteres, debido a que uno de los pares de electrones no enlazantes del oxígeno puede deslocalizarse hacia cualquiera de los dos grupos carbonilo del anhídrido (Carey, 2006) (ver figura 4), mientras que en el caso del éster sólo existe una posibilidad, lo que lo hace menos reactivo (ver figura 5). La resonancia opuesta en el caso del anhídrido es responsable de que siempre exista una forma resonante en la que el carbono carbonílico es mucho más reactivo.
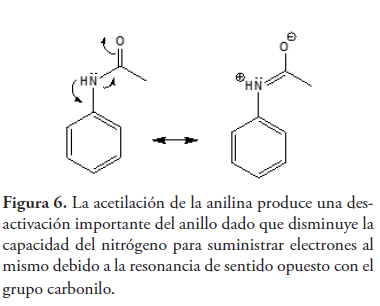
Dicho fenómeno también nos permite explicar la menor reactividad de la acetanilida frente a la anilina en la sustitución electrofílica aromática, como es el caso de la nitración o la halogenación
(Geissman, 1973). Tal como se muestra en la figura 6, la deslocalización del par de electrones no enlazante del nitrógeno de la acetanilida hacia el grupo carbonilo, en competencia con el anillo aromático, tiene como resultado una menor reactividad de esta amida en comparación con la anilina. La arilamina es, por lo tanto, mucho más reactiva frente a la sustitución electrofílica.
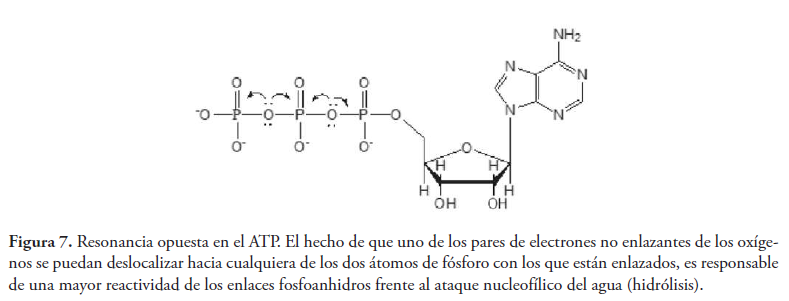
De la misma manera, en el ATP los pares de electrones no enlazantes de los oxígenos pueden deslocalizarse en sentido opuesto hacia dos átomos de fósforo, lo que aumenta la reactividad de los grupos fosfato por tener estos un carácter electrofílico mayor (ver figura 7).
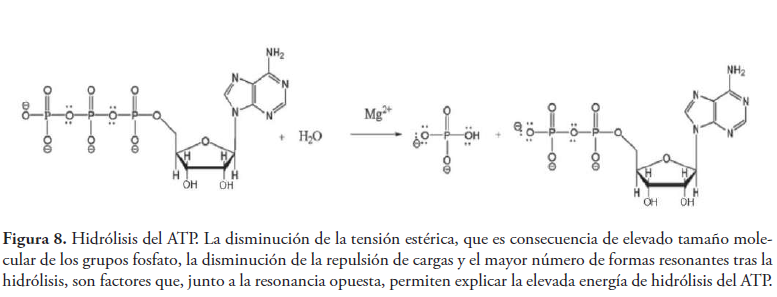
Adicionalmente, el aumento del número de formas resonantes del grupo fosfato durante la hidrólisis del ATP y la energía de resonancia o deslocalización asociada, es probablemente otro factor que contribuye a la importante variación de energía libre que caracteriza a la reacción (ver figura 8).
4.2 Factores estéricos y alejamiento de la posición de equilibrio
Además de factores electrónicos también podemos encontrar factores estéricos, debido al elevado volumen molecular que poseen los grupos fosfato en la molécula de ATP. Tras la hidrólisis, esta tensión estérica queda reducida, aumentando la libertad conformacional y por tanto la entropía del sistema. Este es un factor que también contribuye a incrementar la energía liberada durante la hidrólisis del ATP.
En cualquier caso, es preciso señalar que el papel del ATP como moneda energética en la química celular sólo es posible debido a que las células son capaces de mantener su reacción de hidrólisis muy alejada de la posición de equilibrio. Concretamente las mitocondrias son capaces de alcanzar, en el medio de incubación, un valor del cociente [ADP][Pi]/ [ATP] de tan sólo 10-5. Si tenemos en cuenta este último dato y que en equilibrio, a pH fisiológico, [ADP][Pi]/[ATP] = 105 (American Chemical Society, 2007; Nicholls, 1987), podremos concluir que las células mantienen la reacción de hidrólisis del ATP alejada de la situación de equilibrio en 10 órdenes de magnitud (Nicholls, 1987).
5. Conclusiones
Con el objeto de evitar que los estudiantes asimilen ideas incorrectas sobre la naturaleza de los enlaces que encontramos en las biomoléculas, sugerimos prescindir de la notación de Lipmann. De esta manera, a nivel preuniversitario, proponemos que las explicaciones sobre el papel del ATP en el metabolismo celular se enfoquen en su elevado contenido energético, atribuyéndose éste a varios factores, que deberán relacionarse con la estructura molecular y no con enlaces singulares. El docente deberá reflexionar sobre la conveniencia de profundizar o no en esta cuestión, antes de que los estudiantes tengan los niveles competenciales necesarios en química, que les permitan abordar el problema con el debido rigor científico.
6. Referencias
Alonso, F., García, G., Govea, A., Govea, R., Hernández, G., Téllez, M., Peña J. & Quiroga, M. (2004). Fascículo 2. ¿Qué es una célula, cuál es su estructura, cómo funciona y qué significado tiene para los seres vivos? En Biología 1 (Compendio Fascicular). México, Colegio de Bachilleres.
American Chemical Society. Química. Un proyecto de la ACS (2007). Barcelona, Editorial Reverté.
Bettelheim F., Brown W., Campbell M., Farrell S. & Torres, O. (2012). Introduction to general, organic and biochemistry (9 ed.). California, Nelson Education.
Bohinski, R. (1991). Bioquímica (5 ed.). México, Addison Wesley Iberoamericana S. A.
Brock T. D. & Madigan M. T. (1993).Biología de los Microorganismos. (10 ed.). Ciudad de México, Prentice-Hall.
Carey, F. (2006). Química Orgánica (6 ed). México, McGraw-Hill.
Galindo A., Avendaño R. & Angulo, A. (2012). Biología Básica Primer Año (8 ed). México, Universidad Autónoma de Sinaloa. Dirección General de Escuelas Preparatorias. Academia Estatal de Biología.
García, I. (2015). Biología. México, Secretaría de Educación Pública.
Geissman, T. (1973). Principios de Química Orgánica (2 ed). España, Reverté.
Harvey R. & Ferrier D. (Eds). (2014). Bioquímica, Serie Lippincott Illustrated Reviews (6 ed.). Philadelphia, Wolters Kluwer Lippincott William & Wilkins.
Lauría, L. (2015). Biología 1. Ciudad de México, Grupo Editorial Patria.
Lipman, F. (1941). Metabolic Generation and Utilization of Phosphate Bond Energy. Advances in Enzymology and Related Subjetcs of Biochemistry, 1, 99-162.
McMurry, J. (2012). Química Orgánica (8 ed). México, Cengage Learning Editores S. A.
Murray R., Bender D., Botham K., Kennelly P., Rodwell V.& Weil P. (2010). Bioquímica (28 ed). Ciudad de México, McGraw Hill.
Nicholls, D. (1987). Bioenergética, introducción a la teoría quimiosmótica. Barcelona, Editorial Reverté.
Solomon E., Mader S., Curtis H., Barnes S., Berg R., Martin D. & Villee C. (2007). Biología (9 ed.). México, Cengage Learning.
Smith C., Marks D. & Lieberaman M. (2006). Bioquímica Básica (2 ed). McGraw Hill.
